
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энтропия. Второй закон термодинамики (формулировка и математическое выражение). Обратимые и необратимые в термодинамическом смысле процессы.
Второй закон термодинамики (второе начало термодинамики): Самопроизвольно протекают процессы, приводящие к увеличению общей энтропии системы и окружающей среды ΔSсист + ΔSсреды ≥ 0 или ΔS ≥ 0 Для химической реакции изменение энтропии Энтропия (S) -мера энергетического беспорядка в системе, мера хаоса, мера той энергии, которая рассеивается в виде тепла и не превращается в работу. Изменение энтропии ∆S наиболее просто определяется для обратимых изотермических процессов, оно равняется тепловому эффекту процесса, делённому на абсолютную температуру. Энтропия – экстенсивная функция. Энтропия системы равна сумме энтропий составных частей. Её изменение зависит только от начального и конечного состояния системы и не зависит от пути перехода. Энтропию относят к 1 молю вещества в стандартных условиях S°298; измеряют ее в энтропийных единицах (э.е.): 1 Дж/мoль*К = 1 э.е. Больцман постулировал, что энтропия связана с термодинамической вероятностью логарифмической зависимостью
S = k ln W уравнение Больцмана k – константа Больцмана: k = 1,38∙10-23 Дж/градус; W – число микросостояний, с помощью которых можно реализовать данное макросостояние: Р – вероятность того, что система находится именно в этом микросостоянии. Термодинамически обратимый процесс – процесс, протекающий в прямом и в обратном направлении без изменений в системе и в окружающей среде, т.е. при переходе из начального состояния в конечное все промежуточные состояния являются равновесными. При наличии неравновесных промежуточных состояний процесс считают термодинамически необратимым. Энергия Гиббса. Прогнозирование направления самопроизвольно протекающих процессов в изолированной и закрытой системах; роль энтальпийного и энтропийного факторов. Термодинамические условия равновесия. Энергия Гиббса – функция состояния, являющаяся критерием самопроизвольности процессов в открытых и закрытых системах. G=H–TS H- энтальпия, Т- температура, S- энтропия. Используя энергию Гиббса, второй закон термодинамики можно выразить так: При постоянстве температуры и давления в системе самопроизвольно протекают только процессы, ведущие к уменьшению энергии Гиббса. В состоянии равновесия энергия Гиббса равна нулю ∆G ≤0 (р, Т=const)
При ∆G<0 реакция самопроизвольно протекает в прямом направлении; ∆G>0 в обратном направлении ∆G=0 реакция находится в состоянии равновесия. Изменение ЭГ определяется формулой: ΔG=ΔH–TΔS Стандартная ЭГ определяется формулой:
где
Критериями направления самопроизвольного протекания необратимых процессов являются неравенства ΔG< 0 (для закрытых систем),ΔS> 0 (для изолированных систем). Самопроизвольное течение реакций в закрытых системах контролируется как энтальпийным (ΔrH), так и энтропийным (ΔrS) фактором. Для реакций, у которых ΔrH< 0 и ΔrS> 0, энергия Гиббса всегда будет убывать, т.е. ΔrG< 0, и такие реакции могут протекать самопроизвольно при любых температурах В изолированных системах энтропия максимально возможное для данной системы значение Smax; в состоянии равновесия ΔS= 0.
|
|||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 404; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.163.58 (0.006 с.) |
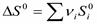 прод -
прод - 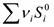 исх
исх




