
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Раствор как гомогенная система. Растворитель, растворенное вещество. Классификация растворов по степени дисперсности, по растворимости в воде, по способности к диссоциации.Стр 1 из 18Следующая ⇒
Раствор как гомогенная система. Растворитель, растворенное вещество. Классификация растворов по степени дисперсности, по растворимости в воде, по способности к диссоциации. Растворы - гомогенные системы, состоящие из растворителя, растворенного вещества и продуктов их взаимодействия. Вещества, составляющие раствор, называют компонентами реакции. Растворитель - тот компонент, который в растворе находится в том же агрегатном состоянии, что и до растворения. В лабораторной практике различают концентрированные растворы (содержание растворенного вещества соизмеримо с содержанием растворителя) и разбавленные растворы (содержание растворенного вещества мало по сравнению с содержанием растворителя). Иногда растворы определяют как дисперсные системы. При этом растворитель, в котором распределено вещество, называется дисперсной средой, а частицы растворенного вещества - дисперсной фазой. По степени дисперсности различают 1) Взвеси- это дисперсные системы, в которых размеры распределенных частиц сравнительно велики (10^-7-10^-5м). Делятся на: суспензии (распределенное вещ-во твердое) и эмульсии (распределенное вещество жидкое). Взвеси неустойчивы, частицы диспергированного вещ-ва выпадают в осадок либо всплывают. Процесс разделения взвесей для суспензий-седиментация, для эмульсий-расслоение. 2) Коллоидные системы-частицы распределенного вещества имеют размеры порядка 10^-9-10^-7 м. Каждая частица может содержать большое число атомов или молекул. Видны в ультрамикроскоп, где свет падает сзади либо сбоку. 3) Истинные растворы-диспергированное вещ-во распределено в среде в виде молекул или ионов, частицы имеют размеры порядка 10^-10-10^-7м. Растворы однородные, устойчивые. Классификация по растворимости в воде:
Электролитическая диссоциация воды. Ионное произведение воды. Водородный и гидроксильный показатели. Расчет рН и рОН растворов. Электролитическая диссоциация – это процесс распада молекул веществ на ионы под действием полярных молекул растворителя, а также при их расплавлении.
Вода представляет собой слабый амфотерный электролит: Н2О ↔ Н+ + ОН- или, более точно: 2Н2O ↔ H3O+ + OH - Если к чистой воде прибавить кислоту, концентрация ионов водорода повысится и станет больше, чем 10-7 моль/л, среда станет кислой, при этом концентрация ионов гидроксила мгновенно изменится так, чтобы ионное произведение воды сохранило свое значение [H+] + [OH-] = 10-14 Водородный показатель рН равен отрицательному десятичному логарифму концентрации ионов водорода: рН = - lg[H+] 7. Степень диссоциации (α) электролита как количественная характеристика равновесия процесса ионизации. Деление электролитов на сильные и слабые по величине степени диссоциации. Факторы, влияющие на величину степени диссоциации. Степень диссоциации – это отношение числа распавшихся на ионы молекул вещества к общему числу его молекул в растворе:
Электролиты со степенью диссоциации больше 0,3 (30%)-сильные. От 0,03(3%) до 0,3 (30%)-средние Менее 0,03(3%)-слабые Степень электролитическое диссоциации зависит от природы электролита, его концентрации и температуры. БУФЕРНЫЕ РАСТВОРЫ Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая и белковая. Механизм их действия. Бикарбонатный буфер. Он составляет 53 % буферной ёмкости и представлен: Н2СО3 NaHCO3 Соотношение 1: 20 Бикарбонатный буфер представляет собой основную буферную систему плазмы крови; он является системой быстрого реагирования, так как продукт его взаимодействия с кислотами СО2 – быстро выводится через легкие. Помимо плазмы, эта буферная система содержится в эритроцитах, интерстициальной жидкости, почечной ткани. Механизм действия. В случае накопления кислот в крови уменьшается количество НСО3- и происходит реакция: НСО3- + Н+ ↔ Н2СО3 ↔ Н2О + СО2↑. Избыток удаляется лёгкими. Однако значение рН крови остаётся постоянным, так как увеличивается объём лёгочной вентиляции, что приводит к уменьшению объёма СО2 При увеличении щелочности крови концентрация НСО3- увеличивается: Н2СО3 + ОН- ↔ НСО3- + Н2О.
Это приводит к замедлению вентиляции лёгких, поэтому СО2 накапливается в организме и буферное соотношение остаётся неизменным Фосфатный буфер Составляет 5 % буферной ёмкости. Содержится как в крови, так и в клеточной жидкости других тканей, особенно почек. В клетках он представлен солями К2НРО4 и КН2РО4, а в плазме крови и в межклеточной жидкости Na2HPO4 и NaH2PO4. Функционирует в основном в плазме и включает: дигидрофосфат ион Н2РО4- и гидрофосфат ион НРО42-. Отношение [HPO4 2- ]/[H2PO4-] в плазме крови (при рН = 7,4) равно 4: 1. Следовательно, эта система имеет буферную ёмкость по кислоте больше, чем по основанию. Например, при увеличении концентрации катионов Н+ во внутриклеточной жидкости, например, в результате переработки мясной пищи, происходит их нейтрализация ионами НРО4 2-: Н + + НРО4 2- ↔ Н2РО4 1- Образующийся избыточный дигидрофосфат выводится почками, что приводит к снижению величины рН мочи. При увеличении концентрации оснований в организме, например при употреблении растительной пищи, они нейтрализуются ионами Н2РО4 1-: ОН ‾ + Н2РО4 1- ↔ НРО4 2- + Н2О Образующийся избыточный гидрофосфат выводится почками, при этом рН мочи повышается. Выведение тех или иных компонентов фосфатной буферной системы с мочой, в зависимости от перерабатываемой пищи, объясняет широкий интервал значений рН мочи – от 4,8 до 7,5. Фосфатная буферная система крови характеризуется меньшей буферной ёмкостью, чем гидрокарбонатная, из-за малой концентрации компонентов крови. Однако эта система играет решающую роль не только в моче, но и в других биологических средах – в клетке, в соках пищеварительных желез. Гемоглобиновый буфер Составляет 35 % буферной ёмкости. Главная буферная система эритроцитов, на долю которой приходится около 75% всей буферной ёмкости крови. Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и СО2. Гемоглобиновая буферная система крови играет значительную роль сразу в нескольких физиологических процессах: дыхании, транспорте кислорода в ткани и в поддержании постоянства рН внутри эритроцитов, а в конечном итоге – в крови. Она представлена двумя слабыми кислотами – гемоглобином и оксигемоглобином и сопряженными им основаниями – соответственно гемоглобинат- и оксигемоглобинат-ионами: HHb ↔ H+ + Hb- HHbO2 ↔ H+ HbO2- Оксигемоглобин – более сильная кислота (рКа = 6,95), чем гемоглобин (рКа = 8,2). При рН = 7,25 (внутри эритроцитов) оксигемоглобин ионизирован на 65%, а гемоглобин – на 10%, поэтому присоединение кислорода к гемоглобину уменьшает значение рН крови, так как при этом образуется более сильная кислота. С другой стороны, по мере отдачи кислорода оксигемоглобином в тканях значение рН крови вновь увеличивается. Буферные свойства ННb прежде всего обусловлены возможностью взаимодействия кислореагирующих соединений с калиевой солью гемоглобина с образованием эквивалентного количества соответствующей калийной соли кислоты и свободного гемоглобина: КНb + Н2СО3 ↔ КНСО3 + ННb. Образующийся гидрокарбонат (КНСО3) уравновешивает количество поступающей Н2СО3, рН сохраняется, так как происходит диссоциация потенциальных молекул Н2СО3 и образовавшихся гемоглобиновых кислот. Именно таким образом поддерживается рН крови в пределах нормы, несмотря на поступление в венозную кровь огромного количества СО2 и других кислореагирующих продуктов обмена.
В капиллярах лёгких гемоглобин (ННb) поглощает кислород и превращается в HHbO2, что приводит к некоторому подкислению крови, вытеснению некоторого количества Н2СО3 из бикарбонатов и понижению щелочного резерва крови, а в тканях отдает его и поглощает СО2. В лёгких: ННb + O2 ↔ HHbO2; HHbO2 + HCO3- ↔ HbO2 + H2O + CO2 ↑ В тканях: HbO2 ↔ Hb- + O2; Hb- + Н2СО3 ↔ ННb + HCO3- Кроме того, гемоглобиновый буфер является сложным белком и действует как белковый буфер. Белковый буфер Составляет 5 % буферной ёмкости. Он состоит из белка-кислоты и его соли, образованной сильным основанием. Pt – COOH - белок-кислота Pt – COONa – белок-соль При образовании в организме сильных кислот они взаимодействуют с солью белка. При этом получается эквивалентное количество белок-кислоты: НС1 + Pt-COONa ↔ Pt-COOH + NaCl. По закону разбавления В.Оствальда увеличение концентрации слабого электролита уменьшает его диссоциацию, рН практически не меняется. При увеличении щелочных продуктов они взаимодействуют с Pt-СООН: NaOH + Pt-COOH ↔ Pt-COONa + H2O Количество кислоты уменьшается. Однако концентрация ионов Н+ увеличивается за счет потенциальной кислотности белок-кислоты. поэтому практически рН не меняется. Белок – это амфотерный электролит и поэтому проявляет собственное буферное действие. Основные показатели КОР. · В норме рН крови равно 7,4. смещение рН в сторону увеличения называется алкалозом, а в сторону уменьшения – ацидозом. Различают респираторный и метаболический ацидоз и алкалоз. · Парциальное давление СО2 в норме составляет 40 мм рт.ст. Снижение этого показателя наблюдается при дыхательном алкалозе и метаболическом ацидозе. Повышение давления СО2 отмечается при дыхательном ацидозе и метаболическом алкалозе. · Щелочной резерв крови. Это количество мл СО2, находящегося в крови, в расчете на 100 мл сыворотки крови. Норма – 55 %. Уменьшение резервной щелочности свидетельствует об уменьшении содержания бикарбонатов в организме, а увеличение её – об увеличении их. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Комплексные соединения это молекулярные или ионные соединения, образующиеся путем присоединения к атому или иону металла или неметалла, нейтральных молекул или других ионов. Они способны существовать как в кристалле, так и в растворе.
Предмет химической термодинамики. Основные понятия термодинамики. Интенсивные и экстенсивные параметры. Функции состояния. Внутренняя энергия. Работа и теплота. Предметом изучения химической термодинамики являются превращения различных видов энергии при протекании химических реакций, процессов растворения, испарения, кристаллизации, адсорбции Химическая термодинамика количественно определяет тепловые эффекты вышеперечисленных процессов, выясняет возможность самопроизвольного их протекания в том или ином направлении и условия, при которых химические реакции будут находиться в состоянии равновесия. Ассимиляция или анаболизм - совокупность процессов усвоения и переработки поступающих из окружающей среды веществ, а также синтеза и накопления ВМС живыми организмами. Одновременно в организме протекают противоположные процессы – диссимиляция или катаболизм - разложение сложных органических соединений, окисление их до Н2О, СО2 и высвобождение энергии. Химическая термодинамика - это раздел химии, изучающий взаимопревращения теплоты и энергии при протекании химической реакции. Термодинамическая система - это тело или группа тел, взаимодействующих между собой, и отделенных от окружающей среды реальной или воображаемой поверхность раздела. Ф а з а - совокупность частей системы, тождественных по химическому составу и термодинамическим свойствам и находящихся между собой в термодинамическом равновесии. Рассматриваемая фаза отделена от сосуществующих с ней поверхностью раздела. Различают непрерывные и прерывные фазы. Реакция является гомогенной, если реагирующие вещества находятся в одной фазе, а если в разных фазах- гетерогенной. Экстенсивные параметры — это параметры, которые зависят от количества вещества системы и суммируются при объединении систем. Интенсивные параметры — это параметры, которые не зависят от количества вещества и выравниваются при объединении систем. Функция состояния — это характеристика системы, которая не поддается прямому измерению, а рассчитывается через параметры состояния. Значение функции состояния не зависит от способа его достижения, а только от начального и конечного состояния системы. Внутренняя энергия — сумма всех видов энергий движения и взаимодействия частиц, составляющих систему. Теплота — форма передачи энергии путем хаотического движения микрочастиц. Работа — форма передачи энергии путем направленного движения макросистемы, как целого. 2. Типы термодинамических систем (изолированные, закрытые, открытые). Приведите примеры. Термодинамическая система – это любой материальный объект, отделѐнный от окружающей среды реальной или воображаемой поверхностью раздела, выбранный для рассмотрения. Изолированная система – это система, которая не обменивается с окружающей средой ни веществом, ни энергией. Закрытая система – это система, которая не обменивается со средой веществом, но обменивается энергией.
Открытая система – это система, которая обменивается со средой и веществом, и энергией. Примером открытой системы является живая клетка.
Энергия Гиббса. Прогнозирование направления самопроизвольно протекающих процессов в изолированной и закрытой системах; роль энтальпийного и энтропийного факторов. Термодинамические условия равновесия. Энергия Гиббса – функция состояния, являющаяся критерием самопроизвольности процессов в открытых и закрытых системах. G=H–TS H- энтальпия, Т- температура, S- энтропия. Используя энергию Гиббса, второй закон термодинамики можно выразить так: При постоянстве температуры и давления в системе самопроизвольно протекают только процессы, ведущие к уменьшению энергии Гиббса. В состоянии равновесия энергия Гиббса равна нулю ∆G ≤0 (р, Т=const) При ∆G<0 реакция самопроизвольно протекает в прямом направлении; ∆G>0 в обратном направлении ∆G=0 реакция находится в состоянии равновесия. Изменение ЭГ определяется формулой: ΔG=ΔH–TΔS Стандартная ЭГ определяется формулой:
где
Критериями направления самопроизвольного протекания необратимых процессов являются неравенства ΔG< 0 (для закрытых систем),ΔS> 0 (для изолированных систем). Самопроизвольное течение реакций в закрытых системах контролируется как энтальпийным (ΔrH), так и энтропийным (ΔrS) фактором. Для реакций, у которых ΔrH< 0 и ΔrS> 0, энергия Гиббса всегда будет убывать, т.е. ΔrG< 0, и такие реакции могут протекать самопроизвольно при любых температурах В изолированных системах энтропия максимально возможное для данной системы значение Smax; в состоянии равновесия ΔS= 0. ПРЕДМЕТ И ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ КИНЕТИКИ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ. Или R- T- температура в Кельвинах 7. Понятие о теории активных соударений, образование активированного комплекса. Теория активных соударений. Для того чтобы произошла химическая реакция, необходимо, чтобы частицы столкнулись. Скорость реакции пропорциональна общему числу двойных столкновений в единицу времени в единице объема w=qzобщ, где q – коэффициент пропорциональности; zобщ– общее число столкновений. В теории соударений используются следующие допущения: 1. Частицы бесструктурны – это шары с радиусом r; 2. В момент соударения молекулы ведут себя как упругие шары. Т.е. суммарная энергия молекул до и после соударения остается постоянной, но может перераспределяться между молекулами. 3. Реагируют только молекулы, которые обладают энергией активации. 4. Число двойных активных столкновений определяется соотношением:
где zобщ– общее число столкновений, zакт– число активных столкновений,
5. Процесс превращения исходных веществ в продукты происходит мгновенно в момент соударения активных молекул. 6. Скорость реакции А+В=С определяется выражением
где Р – стерический фактор. Он определяется опытным путем из соотношения опытной и теоретической скорости. Р<1. Катализ. Гомогенный и гетерогенный катализ, положительный и отрицательный. Промоторы, ингибиторы, каталитические яды. Требования к катализаторам, принцип действия. Катализ - это изменение скорости реакции под действием некоторых веществ, которые к концу реакции остаются в химически неизменном виде. Гомогенный катализ - катализатор и реагенты находятся в одной фазе Гетерогенный катализ -катализатор и реагенты находятся в разных фазах Положительный катализатор -под действием которого скорость реакции увеличивается Отрицательный катализатор -под действием которого скорость реакции уменьшается (ингибиторы) Принципы катализа: 1) катализатор принимает участие в химической реакции, образуя промежуточные продукты, но в конце реакции выделяется в химически неизменном виде. Физическое состояние катализатора, входящего в активный комплекс, может существенно изменяться, например, уменьшатся размеры зерен твердого катализатора, изменится структура поверхностных слоев; 2) катализатор не смещает положение равновесия, а лишь увеличивает скорость прямой и обратной реакции в равной степени; 3) действие катализатора является специфичным (селективным); 4) катализатор увеличивает скорость реакции за счет уменьшения Еакт, ведет реакцию по пути с меньшим энергетическим барьером. Промоторы - это вещества, которые не обладают каталитическими свойствами, но добавление их к катализатору значительно увеличивает его активность. Каталитические яды - это вещества, понижающие активность катализатора.
Природа поверхностной энергии. Поверхностное натяжение. Физический смысл поверхностного натяжения. Энергетическое и силовое выражение поверхностного натяжения. Зависимость поверхностного натяжения от температуры. К поверхностным явлениям относят те эффекты и особенности поведения веществ, которые наблюдаются на поверхностях раздела фаз. Причиной поверхностных явлений служит особое состояние молекул в слоях жидкостей и твёрдых тел, непосредственно прилегающих к поверхностям раздела фаз. Молекула жидкости, находящаяся внутри жидкости, окружена себе подобными молекулами. Силы взаимодействия между такими молекулами при этом взаимно уравновешиваются. Поверхностный слой жидкости находится в особых условиях по сравнению со всем объѐмом вещества. Молекулы поверхностного слоя граничат не только с себе подобными молекулами, но и с молекулами газа. Втягивая поверхностные молекулы внутрь фазы, внутреннее давление стремится уменьшить поверхность до минимально возможной в данных условиях. Для увеличения поверхности жидкости нужно преодолеть силу внутреннего давления и совершить определѐнную механическую работу против сил молекулярного сцепления, против внутреннего давления. Очевидно, что чем оно больше, тем больше энергии надо затратить. Эта энергия сосредотачивается в молекулах, находящихся на поверхности, и называется поверхностной энергией. Избыток поверхностной энергии, приходящейся на 1 м2 межфазной поверхности, характеризуется поверхностным натяжением (ζ). Бесконечно малое изменение поверхностной энергии Гиббса (dG) с изменением величины площади поверхности при постоянных р и Т равно
где dS –бесконечно малое изменение площади поверхности; σ – коэффициент поверхностного натяжения. Из приведѐнного выражения следует (при постоянстве числа молей компонентов n):
Таким образом, поверхностное натяжение можно представить как частную производную от величины энергии Гиббса по величине межфазной поверхности при р = const и Т=const и постоянных числах молей компонентов. Согласно энергетическому выражени ю, поверхностное натяжение ζ есть поверхностная энергия Гиббса единицы поверхности (т.е. удельная поверхностная энергия Гиббса). В таком случае σ равно работе, затраченной на образование единицы поверхности. Энергетической единицей σ является Дж/м2. Силовое определение поверхностного натяжения формулируется так: ζ – это сила, действующая на поверхности по касательной к ней и стремящаяся сократить свободную поверхность тела до наименьших возможных пределов при данном объѐме. В этом случае единицей измерения ζ является Н/м. Энергетическое и силовое выражения ζ эквивалентны, и численная величина совпадает в обеих размерностях. Так, для воды при 298 К ζ = 71,96∙10^-3Дж/м2 = 71,96∙10^-3 Н/м. Одна размерность легко выводится из другой: Дж/м2= Н∙м/м2= Н/м. Поверхностное натяжение жидкостей уменьшается с ростом температуры. Это означает, что при критической температуре границы раздела между фазами исчезают и система «газ – жидкость» из гетерогенной превращается в гомогенную. При повышении давления увеличивается взаимодействие поверхностных молекул жидкости с молекулами газовой фазы и уменьшается избыток энергии молекул на поверхности. Поэтому с повышением давления в системе «жидкость – газ» поверхностное натяжение уменьшается Зависимость поверхностного натяжения от природы и концентрации растворенного вещества (ПАВ, ПИВ и ПНВ). Ориентация молекул ПАВ в поверхностном слое. Правило Дюкло-Траубе. Растворѐнные вещества в зависимости от природы могут по-разному влиять на поверхностное натяжение жидкостей. Способность растворѐнных веществ изменять поверхностное натяжение растворителя называется поверхностной активностью. Все вещества по способности изменять поверхностное натяжение растворителя делятся на три группы. 1. Вещества, понижающие поверхностное натяжение, называются поверхностно-активными вещества (ПАВ). По отношению к водным растворам поверхностно активными веществами являются спирты, жирные кислоты и их соли (мыла), сложные эфиры, амины, белки и некоторые другие вещества, имеющие дифильное строение. В молекулах таких веществ различают неполярную (гидрофобную) часть – углеводородный радикал («хвост») и полярную (гидрофильную) часть. Чтобы вещество обладало способностью понижать поверхностное натяжение растворителя, необходимо, чтобы в составе молекулы имелись полярные группы: -ОН, -NH2, -COOH, -SO3др. Мерой способности растворѐнного вещества к понижению поверхностного натяжения раствора является величина производной поверхностного натяжения по концентрации, называемая поверхностной активностью. Единица измерения поверхностной активности названа в честь Дж. Гиббса: 1 гиббс = 10^-6 Дж ∙ м / моль. Поверхностная активность веществ одного и того же гомологического ряда возрастает приблизительно в три раза при увеличении углеводородной цепи на одну метиленовую группу (- СН2-). (Правило Дюкло-Траубе) ПАВ, как и все вещества в зависимости от способности к электролитической диссоциации, делят на электролиты (ионогенные ПАВ) и неэлектролиты (неионогенные ПАВ). Ионогенные ПАВ подразделяют на катионные, анионные и амфотерные. 2. Вещества, повышающие поверхностное натяжение, называются поверхностно-инактивными (ПИВ). К этим веществам относятся сильные электролиты: соли, кислоты, щѐлочи. Ионы этих веществ, образующиеся в результате электролитической диссоциации, взаимодействуют с молекулами воды сильнее, чем молекулы воды между собой. Поэтому значительная часть ионов увлекается молекулами воды внутрь объѐма раствора. Однако некоторые немногие оставшиеся на поверхности создают вблизи поверхности силовое поле, тем самым повышают поверхностное натяжение. 3. Имеются вещества, которые не меняют поверхностное натяжение растворителя. Эти вещества называют поверхностно-неактивными. Молекулы таких веществ в своѐм составе имеют большое число полярных функциональных групп (например, сахароза). Всѐ многообразие зависимостей поверхностного натяжения от концентрации может быть представлено кривыми трѐх типов:
Из графика видно, что для ПАВ < 0, для ПИВ > 0, а для ПНВ = 0. На графике σ0– поверхностное натяжение воды. Отметим, что для ПАВ характерно резкое снижение σ даже при малых концентрациях. По мере роста концентрации ПАВ график становится более пологим и, наконец, переходит в горизонтальную прямую, что означает, что поверхностное натяжение достигло своего минимального значения. Увеличение σ под влиянием ПИВ происходит незначительно, что связано с тем, что концентрация ионов в поверхностном слое незначительна и по составу он близок к чистому растворителю. Отметим, что понятия ПАВ и ПИВ не носят абсолютный характер, они определяются выбранным растворителем, его поверхностным натяжением. 5. Адсорбция, основные термины (адсорбент, адсорбтив, адсорбат, десорбция). Химическая и физическая адсорбция. Под адсорбцией на неподвижной границе раздела фаз понимается накопление одного вещества на поверхности другого. Твѐрдое вещество, на поверхности которого накапливается другое вещество, называется адсорбентом, а поглощаемое вещество – адсорбтивом. Уже адсорбированное вещество называется адсорбатом. Десорбция - процесс, обратный адсорбции В зависимости от природы сил, действующих между адсорбентом и адсорбатом различают физическую и химическую адсорбции. Физическая адсорбция обусловлена межмолекулярным взаимодействием за счёт сил Ван дер-Ваальса или водородной связью. Поэтому для этого вида адсорбции характерны: обратимость, неспецефичность, экзотермичность. Химическая адсорбция осуществляется при взаимодействии адсорбента с адсорбатом с образованием химической связи. Химическая адсорбция: необратима, специфична и локализована
Хроматография. Понятия об адсорбционной, распределительной, ионообменной хроматографии. Хемосорбционная хроматография. Молекулярно-ситовая хроматография (или гельфильтрация). Деление хроматографии по технике эксперимента: колоночная, бумажная и тонкослойная хроматография. Хроматография – метод анализа и разделения смеси веществ, основанный на их различной адсорбции. Хроматография подразделяется: 1) Адсорбционная - основана на различной адсорбции разделяемых веществ. 2) Распределительная - основана на различии в растворимости и распределения веществ между двумя несмешивающимися жидкости. 3) Ионообменная - по обмену ионами между раствором и адсорбентом 4) Хемосорбционная – основана на различии в константах химической реакции. 5) Молекулярно-ситовая – основана на разделение смеси веществ с различным размером молекул. Колоночная хроматография — осуществляется пропусканием исследуемого раствора через стеклянную трубку, заполненную порошкообразным поглотителем. Бумажная хроматография - метод, основанный на распределении веществ между подвижной и неподвижной жидкими фазами. Тонкослойная хроматография - основанный на различной скорости перемещения компонентов смеси в плоском тонком слое сорбента при их движении в потоке подвижной фазы. Правило Шульце-Гарди Коагулирующее действие иона тем выше, чем выше его заряд. При увеличении заряда иона на единицу, порог концентрации уменьшается на один порядок По современной теории коагуляции электролитами, разработанной Б.В. Дерягиным и Л.Д. Ландау, порог коагуляции определяется уравнением:
γ = С
где С – константа, зависящая от числа зарядов катиона и аниона; k – константа Больцмана; е – заряд электрона, Т – температура (в К), ε – диэлектрическая проницаемость раствора, А – константа вандерваальсова притяжения; Z – величина заряда иона. Если применяется смесь электролитов, то механизм коагуляции осложняется. Происходит смещение адсорбционного равновесия, которое сопровождается перераспределением ионов двойного слоя и изменением порога коагуляции. Наблюдаемые при этом явления можно свести к 3 следующим: антагонизм, синергизм, аддитивность. 1)Аддитивность - коагулирующее действие смеси равно общей сумме коагулирующих эффектов составляющих её электролитов. 2)Антагонизм - действие одного электролита ослабляется при добавлении другого. 3)Синергизм -действие одного электролита усиливается при добавлении другого. Кинетика коагуляции. В качестве количественной характеристики коагуляции Зигмонди предложил использовать скорость коагуляции. Скорость коагуляции V – это изменение концентрации коллоидных частиц в единицу времени при постоянном объёме системы. V = - c – концентрация частиц; t – время. Знак «-» стоит потому, что концентрация частиц со временем уменьшается, а скорость всегда положительна. Степень коагуляции α: α = где Z – общее число столкновений частиц в единицу времени; Zэф – число эффективных столкновений (т.е. столкновений, приводящих к коагуляции) в единицу времени. -Если α = 0, коагуляция не происходит, золь агрегативно устойчив. -Если α = 1, происходит быстрая коагуляция, т.е. каждое столкновение частиц приводит к их слипанию. -Если 0 ‹ α ‹ 1, то идет медленная коагуляция, т.е. только некоторые столкновения частиц приводят к их слипанию. Свойства растворов ВМС. 1. Растворы высокомолекулярных соединений (ВМС) как истинные растворы, их особенности: гомогенность, самопроизвольность образования, равновесность, молекулярность или ионность. Высокомолекулярные вещества (или полимеры) растворяются в различных низкомолекулярных жидкостях, образуя устойчивые равновесные системы с молекулярной дисперсностью компонентов. Таким образом, растворы полимеров являются гомогенными системами, истинными растворами. Являясь истинными растворами, растворы ВМС всѐ же отличаются от растворов низкомолекулярных веществ, что связано с огромными размерами макромолекул. Растворение ВМС осуществляется с образованием менее упорядоченной системы из более упорядоченной и, значит, этот процесс протекает с увеличением энтропии (∆S > 0). Растворение ВМС – процесс самопроизвольный, следовательно, при растворении полимеров уменьшается свободная энергия: ∆G = ∆H - T∆S < 0. Изменение энтальпии (знак ∆Н) при растворении может быть положительным (эндотермический процесс), отрицательным (экзотермический процесс) или равным нулю. Так как растворы полимеров образуются самопроизвольно с уменьшением свободной энергии, они являются термодинамически устойчивыми системами, которые могут существовать без стабилизаторов неограниченное время. В этом заключается их основное отличие от лиофобных коллоидных систем. В отличие от лиофобных коллоидных систем растворы ВМС являются равновеснымим системами. Растворы ВМС, подобно растворам низкомолекулярных соединений, могут быть и молекулярными, и ионными, причѐм в последнем случае природа зарядов связана с наличием функциональных групп.
Раствор как гомогенная система. Растворитель, растворенное вещество. Классификация растворов по степени дисперсности, по растворимости в воде, по способности к диссоциации. Растворы - гомогенные системы, состоящие из растворителя, растворенного вещества и продуктов их взаимодействия. Вещества, составляющие раствор, называют компонентами реакции. Растворитель - тот компонент, который в растворе находится в том же агрегатном состоянии, что и до растворения. В лабораторной практике различают концентрированные растворы (содержание растворенного вещества соизмеримо с содержанием растворителя) и разбавленные растворы (содержание растворенного вещества мало по сравнению с содержанием растворителя). Иногда растворы определяют как дисперсные системы. При этом растворитель, в котором распределено вещество, называется дисперсной средой, а частицы растворенного вещества - дисперсной фазой. По степени дисперсности различают 1) Взвеси- это дисперсные системы, в которых размеры распределенных частиц сравнительно велики (10^-7-10^-5м). Делятся на: суспензии (распределенное вещ-во твердое) и эмульсии (распределенное вещество жидкое). Взвеси неустойчивы, частицы диспергированного вещ-ва выпадают в осадок либо всплывают. Процесс разделения взвесей для суспензий-седиментация, для эмульсий-расслоение. 2) Коллоидные системы-частицы распределенного вещества имеют размеры порядка 10^-9-10^-7 м. Каждая частица может содержать большое число атомов или молекул. Видны в ультрамикроскоп, где свет падает сзади либо сбоку. 3) Истинные растворы-диспергированное вещ-во распределено в среде в виде молекул или ионов, частицы имеют размеры порядка 10^-10-10^-7м. Растворы однородные, устойчивые. Классификация по растворимости в воде:
|
||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 1296; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.42.196 (0.165 с.) |



 газовая постоянная,
газовая постоянная,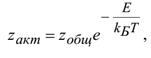
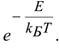
 -доля активных столкновений, равная множителю Больцмана
-доля активных столкновений, равная множителю Больцмана



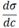
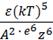
 где
где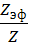 где
где


