
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Происхождение и формирование гидросферыСодержание книги
Поиск на нашем сайте
Проблема происхождения воды и формирования гидросферы, несмотря на довольно высокий современный уровень развития наук о Земле, до сих пор является наименее разработанной. Существует множество гипотез происхождения воды и развития гидросферы, но ни одна из них не вышла из стадии рабочей гипотезы, накопления, предварительной систематизации и обобщения материалов. Все гипотезы условно можно объединить в две большие группы: 1) теллурического происхождения; 2) космического происхождения воды. Наиболее убедительными представляются гипотезы первой группы, согласно которым литосфера, атмосфера и гидросфера образовались в едином процессе, в результате выплавления и дегазации вещества мантии. По мнению А. П. Виноградова, в момент формирования Земли из протопланетного облака все элементы ее будущей атмосферы и гидросферы находились в связанном виде в составе твердых веществ: вода – в гидроокислах, азот – в нитритах и нитратах, кислород – в окислах металлов, углерод – в графитах, карбидах и карбонатах. Достигнув примерно современной массы, Земля стала разогреваться в результате гравитационного сжатия ее недр и за счет распада радиоактивных изотопов, и в мантии началось плавление и дифференциация вещества на летучие, легкоплавкие и тугоплавкие. Тугоплавкие вещества остались в недрах Земли, легкоплавкие в виде базальта образовали земную кору. Летучие вещества – водяной пар вулканических газов, соединения углерода, серы, аммиак, галоидные кислоты, водород, аргон и некоторые другие газы – поднялись на поверхность и образовали атмосферу и гидросферу. Причем, почти весь водяной пар конденсировался (температура над поверхностью Земли не превышала +15 °С), превратился в жидкую воду и тем самым сформировал «праокеаны». В первичный океан переходили, растворяясь в воде, также и другие составные части вулканических газов – большая доля углекислого газа, кислоты, соединения серы и часть аммиака. Кислоты, особенно в воде, реагировали с силикатами горных пород, извлекая из них щелочные, щелочноземельные и другие элементы. В результате вода переставала быть кислой, а растворимые соли извлеченных из силикатов элементов переходили в океан, поэтому вода в нем сразу же становилась соленой. Первичный океан, вероятно, был неглубоким, но покрывал почти всю Землю. С ростом массы гидросферы увеличивался и объем океана, изменялись его очертания, что было связано с формированием континентальной и океанической коры. С поверхности океана испарялась вода (пресная), которая, возвращаясь в виде дождей на земную поверхность, сформировала воды суши. Воды океана, суши и атмосферы составили единую земную оболочку – гидросферу. Это и определило одну из специфических особенностей Земли, отличающую ее от других планет Солнечной системы, – постоянное наличие на ней гидросферы. 2.2 Водные ресурсы планеты
Понятие «гидросфера» постоянно трансформировалось. В настоящее время гидросферой принято называть водную оболочку Земли, включающую всю несвязанную воду независимо от ее состояния: жидкую, твердую, газообразную. Нижняя граница гидросферы принимается на уровне поверхности мантии (поверхности Мохоровичича), а верхняя проходит в верхних слоях атмосферы. Гидросфера включает в себя Мировой океан, воды суши (реки, озера, болота, ледники), атмосферную влагу, а также подземные воды, залегающие всюду на материках, на дне озерных и морских впадин и под толщей вечных льдов. Таким образом, являясь частью географической оболочки, гидросфера охватывает весь комплекс земных оболочек. Гидросфера непрерывна, как непрерывны лито- и атмосфера, и едина. Ее единство заключается в общности происхождения всех природных вод из мантии Земли, в единстве их эволюции, взаимосвязи всех видов вод и способности перехода одного вида вод в другой, в единстве их функций в природе (обмен веществами и энергией). Мировые запасы воды на Земле колоссальны. Общий объем гидросферы по последним данным (таблица 2.1) составляет около 1390 млн. км3. Если все воды гидросферы равномерно распределить по поверхности Земли, слой ее будет иметь толщину около 2,5 км. Предполагается, что это количество воды в течение геологического времени практически остается неизменным, несмотря на продолжающее Таблица 2.1 – Мировые запасы воды
Примечание. Расчет запасов подземных вод выполнен по отдельным континентам без учета запасов подземных вод в Антарктиде, ориентировочно оцениваемых в 2 млн. км3, в том числе преимущественно пресных – около 1млн. км3.
поступление воды из мантии и из Космоса (ледяные ядра комет, метеорное вещество, пыль...) и потери ее за счет разложения воды фотосинтезом и диссипации легких газов в Космосе. Однако соотношение отдельных ее видов, перечисленных в таблице 2.1, нельзя считать постоянным и абсолютно точным. Оно менялось в разные периоды жизни Земли. Имеющиеся в литературе данные [3] о соотношении частей гидросферы несколько различаются (рисунок 2.1). В современную эпоху основные запасы воды сосредоточены в Мировом океане (96,5 %). Пресных вод в гидросфере всего 2,58 % от общих запасов воды. Больше всего пресных вод содержится в ледниках и снежном покрове Антарктиды, Арктики и горных стран (1,78 % объема гидросферы или 69,3% от запасов пресных вод на Земле). Если весь лед равномерно распределить по поверхности земного шара, он покроет ее слоем в 53 м, а если растопить эти массы льда, то уровеньлед равномерно распределить по поверхности земного шара, он покроет ее слоем в 53 м, а если растопить эти массы льда, то уровень океана повысится на 64 м. Ледники занимают особое место в круговороте воды на Земле, т.к. они сохраняют влагу в твердом состоянии на много лет. В среднем, снежинка, выпавшая на ледник, покоится там более 8000 лет, прежде чем вновь превратится в воду и попадет в активный круговорот воды. Громадные запасы воды аккумулированы в литосфере. Доля пресных подземных вод от общего запаса пресных вод на Земле составляет 29,4 %. На долю рек приходится 0,006 %, пресных озер – 0,25 %, на воду, содержащуюся в атмосфере, – 0,03 % общего количества пресных вод. На долю пресных вод, пригодных для водоснабжения, приходится 4,2 млн. км3, или всего лишь 0,3 % объема гидросферы. Интересен тот факт, что самым большим хранилищем поверхностных пресных вод является озеро Байкал, где содержится 1/5 всех мировых запасов поверхностных пресных вод мира. Сказанное можно подкрепить и другим примером. Если допустить, что запасы воды будут изъяты из озера, то заполнение освободившегося объема озера всеми впадающими реками произошло бы только за 250-300 лет при условии, что вода из озера не расходовалась бы на сток и испарение.
Важнейшие свойства воды
Вода – одно из самых удивительных соединений на Земле – давно уже поражает исследователей необычностью многих своих физических свойств: 1) Неисчерпаемость как вещества и природного ресурса; если все другие ресурсы земли уничтожаемы или рассеиваемы, то вода как бы ускользает от этого, принимая различные формы или состояния: кроме жидкой – твердую и газообразную. Это единственное вещество и ресурс такого типа. Это свойство обеспечивает вездесущность воды, она пронизывает всю географическую оболочку Земли и производит в ней разнообразную работу. 2) Присущее только ей расширение при затвердевании (замерзании) и уменьшение объема при плавлении (переходе в жидкое состояние). 3) Максимальная плотность при температуре +4 °С и связанные с этим весьма важные свойства для природных и биологических процессов, например исключение глубокого промерзания водоемов. Как правило, максимальная плотность физических тел наблюдается при температуре затвердевания. Максимальная плотность дистиллированной воды наблюдается в аномальных условиях – при температуре 3,98-4 °С (или округленно +4 °С), т. е. при температуре выше точки затвердевания (замерзания). При отклонении температуры воды от 4 °С в обе стороны плотность воды убывает. 4) При плавлении (таянии) лед плавает на поверхности воды (в отличие от других жидкостей). 5) Аномальное изменение плотности воды влечет за собой такое же аномальное изменение объема воды при нагревании: с возрастанием температуры от 0 до 4 °С объем нагреваемой воды уменьшается и только при дальнейшем возрастании начинает увеличиваться. Если бы при понижении температуры и при переходе из жидкого состояния в твердое плотность и объем воды изменялись так же, как это происходит у подавляющего большинства веществ, то при приближении зимы поверхностные слои природных вод охлаждались бы до 0 °С и опускались на дно, освобождая место более теплым слоям, и так продолжалось бы до тех пор, пока вся масса водоема не приобрела бы температуру 0 °С. Далее вода начинала бы замерзать, образующиеся льдины погружались бы на дно, и водоем промерзал бы на всю его глубину. При этом многие формы жизни в воде были бы невозможны. Но так как наибольшей плотности вода достигает при 4 °С, то перемещение ее слоев, вызываемое охлаждением, заканчивается при достижении этой температуры. При дальнейшем понижении температуры охлажденный слой, обладающий меньшей плотностью, остается на поверхности, замерзает и тем самым защищает лежащие ниже слои от дальнейшего охлаждения и замерзания. 6) Переход воды из одного состояния в другое сопровождается затратами (испарение, таяние) или выделением (конденсация, замерзание) соответствующего количества тепла. На таяние 1 г льда необходимо затратить 677 кал, на испарение 1 г воды – на 80 кал меньше. Высокая скрытая теплота плавления льда обеспечивает медленное таяние снега и льда. 7) Способность относительно легко переходить в газообразное состояние (испаряться) не только при положительных, но и при отрицательных температурах. В последнем случае испарение происходит минуя жидкую фазу – из твердой (льда, снега) сразу в парообразную. Такое явление носит название – сублимация. 8) Если сравнить температуру кипения и замерзания гидридов, образованных элементами шестой группы таблицы Менделеева (селена H2Se, теллура Н2Те) и воды (Н2О), то по аналогии с ними температура кипения воды должна быть порядка 60 °С, а температура замерзания – ниже 100° С. Но и здесь проявляются аномальные свойства воды – при нормальном давлении в 1 атм. вода кипит при +100 °С, а замерзает при 0 °С. 9) Громадное значение в жизни природы имеет и тот факт, что вода обладает аномально высокой теплоемкостью, в 3000 раз большей, чем воздух. Это значит, что при охлаждении 1 м3 воды на 1 0С на столько же нагревается 3000 м3 воздуха. Поэтому, аккумулируя тепло, Океан оказывает смягчающее влияние на климат прибрежных территорий. 10) Вода поглощает тепло при испарении и таянии, выделяя его при конденсации из пара и замерзании. 11) Способность воды в дисперсных средах, например в мелкопористых почвах или биологических структурах, переходить в связанное или рассредоточенное состояние. В этих случаях очень сильно меняются свойства воды (ее подвижность, плотность, температура замерзания, поверхностное натяжение и другие параметры), крайне важные для протекания процессов в природных и биологических системах. 12) Вода – универсальный растворитель, поэтому не только в природе, но и в лабораторных условиях идеально чистой воды нет уже по той причине, что она способна к растворению любого сосуда, в который заключена. Есть предположение, что поверхностное натяжение идеально чистой воды было бы таковым, что по ней можно было бы кататься на коньках. Способность воды к растворению обеспечивает перенос веществ в географической оболочке, лежит в основе обмена веществами между организмами и средой, в основе питания. 13) Из всех жидкостей (кроме ртути) у воды самое высокое поверхностное давление и поверхностное натяжение: 14) Вода обладает высокой термической устойчивостью. Водяной пар начинает разлагаться на водород и кислород только при температуре выше 1000 °С. 15) Химически чистая вода является очень плохим проводником электричества. Вследствие малой сжимаемости в воде хорошо распространяются звуковые и ультразвуковые волны. 16) Свойства воды сильно изменяются под влиянием давления и температуры. Так, при росте давления температура кипения воды повышается, а температура замерзания, наоборот, понижается. С повышением температуры уменьшаются поверхностное натяжение, плотность и вязкость воды и возрастают электропроводность и скорость звука в воде. Аномальные свойства воды вместе взятые, свидетельствующие о чрезвычайно высокой ее устойчивости к воздействию внешних факторов, вызваны наличием дополнительных сил между молекулами, получивших название водородных связей. Суть водородной связи сводится к тому, что ион водорода, связанный с каким-то ионом другого элемента, способен электростатически притягивать к себе ион того же элемента из другой молекулы. Молекула воды имеет угловое строение: входящие в ее состав ядра образуют равнобедренный треугольник, в основании которого находится два протона, а в вершине – ядро атома кислорода (рисунок 2.2).
Рисунок 2.2 – Строение молекулы воды
Из имеющихся в молекуле 10 электронов (5 пар) одна пара (внутренние электроны) расположена вблизи ядра кислорода, а из остальных 4 пар электронов (внешних) по одной паре обобществлено между каждым из протонов и ядром кислорода, тогда как 2 пары остаются неопределенными и направлены к противоположным от протонов вершинам тетраэдра. Таким образом, в молекуле воды имеется 4 полюса зарядов, расположенных в вершинах тетраэдра: 2 отрицательных, созданных избытком электронной плотности в местах расположения неподеленных пар электронов, и 2 положительных, созданных ее недостатком в местах расположения протонов. Вследствие этого молекула воды оказывается электрическим диполем. При этом положительный полюс одной молекулы воды притягивает отрицательный полюс другой молекулы воды. В результате получаются агрегаты (или ассоциации молекул) из двух, трех и более молекул (рисунок 2.3).
Рисунок 2.3 – Образование диполями воды ассоциированных молекул: 1 – моногидроль Н2О; 2 – дигидроль (Н2О)2; 3 – тригидроль (Н2О)3
Следовательно, в воде одновременно присутствуют одиночные, двойные и тройные молекулы. Содержание их меняется в зависимости от температуры. Во льду содержатся, в основном, тригидроли, объем которых больше моногидролей и дигидролей [4]. При повышении температуры скорость движения молекул возрастает, силы притяжения между молекулами ослабевают, и в жидком состоянии вода – это смесь три-, ди- и моногидролей. С дальнейшим увеличением температуры тригидрольные и дигидрольные молекулы распадаются, при температуре 100 °С вода состоит из моногидролей (пар). Существование неподеленных электронных пар определяет возможность образования двух водородных связей. Еще две связи возникают за счет двух водородных атомов. Вследствие этого каждая молекула воды в состоянии образовать четыре водородные связи (рисунок 2.4).
Рисунок 2.4 – Водородные связи в молекулах воды:
Благодаря наличию в воде водородных связей в расположении ее молекул отмечается высокая степень упорядоченности, что сближает ее с твердым телом, а в структуре возникают многочисленные пустоты, делающие ее очень рыхлой. К наименее плотным структурам принадлежит структура льда. В ней существуют пустоты, размеры которых несколько превышают размеры молекулы Н2О. При плавлении льда его структура разрушается. Но и в жидкой воде сохраняются водородные связи между молекулами: возникают ассоциаты – зародыши кристаллических образований. В этом смысле вода находится как бы в промежуточном положении между кристаллическим и жидким состояниями и более сходна с твердым телом, чем с идеальной жидкостью. Однако в отличие от льда каждый ассоциат существует очень короткое время: постоянно происходит разрушение одних и образование других агрегатов. В пустотах таких «ледяных» агрегатов могут размещаться одинокие молекулы воды, при этом упаковка молекул воды становятся более плотной. Именно поэтому при плавлении льда объем, занимаемый водой, уменьшается, ее плотность возрастает. При + 4 °С вода имеет самую плотную упаковку. При нагревании воды часть теплоты затрачивается на разрыв водородных связей. Этим объясняется высокая теплоемкость воды. Водородные связи между молекулами воды полностью разрушаются при переходе воды в пар. Сложность структуры воды обусловлена не только свойствами ее молекулы, но и тем, что вследствие существования изотопов кислорода и водорода в воде имеются молекулы с различным молекулярным весом (от 18 до 22). Наиболее распространенной является «обычная» молекула с молекулярным весом 18. Содержание молекул с большим молекулярным весом невелико. Так, «тяжелая вода» (молекулярный вес 20) составляет менее 0,02% всех запасов воды. В атмосфере она не обнаружена, в тонне речной воды ее не более 150 г, морской –160-170 г. Однако, ее присутствие придает «обычной» воде большую плотность, влияет на другие ее свойства. Удивительные свойства воды позволили возникнуть и развиться жизни на Земле. Благодаря им вода может играть незаменимую роль во всех процессах, совершающихся в географической оболочке.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 2789; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.143.237.203 (0.014 с.) |

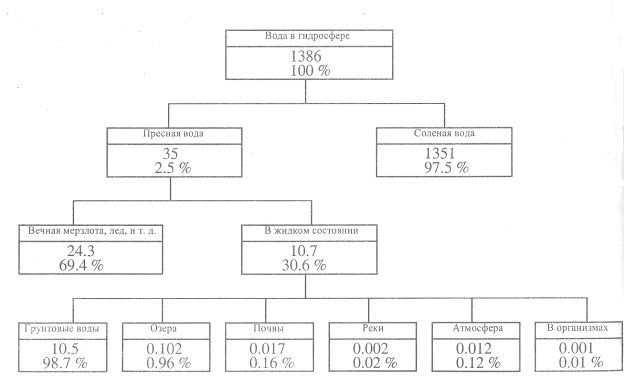 Рисунок 2.1 – Водные ресурсы Земли (·106 км3), по [3]
Рисунок 2.1 – Водные ресурсы Земли (·106 км3), по [3]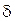 = 75·10-7 Дж/см2 (глицерин – 65, аммиак – 42, а все остальные – ниже 30 ·10-7 Дж/см2). В силу этого капля воды стремится принять форму шара, а при соприкосновении с твердыми телами смачивает поверхность большинства из них. Именно поэтому она может подниматься вверх по капиллярам горных пород и растений, обеспечивая почвообразование и питание растений.
= 75·10-7 Дж/см2 (глицерин – 65, аммиак – 42, а все остальные – ниже 30 ·10-7 Дж/см2). В силу этого капля воды стремится принять форму шара, а при соприкосновении с твердыми телами смачивает поверхность большинства из них. Именно поэтому она может подниматься вверх по капиллярам горных пород и растений, обеспечивая почвообразование и питание растений.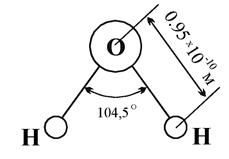
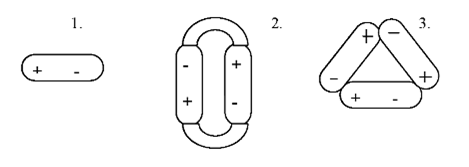

 – обозначение водородной связи
– обозначение водородной связи


