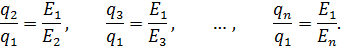Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Характеристическое рентгеновское излучение
Характеристическое рентгеновское излучение имеет не сплошной, а линейчатый спектр. Этот тип излучения возникает, когда быстрый электрон, достигая анода, проникает во внутренние орбитали атомов и выбивает один из их электронов. В результате появляется свободное место, которое может быть заполнено другим электроном, спускающимся с одной из верхних атомных орбиталей. Такой переход электрона с более высокого на более низкий энергетический уровень вызывает рентгеновское излучение определенной дискретной длины волны. Поэтому характеристическое рентгеновское излучение имеет линейчатый спектр. Частота линий характеристического излучения полностью зависит от структуры электронных орбиталей атомов анода. 11.5 Формула Вульфа Брэгга. Условие Вульфа-Брэгга определяет направление возникновения дифракции максимумов упруго рассеянного на кристалле рентгеновского излучения. Выведено в 1913 независимо У.Л. Брэггом и Г.В. Вульфом. Имеет вид: 2dsin У. Л. Брэгг показал, что поглощение и испускание рентгеновских лучей кристаллами с математической точки зрения эквивалентно отражению света от параллельных плоскостей. Пусть плоская монохроматическая волна любого типа падает на кристаллическую решётку с периодом d, под углом θ, как показано на рисунке
Рис 11. 1 Падающий (синий) и отражённые (красные) лучи. Как видно есть разница в путях между лучом, отражённым вдоль AC' и лучом, прошедшим к второй плоскости атомов по пути AB и только после этого отражённым вдоль BC. Разница в путях запишется как (AB + ВC) − (AC '). (11.1) Если эта разница равна целому числу волн n то две волны придут в точку наблюдения с одинакомыми фазами испытав интерференцию. Математически можно записать: (AB +BC) – ( где λ — длина волны излучения. Используя теорему Пифагора можно показать, что AB = как и следующие соотношения:
Собрав всё вместе получим известное выражение:
После упрощения получим закон Брэгга 2dsin Условие Вульфа-Брэгга является исходным пунктом исследований в рентгеновском структурном анализе, рентгенографии материалов, рентгеновской топографии.
Глава 4 Атомная физика. Лекция 12. Эксперименты, лёгшие в основу атомизма. 12.1. Спектральные закономерности. 12.2. Открытие естественной радиоактивности. 12.3. Открытие электрона. Спектральные закономерности Опыт 12.1 «Столкновение частиц» Оборудование: 1. микроскоп (с увеличением 50) 2. предметное стекло 3. покровное стекло (толщиной 0,18 мм) 4. акварельные краски 5. кисточка 6. стеклянная палочка 7. фильтровальная бумага 8. порошкообразное вещество Ход работы: На предметное стекло при помощи стеклянной палочки нанесите каплю воды. Небольшое количество краски кисточкой добавьте в воду (вода должна лишь слегка окраситься). Поверх капли положите покровное стекло. При необходимости наклоном предметного стекла удалите из взвеси возникшие пузырьки воздуха. Под покровным стеклом должно находится такое количество воды, чтобы при любом наклоне предметного стекла покровное стекло не смещалось. Излишнюю воду нужно удалить при помощи полоски фильтрованной бумаги, подносимой к краю покровного стекла. Эксперимент будет тем удачнее, чем тоньше слой воды между стеклами. Готовый препарат помещается на столик микроскопа. При приближении объектива к препарату сначала видны лишь крупные частицы туши. Эти частицы не проявляют броуновского движения. Вблизи крупных частиц видны более мелкие, вот они и находятся в непрерывном движении (или «дрожании»), получая различные импульсы от молекул воды. Выводы: При выполнении опыта демонстрируется броуновское движение частиц. Опыт 12.2 Регистрация заряженных частиц с помощью камеры Вильсона Оборудование: Камера Вильсона – трековый детектор элементарных заряженных частиц, в котором трек (след) частицы образует цепочка мелких капелек жидкости вдоль траектории её движения. Изобретена Ч. Вильсоном в 1912 г. (Нобелевская премия 1927 г.). Ход работы: Принцип работы камеры Вильсона основан на конденсации пересыщенного пара и образовании видимых капель жидкости на ионах вдоль следа пролетевшей через камеру заряженной частицы. Для создания пересыщенного пара происходит быстрое адиабатическое расширение газа с помощью механического поршня. После фотографирования трека, газ в камере снова сжимается, капельки на ионах испаряются. Электрическое поле в камере служит для “очистки” камеры от ионов образовавшихся при предыдущей ионизации газа. В камере Вильсона треки заряженных частиц становятся видимыми благодаря конденсации перенасыщенного пара на ионах газа, образованных заряженной частицей. На ионах образуются капли жидкости, которые вырастают до размеров достаточных для наблюдения (10–3-10–4 см) и фотографирования при хорошем освещении. Рабочей средой чаще всего является смесь паров воды и спирта под давлением 0.1-2 атмосферы (водяной пар конденсируется главным образом на отрицательных ионах, пары спирта – на положительных). Перенасыщение достигается быстрым уменьшением давления за счёт расширения рабочего объёма. Возможности камеры Вильсона значительно возрастают при помещении её в магнитное поле. По искривлённой магнитным полем траектории заряженной частицы определяют знак её заряда и импульс. С помощью камеры Вильсона в 1932 г. К. Андерсон обнаружил в космических лучах позитрон.
Вывод: В ходе опыта демонстрируется принцип работы камеры Вильсона. Опыт 12.3 Регистрация заряженных частиц с помощью счетчика Гейгера Оборудование: Счётчик Гейгера представляет собой, как правило, цилиндрический катод, вдоль оси, которого натянута проволока — анод. Система заполнена газовой смесью. Ход работы: При прохождении через счётчик заряженная частица ионизирует газ. Образующиеся электроны, двигаясь к положительному электроду — нити, попадая в область сильного электрического поля, ускоряются и в свою очередь ионизуют молекулы газа, что приводит к коронному разряду. Амплитуда сигнала достигает нескольких вольт и легко регистрируется. Вывод: При выполнении работы мы убедились в том, что счётчик Гейгера регистрирует факт прохождения частицы через счётчик, но не позволяет измерить энергию частицы. 1. Накаленные твердые тела испускают сплошные спектры. У газов (наряду со сплошной областью) наблюдаются линейчатые и полосатые спектры. Линейчатый спектр состоит из ряда закономерно расположенных более или менее узких спектральных линий. В полосатом спектре полосы кажутся сплошными при наблюдении в спектроскоп малой разрешающей силы. При применении спектрального аппарата высокой разрешающей силы они распадаются на множество тесно расположенных спектральных линий.
(В настоящее время приведенные соображения утратили свое значение. Методами нелинейной оптики удалось на опыте измерить частоту световых колебаний и притом с точностью, превышающей измерение длины волны в спектроскопии. Скорость же света в вакууме связана с частотой
2. Основным законом спектроскопии, установленным эмпирически в 1908 г., является комбинационный принцип Ритца. Он состоит в том что вое многообразие спектральных линий рассматриваемого атома может быть получено путем попарных комбинаций гораздо меньшего числа величин, называемых спектральными термами или сокращенно просто термами. Частота (волновое число) каждой спектральной линии выражается разностью двух термов:
Термы принято считать существенно положительными и нумеровать их так, чтобы с возрастанием номера терма его величина уменьшалась. В приведенной формуле, например, должно быть n1 < n2; Tn1 > Tn2. Если фиксировать n1 и придавать n2 всевозможные возрастающие значения, начиная с n2 = n1 + 1, то получится система линий, называемая спектральной серией. Совокупность спектральных серий составляет спектр рассматриваемого элемента (атома).
Аналитические выражения для термов подавляющего большинства элементов неизвестны. В лучшем случае они представляются приближенными эмпирическими или полуэмпирическими формулами. Исключение составляет простейший атом — атом водорода, состоящий из одного протона и одного электрона. Для атома водорода терм с высокой степенью точности имеет вид
Такое же выражение, но с другим числовым значением постоянной Ридберга справедливо для всех изотопов водорода и всех одноэлектронных ионов. Из выражения (12.3) путем комбинаций получаются следующие спектральные серии: Серия Лаймана:
Рисунок 12. 1 Таблица 2, в которой приведены вычисленные и наблюденные значения длин волн для первых девяти линий серии Бальмера, показывает, с какой не высокой точностью формула (12.6) согласуется с опытом. Длины волн отнесены к воздуху, где они были экспериментально измерены. Поэтому вычисленные по формуле (12.6) длины волн были пересчитаны для воздуха.
Таблица 12. 1
Открытие естественной радиоактивности На границе двух последних веков произошло событие, изменившее судьбу человечества. Наблюдения Беккереля заинтересовали французский ученых, физика и химика Мари Склодовскую-Кюри и ее супруга физика Пьера Кюри. Они занялись поисками новых радиоактивных химических элементов в минералах урана. Найденные ими в 1898 году полоний Po и радий Ra оказались продуктами распада атомов урана. Это была уже настоящая революция в химии, так как до этого атомы считались неделимыми, а химические элементы - вечными и неразрушимыми. В ХХ веке в химии произошло много интересных открытий. Вот только небольшая часть из них. С 1940 по 1988 гг. было синтезировано 20 новых химических элементов, не найденных в природе, в том числе технеций Tc и астат At. Удалось получить элементы, находящиеся в Периодической системе после урана, от нептуния Np с атомным номером 93 до элемента, не имеющего до сих пор общепризнанного названия, с атомным номером 114. Происходит постепенное слияние неорганической и органической химии и образованием на их основе химии металлоорганических соединений, бионеорганической химии, химии кремния и бора, химии комплексных соединений. Начало этому процессу положил датский химик-органик Вильям Цейзе, синтезировавший в 1827 году необычное соединение трихлороэтиленплатинат(II) калия K[Pt(C2H4)Cl3]. Только в 1956 году удалось установить характер химических связей в этом соединении. Во второй половине XX века удалось получить искусственным путем такие очень сложные природные вещества, как хлорофилл и инсулин. Были также синтезированы соединения благородных газов от радона Rn до аргона Ar, считавшихся ранее инертными, неспособными к химическому взаимодействию. Положено начало получению топлива из воды и света. Возможности химии оказались беспредельными, а самые необузданные фантазии человека в области синтеза веществ с необычными свойствами - осуществимыми. Их реализацией и займется молодое поколение химиков первой половины XXI века.
Открытие электрона Гипотеза о существовании элементарного электрического заряда. Опыты Фарадея показали, что для разных электролитов электрохимический эквивалент k вещества оказывается различным, но, чтобы выделить на электроде один моль любого одновалентного вещества, требуется пропустить один и тот же заряд F, равный примерно 9.6*104 Кл. Более точное значение этой величины, называемой постоянной Фарадея, равно F=96485 Кл*моль-1. Если 1 моль ионов при пропускании электрического тока через раствор электролита переносит электрический заряд, равный постоянной Фарадея F, то на долю каждого иона приходится электрический заряд, равный
На основании такого расчета ирландский физик Д. Стоней высказал предположение о существовании внутри атомов элементарных электрических зарядов. В 1891 г. минимальный электрический заряд е он предложил назвать электроном. Измерение заряда иона. При пропускании через электролит постоянного электрического тока за время t к одному из электродов приходит электрический заряд, равный произведению силы тока I на время t. С другой стороны, этот электрический заряд равен произведению заряда одного иона q0 на число ионов N: It = q0N. (12.11) Отсюда получаем
Так как
то из выражений (12.12) и (12.13) находим
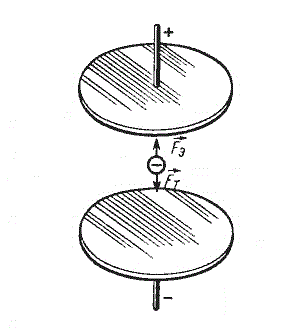
Таким образом, для экспериментального определения заряда одного иона нужно измерить силу постоянного тока I, проходящего через электролит, время t пропускания тока и массу m вещества, выделившегося у одного из электродов. Необходимо знать также молярную массу вещества M. Открытие электрона. Установление закона электролиза еще не доказало строго, что в природе существуют элементарные электрические заряды. Можно, например, предположить, что все одновалентные ионы имеют различные электрические заряды, но их среднее значение равно элементарному заряду е. Опыт Милликена. Окончательное доказательство существования элементарного электрического заряда было дано опытами, которые выполнил в 1909— 1912 гг. американский физик Роберт Милликен (1868— 1953). В этих опытах измерялась скорость движения капель масла в однородном электрическом поле между двумя металлическими пластинами. Капля масла, не имеющая электрического заряда из-за сопротивления воздуха падает с некоторой постоянной скоростью. Если на своем пути капля встречается с ионом и приобретает электрический заряд q, то на нее, кроме силы тяжести, действует еще кулоновская сила mg=q1E1.
Рисунок 12. 2
При освещении пылинки ультрафиолетовым светом ее заряд изменялся и для уравновешивания силы тяжести нужно было изменить напряженность электрического поля между пластинами: mg=q2E2.
По измеренным значениям напряженности электрического поля можно было определить отношение электрических зарядов пылинки: mg = q1E1 = q2E2 = … = qnEn;
Опыты Милликена и Иоффе показали, что заряды капель и пылинок всегда изменяются скачкообразно. Минимальная «порция» электрического заряда — элементарный электрический заряд, равный e=1,602*10-19 Кл. Электрический заряд любого тела всегда целочисленно кратен элементарному электрическому заряду. Других «порций» электрического заряда, способных переходить от одного тела к другому, в природе до сих пор экспериментально обнаружить не удалось. В настоящее время имеются теоретические предсказания о существовании элементарных частиц — кварков — с дробными электрическими зарядами, равными 1/З е и 2/З е.
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 193; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.70.157 (0.054 с.) |
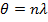 , где d-межплоскостное расстояние, θ-угол скольжения падающего луча, n-порядок отражения, λ-длина волн
, где d-межплоскостное расстояние, θ-угол скольжения падающего луча, n-порядок отражения, λ-длина волн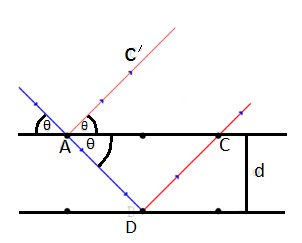
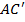 ) = n
) = n 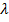 (11.2)
(11.2)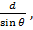 ВС =
ВС = 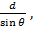 AC =
AC = 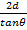 , (11.3)
, (11.3)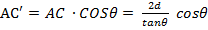 (11.4)
(11.4)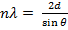 -
- 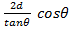 =
= 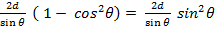 (11.5)
(11.5)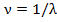 . Частота более удобна для выражения спектральных закономерностей. Но для ее вычисления надо знать скорость света с, а она была измерена с недостаточной точностью, во всяком случае до самого последнего времени. Длина же волны λ измеряется спектральным аппаратом с высокой точностью — до седьмого десятичного знака и выше. Поэтому вместо
. Частота более удобна для выражения спектральных закономерностей. Но для ее вычисления надо знать скорость света с, а она была измерена с недостаточной точностью, во всяком случае до самого последнего времени. Длина же волны λ измеряется спектральным аппаратом с высокой точностью — до седьмого десятичного знака и выше. Поэтому вместо 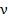 спектроскописты употребляют так называемое спектроскопическое волновое число
спектроскописты употребляют так называемое спектроскопическое волновое число 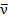 . Это есть число волн, укладывающихся в вакууме на 1 см длины:
. Это есть число волн, укладывающихся в вакууме на 1 см длины: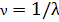 (12.1)
(12.1)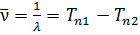 (12.2).
(12.2).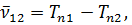
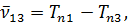
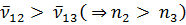
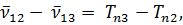
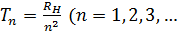 ), (12.3)
), (12.3) 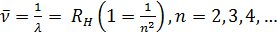 (12.5).
(12.5).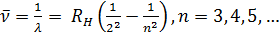 (12.6).
(12.6).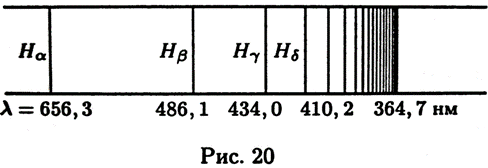
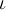
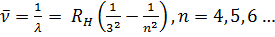 (12.7).
(12.7).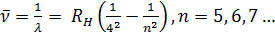 (12.8).
(12.8).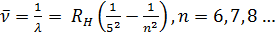 (12.9).
(12.9).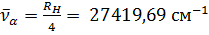 или
или 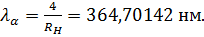 (12.8).
(12.8). 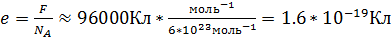 . (12.10)
. (12.10)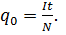 (12.12)
(12.12)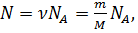 (12.13)
(12.13)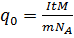 .
.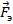 со стороны электрического поля. В результате изменения силы, вызывающей движение капли, изменяется скорость ее движения. Измеряя скорость движения капли и зная напряженность электрического поля, в котором происходило ее движение, Милликен мог определить заряд капли.
со стороны электрического поля. В результате изменения силы, вызывающей движение капли, изменяется скорость ее движения. Измеряя скорость движения капли и зная напряженность электрического поля, в котором происходило ее движение, Милликен мог определить заряд капли.