
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Матеріальний баланс при абсорбції і робоча лінія процесуСодержание книги
Поиск на нашем сайте
З матеріального балансу при абсорбції зазвичай визначають витрату абсорбенту для проведення процесу в заданих умовах. Матеріальний баланс абсорбції характеризується рівнянням
Робоча лінія процесу абсорбції описується рівнянням
На діаграмі у – х вона розташована вище за лінію рівноваги, оскільки при абсорбції зміст компонента в газовій фазі більший за рівноважний, а при десорбції, навпаки, робоча лінія лежить нижче лінії рівноваги. Щоб побудувати робочу лінію, потрібно знати склади фаз на вході в абсорбер і на виході з нього, за цими даними будують точки А і В.
Масопередача при абсорбції Масопередача при абсорбції в основному залежить від розчинності газу в рідині, а також від температури, і тиску процесу, що проводиться. Коефіцієнт масопередачі визначають по формулі (5.6), а коефіцієнти масоотдачі β х і β у, що входять в неї, О.С. Чехов для тарілчастих абсорберів рекомендує визначати по наступних формулах: а) коефіцієнти масовіддачі в газовій фазі для ковпачкових тарілок
βу = 15,8 wу1,32 Δpx кмоль/(м2 год); (5.11) для ситчатих тарілок βу = 10,7 wу0,76 Δрх кмоль/(м2 год); (5.12)
б) коефіцієнти масовіддачі в рідкій фазі для ковпачкових тарілок
βх = 119 wу0,79 Δрх кмоль/(м2 год); (5.13) для ситчатих тарілок βх = 119 Δрх / (1,95 wу – 0,41) кмоль/(м2 год). (5.14)
де wу – швидкість газу у вільному перетині колони, м/с; Δрх – гідравлічний опір газорідинного шару на тарілці, Па. Загальну поверхню F (в м2) контакту фаз при масопередачі визначають із основного рівняння масопередачі
F = М / (К' Δс), (5.15)
де М – масова кількість речовини, що перейшла з однієї фази в іншу, кг або кмоль; К ' – коефіцієнт масопередачі, м3/с; Δс – рушійна сила процесу, кг/м3. Основним регульованим параметром процесу абсорбції є кінцева концентрація витягуваної речовини в газовій фазі, яка залежить від витрати газової суміші, концентрацій х в і х к, відношення L / G, температури і тиску процесу.
Адсорбція Загальні відомості Адсорбцією називають процес виборчого поглинання компонента газу, пари або розчину поверхнею твердого тіла – адсорбенту. Щоб процес цей був ефективним, активна поверхня адсорбенту має бути велика. Тому для адсорбції застосовуються пористі тіла, що мають велику поверхню. Розрізняють фізичну адсорбцію і хімічну (хемосорбцію). При поглинанні пари в порах адсорбенту в деяких випадках може статися конденсація пари і вони заповнюються рідиною. Цей процес називають капілярною конденсацією. У харчовій промисловості адсорбція застосовується для очищення водно-спиртових сумішей (сортувань) і для уловлювання спирту з газів в спиртовому виробництві, для знебварвлення соків і сиропів в цукровому, рафінадному і крахмало-паточном виробництвах, для освітлення пива в пивоварному виробництві. Процес адсорбції є оборотним. Поглинена речовина може бути виділена з адсорбенту шляхом відповідної його обробки. Цей процес називають десорбцією. Типи адсорбентів У харчових виробництвах застосовуються різні адсорбенти. Найбільш поширено активне деревне вугілля, що має пористу структуру з великою питомою поверхнею. Активна поверхня 1 кг активного вугілля складає від 600 до 1700 м2. Розмір часток активного вугілля коливається в межах 1…5 мм. Застосовується: кістяне вугілля; целюлозна маса; силікагель; діатоміт; перліт та ін. Процес адсорбції Активність адсорбенту. Під активністю адсорбенту понимаютего здатність поглинати речовину. Розрізняють статичну і динамічну активність. Статична активність адсорбенту – ця кількість сорбтива, яке поглинається до моменту досягнення рівноваги масовою або об'ємною одиницею адсорбенту при цій температурі і концентрації сорбтива в носії. Динамічна активність визначається кількістю сорбтива, поглиненого одиницею об'єму сорбенту при пропусканні через нього газу або рідини, сорбтив, що містять, до початку проскакування. Під проскакуванням розуміють проходження сорбтнва через шар сорбенту без затримки. Проскакування починаються через деякий час роботи сорбенту, коли поверхня його в якійсь мірі насичена сорбтивом. Активність сорбенту залежить від температури носителя і концентрації в нім сорбтива. Динамічна активність завжди менша за статичну. Витрату адсорбенту слід визначати по його динамічній активності. Розглянемо механізм процесу адсорбції. Експериментально встановлене, що
Впродовж першої стадії процесу адсорбції крива розподілу концентрацій, зображена на мал. 5.3, а, не міняє ні своєї форми, ні свого місця по висоті шару. Це відбувається тому, що умови поглинання залишаються незмінними до тих пір, поки не станеться насичення першого шару адсорбенту. До цього моменту адсорбована речовина не робитиме ніякого впливу на хід процесу, якщо допустити, що рівноважна концентрація його над поверхнею адсорбенту при усіх величинах поглинання, менших, ніж статична активність, дорівнює нулю. Починаючи з моменту насичення першого шару, тобто досягнення в нім величини насичення, рівної статичної активності, крива розподілу концентрацій починає переміщатися у напрямі осі абсцис, як це показано на мал. 5.3, б. Це відбувається в результаті послідовного насичення елементарних шарів адсорбенту. На другій стадії адсорбції умови поглинання абсолютно аналогічні таким на першій стадії, оскільки раніше насичені шари адсорбенту не роблять ніякого впливу на хід процесу. Переміщення кривої розподілу концентрацій на шар H 1 відповідає повному насиченню шару H 0. З приведеного виходить, що на відміну від інших массообменных процесів процес адсорбції протікає таким чином, що впродовж певного часу задана міра поглинання адсорбованої речовини зберігається. Цей час τ називається часом захисної дії шару. Масопередача в процесі адсорбції. Кількість речовини М (в кг), адсорбованого 1 м3 адсорбенту за годину (в с), при безперервній адсорбції може бути визначено по формулі
де Δ С – середня рушийна сила процесу; β – коефіцієнт масовіддачі. м/с. Величину коефіцієнта адсорбції
де Nu' і Pr' – дифузійні критерії Нуссельта й Прандтля; Re – число Рейнольдса. Величину коефіцієнта А и показники ступенів т и п визначають експериментально. При поглинанні пар активним вугіллям при орієнтовних розрахунках можна прийняти
Підставляючи в це рівняння значення Nu' і Рr', одержують
де D – коефіцієнт дифузії пари в середовищі носія при температурі процесу, м2/с; ν – коефіцієнт динамічної в'язкості, м2/с; d – діаметр часток поглинача, м. При інших температурах і тисках D визначають по формулі
D = D 0 (p 0 / p) (T / T 0)
Десорбція Процес витягання адсорбованої речовини з адсорбенту носити назву десорбції. Звільнений від поглиненої речовини адсорбент може бути використаний повторно. Таким чином, відбувається регенерація адсорбенту. Найчастіше процес десорбції здійснюється шляхом пропускання через адсорбент газу або парі. Десорбуючий агент витягає з адсорбенту поглинені компоненти. Після проведення десорбції адсорбент сушать. Силікагель регенерують продуванням сухого гарячого газу. Кістяне вугілля регенерують прожаренням в печах. Процеси десорбції проводять в апаратах періодичної або безперервної дії.
Іонообмінні процеси
Аніоніти обмінюються з оброблюваними електролітами аніонами, катіоніти – катіонами. Синтетичні іоніти, вживані в харчовій промисловості, відносяться за своїм характером до смол. Вони мають хімічну стійкість, механічну міцність і виборчу здатність до обміну певними іонами. Завдяки іонному обміну в харчовій промисловості здійснюється ряд процесів: зм'якшування і знесолювання води очищення водних розчинів етанолу від домішок та ін. Цей процес в економічних відносинах може конкурувати з процесом ректифікації Насичений поглиненим компонентом іоніт може бути регенерований при пропусканні через нього регенеруючого розчину При очищенні води таким розчином є, наприклад, розчин хлористого натрію. На мал. 5.4 показана схема іонообмінної установки періодичної дії.
Екстрагування
|
|||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 476; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.102.43 (0.01 с.) |

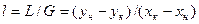
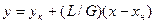
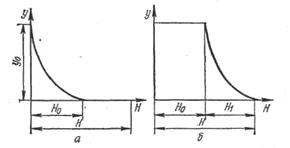
 при проходженні потоку газу через адсорбер не увесь шар Н адсорбенту в нім одночасно бере участь в роботі: спочатку лише шар заввишки Н 0 (мал. 5.3), в якому початкова концентрація витягуваної з газу речовини знижується до нуля; цей шар називають працюючим.
при проходженні потоку газу через адсорбер не увесь шар Н адсорбенту в нім одночасно бере участь в роботі: спочатку лише шар заввишки Н 0 (мал. 5.3), в якому початкова концентрація витягуваної з газу речовини знижується до нуля; цей шар називають працюючим.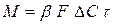 (5.16)
(5.16)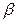 визначають експериментально. Теорія подоби приводить до наступної критеріальної залежності між дифузійними критеріями Нуссельта й Прандтля:
визначають експериментально. Теорія подоби приводить до наступної критеріальної залежності між дифузійними критеріями Нуссельта й Прандтля: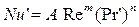 (5.17)
(5.17)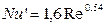 (5.18)
(5.18)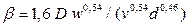 (5.19)
(5.19)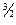 (5.20)
(5.20)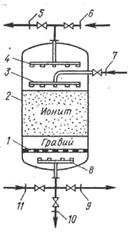
 Одними з різновидів адсорбентів є природні або синтетичні іоніти. Вони мають здатність обмінювати іони на еквівалентну кількість іонів того ж знаку з розчину, з яким вони взаємодіють. Таким чином витягаються і утримуються адсорбентом іони, що підлягають видаленню з розчину. Розрізняють іоніти двох пологів – аніоніти і катіоніти.
Одними з різновидів адсорбентів є природні або синтетичні іоніти. Вони мають здатність обмінювати іони на еквівалентну кількість іонів того ж знаку з розчину, з яким вони взаємодіють. Таким чином витягаються і утримуються адсорбентом іони, що підлягають видаленню з розчину. Розрізняють іоніти двох пологів – аніоніти і катіоніти.


