Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Екстрагування в системі рідина – рідина
Теорія процесу. Для екстрагування з рідкої суміші якого-небудь компонента підбирають розчинник, який не змішується з оброблюваною рідкою сумішшю, але добре розчиняє витягуваний компонент. Цей розчинник (екстрагент), таким чином, нерастворим в початковій рідині або слабо в ній розчинимо. В результаті обробки початкової рідини екстрагентом отримують дві рідкі фази. Однією з них є початкова рідина, що містить залишок витягуваних компонентів і деяку кількість екстрагента, оскільки важко підібрати абсолютно нерозчинний в початковій рідині екстрагент. Ця фаза називається рафинатной, або просто рафінатом. Другу фазу складає екстрагент з компонентами, витягнутими їм з початкової суміші. Ця фаза називається екстрактом. Розподіл витягуваного компонента між фазами визначається умовами рівноваги. У простому випадку, якщо екстрагент і початкова рідина повністю нерастворимы, умова рівноваги буде записана простим рівнянням
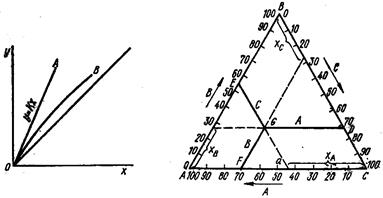
у = Кх,(5.21)
де у – концентрація витягуваного компонента в екстракті; х – концентрація витягуваного компонента в рафінаті; К – коефіцієнт розподілу. У координатах х – у лінія рівноваги ОА має вигляд прямої, що виходить з початку координат (мал. 5.5). Величина коефіцієнта розподілу К для заданої системи залежатиме тільки від температури. Якщо екстрагент частково розчинимо в початковій рідині, то лінія рівноваги ОВ не буде прямою, оскільки на величину коефіцієнта розподілу робить вплив взаємна розчинність. В цьому випадку лінія рівноваги відхиляється від прямої, наприклад лінія ОВ на мал. 5.5.
Оскільки в процесі екстракції, описаному вище, беруть участь три компоненти, то при розгляді процесу рідинної екстракції користуються трикутною діаграмою (мал. 5.6).
На мал. 5.6 представлений рівносторонній трикутник, на сторонах якого відкладений відсотковий вміст кожного з трьох компонентів. Вершини трикутника відповідають чистим компонентам А, В і С. На сторонах трикутника відмічені відрізки, що відповідають подвійним сумішам. Наприклад, точка а на стороні АС відповідає суміші, що не містить компонент В і що складається з 50% компонента А і 50% компонента С. Будь-яка точка G усередині трикутника зображує суміш трьох компонентів. Щоб визначити її склад, треба з точки G провести лінії, паралельні сторонам трикутника, як це показано на мал. 5.6. Склад суміші, що відповідає точці G, буде: х А =45%, х В = = 26%, х С = 29%. Принято вважати, що вершина А відповідає рідині, що екстрагується, точка С – екстрагенту, точка В – витягуваному компоненту.
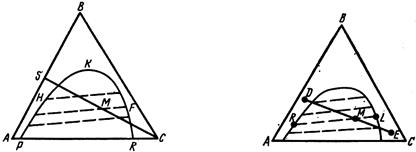
Початкова суміш містить рідину, що екстрагується, А і компонент В (див. мал. 5.7). Наприклад, точка S відповідає змісту 50% компонента А і 50% компонента В. Якщо до цієї суміші додати екстрагент, то склад суміші відповідатиме якійсь точці, що лежить усередині трикутника АВС. Можна довести, що у міру збільшення в суміші екстрагента усі точки, суміші, що відповідають проміжним складам, знаходитимуться на лінії SС.
Оскільки екстрагент тільки частково розчинимо в початковій рідині, то на потрійній діаграмі зображатимуться дві зони: гомогенна, де усі компоненти взаємно розчинні, і гетерогенна, де система має дві фази – рафінат і екстракт. Гетерогенна зона на мал. 5.7 лежить нижче лінії РКR. Нехай, наприклад, при збільшенні до початкової суміші екстракту отриманий склад суміші, зображений точкою М. Ця точка знаходиться в гетерогенній області, т.е. при цьому складі суміш розшаровуватиметься і утворюються дві рідкі фази: екстрактна і рафинатная. Склад цих фаз може бути знайдений експериментально, що дозволить побудувати в діаграмі лінії сполучення, або коноди. Ці лінії позначені на мал. 5.7 пунктиром. Нахил конод визначається величиною коефіцієнта розподілу К. Якщо, наприклад, при додаванні до суміші S екстрагента С отримана суміш, що зображується точкою М, то ця суміш розшарується, утворюючи дві фази. Склад однієї з них, екстрактною, буде даний точкою F, склад інший, рафинатной, – точкою Н. По мал. 5.7 можна визначити не лише склад фаз, але і співвідношення їх кількостей. Маси фаз відноситимуться один до одного згідно з рівнянням
GH / G F = MF / MH.
Це рівняння називається правилом важеля.
З викладеного витікає, що для процесу екстракції представляє інтерес тільки та область діаграми, яка лежить нижче області, що обмежує гетерогенну зону кривої. Саме у цій зоні можливе розшаровування і виведення з системи компонента, що екстрагується. Розглянута потрійна діаграма дозволяє зображувати графічно процес, що відбувається в екстракторі для рідини. Припустимо, що маємо потрійну діаграму для якої-небудь потрійної системи (мал. 5.8). Нехай склад початкової суміші заданий точкою D, а склад екстрагента – точкою Е. Припустимо, що кількість суміші із складом, що відповідає точці D, рівне G D (в кг), а кількість екстрагента узята G Е (в кг). При їх змішенні отримують склад суміші, що відповідає точці М. При цьому
GD / GЕ = МЕ / МD.
Отримана суміш, склад якої відповідає точці М, розшаровується, утворюючи екстракт і рафінат. Таким чином, в результаті одноразового контакту початкової суміші і екстрагента виходять дві фази, одна з яких (екстракт) збагачена компонентом D, а інша, навпаки, збіднена (рафінат). Кількість цих фаз може бути знайдена з мал. 5.8 по рівнянню
GR / GL = МL / МR.
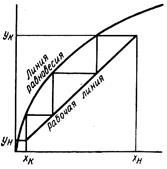
Рідинну екстракцію можна представити як простіший процес, якщо вважати, що початкова рідина і екстрагент взаємно нерозчинні. Тоді графічна побудова значно спроститься і може бути представлено діаграмою, приведеною на мал. 5.9. На цій діаграмі приведені лінія рівноваги і робоча лінія. На горизонтальній осі відкладені концентрація компонента, що екстрагується, в рідині, що екстрагується, на вертикальній осі – концентрація компонента, що екстрагується, в екстрагенті.
Робочу лінію будують по заданих кінцевих і початкових концентраціях компонента, що екстрагується, в екстрагенті. Побудувавши ступінчастий графік, отримують число східців концентрації, необхідне для проведення екстракції в заданих межах концентрації. Рівняння робочої лінії може бути отримане з матеріального балансу компонента, що поглинається
G 1 (x н – x к) = G 2 (y к – yн). (5.22)
де G 1 – кількість рідини, що екстрагується, кг; G 2 – кількість екстрагента, кг. Звідси одержують рівняння робочої лінії
G 1 / G 2 = (y к – yн) / (x н – x к). (5.23)
Кристалізація Розчин твердих речовин. Якщо при деякій постійній температурі розчинити яку-небудь тверду речовину в якому-небудь розчиннику (наприклад, цукор у воді), то при певному вмісті розчинної речовини в розчині подальше його розчинення припиняється. Такий розчин називається насиченим. Ті розчини, які ще можуть розчиняти цю речовину, називаються ненасиченими. Насичений розчин містить максимально можливу кількість речовини, що розчиняється. Якщо насичений розчин є у контакті з кристалами розчиненої речовини, то стан його не міняється. Розчинністю називається концентрація цієї речовини в насиченому розчині. Вона вимірюється у відсотках до маси розчину або кількістю частин розчиненої речовини на 1 частину води. Наприклад, розчинність сахарози при 20°С складає 66,92% або на 1 частину води доводиться 2,023 частини сахарози. При підвищенні температури для більшості твердих речовин розчинність збільшується. Так, розчинність сахарози у воді при 60°С складає 74,43%, а при 100°С – 82,87%. Растворимость залежить також від міри чистоти розчину. Домішки, що містяться в розчині, змінюють розчинність. Якщо розчин містить розчинної речовини більше, ніж в насиченому стані, то він називається перенасиченим. Перенасичення розчину досягається в наступних процесах:
1) при випарюванні розчинника під час кипіння розчину у випарному апараті; 2) при випарі розчинника у відкритій посудині при температурі, яка нижче температури кипіння; 3) при охолодженні насиченого розчину; в цьому випадку розчин стає перенасиченим, оскільки розчинність більшості солей зменшується при зниженні температури; 4) при збільшенні в розчин водовіднімаючих речовин; в цьому випадку частина води буде пов'язана водовіднімаючою речовиною. Розчинність речовини також зменшується у присутності солей з однаковим іоном. Тому при додаванні до розчину солі з тим же іоном відбувається іонне висолювання. Для прикладу можна вказати на зменшення розчинності КСl у присутності NaCl. Оскільки пересичений розчин містить надмірну кількість розчиненої речовини, то він нестійкий і з нього може виділитися надмірна кількість речовини у вигляді кристалів. При цьому він стає насиченим і стійким. Пересичення розчину характеризується коефіцієнтом пересичення П. Величина П – це відношення вмісту розчиненої речовини в пересиченому розчині до змісту його в насиченому розчині. При П < 1 розчини не насичені, при П = 1 розчини насичені, при П > 1 розчини пересичені. Окрім цих понять представляє інтерес коефіцієнт насичення, який показує, в скільки разів змінюється розчинність основного продукту у присутності домішок.
|
|||||||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 349; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.130.165 (0.016 с.) |