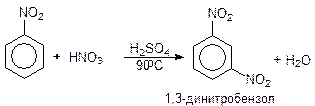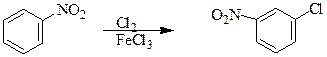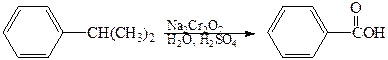Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ди- и полизамещение (правила ориентации) ⇐ ПредыдущаяСтр 3 из 3
Существенной особенностью реакций электрофильного замещения является то, что новые заместители вступают в бензольное кольцо в определенные положения по отношению к уже имеющимся заместителям. Закономерности, определяющие направления реакций замещения в бензольном ядре, называются правилами ориентации. Ориентирующее влияние заместителей обусловлено их электронными эффектами (статический фактор) и стабильностью промежуточно образующихся аренониевых ионов – s-комплексов (динамический фактор). Статический фактор отражает распределение электроннной плотности в молекуле субстрата. Например в толуоле, где электронодонорная группа СН3 повышает электронную плотность на всех атомах углерода кольца, но особенно в орто- и пара -положениях, т.е. активирует эти положения больше, чем мета -положения. В нитробензоле электроноакцепторная нитрогруппа понижает электронную плотность кольца, причем орто- и пара -положения дезактивируются больше, чем мета -положения.
Динамический фактор, т.е. стабилизирующее или дестабилизирующее влияние заместителя на образующиеся в ходе реакции аренониевые ионы, имеет важнейшее значение. Дезактивирующие заместители дестабилизируют s-комплекс и увеличивают энергию активации стадии, приводящей к его образованию. Группы, активирующие бензольное кольцо, стабилизируют s-комплекс, снижают его энергию и энергию активации образования s-комплекса.
Таблица 1. Влияние заместителей на реакции SEAr
Заместители, подающие электроны на бензольное кольцо и ориентирующие заместитель в орто- и пара-положения называют заместителями I рода. Заместители, оттягивающие электроны с бензольного кольца и ориентирующие заместитель в мета -положение называют заместителями II рода. В дизамещенных производных бензола ориентирующее влияние заместителей будет согласованным, если заместители направляют электрофильный реагент в одни и те же положения кольца. Возможны случаи и несогласованной ориентации, когда ориентирующее влияние одного заместителя не совпадает по направлению с влиянием другого заместителя. При несогласованной ориентации заместители конкурируют между собой, что приводит к образованию смеси продуктов. Но и в этом случае можно предсказать основное направление реакции, руководствуясь следующими обобщениями.
Если в бензольном кольце имеются сильная и слабая активирующие группы, то ориентация в основном определяется сильной группой. Если в бензольном кольце имеются активирующая и дезактивирующая группы, то ориентация электрофильного реагента определяется главным образом активирующей группой. Атакующий электрофил, как правило, не замещает водород в кольце между двумя заместителями, находящимися в мета -положении относительно друг друга. Атаку электрофила затрудняют стерические препятствия, что ососбенно важно, когда с кольцом связаны объемные заместители. Направление реакции и соотношение изомеров в электрофильном ароматическом замещении зависит также от активности электрофильного реагента Е+ и от пространственных факторов. Чем выше активность электрофильного реагента Е+, тем меньше его избирательность. Состав продуктов реакции при несогласованной ориентации заместителей подчиняется определенным правилам: - все орто, пара -ориентанты доминируют над мета -ориентантами, - все активирующие орто, пара -ориентанты доминируют над галогенами, - сильно и умеренно активирующие орто, пара -ориентанты доминируют над более слабыми орто, пара -ориентантами. Нитробензол путем длительного нагревания с использованием концентрированных кислот способен нитроваться до динитробензола, в основном мета.
Полинитросоединения сами по себе используются в качестве взрывчатых веществ. Гидрированием м -динитробензола получают м -фенилендиамин.
м -динитробензол м -фенилендиамин
Реакционная способность хлорбензола в нитровании ниже, чем реакционная способность бензола. Нитрование хлорбензола приводит к образованию орто- и пара- хлорбензолов. Галогены являются орто, пара -ориентантами, но при этом дезактивируют электрофильное замещение, так как у них –J > +M.
орто- хлорбензол пара- хлорбензол
Хлорирование нитробензола дает мета- хлорнитробензол
Алкилбензолы Алкилбензолы вступают в реакцию радикального хлорирования и бромирования боковой цепи. Эта реакция протекает по цепному механизму, как и радикальное галогенирование алканов, и включает стадии инициирования, роста и обрыва цепи. Для инициирования образования радикальных частиц используется освещение ультрафиолетовым светом (фотолиз) или высокие температуры – 450-500оС (термолиз). При фотохимическом или термическом хлорировании толуола возможно замещение всех трех атомов водорода, при этом каждый последующий атом замещается труднее предыдущего. Поэтому реакцию можно останавливать на любой стадии.
бензилхлорид дихлорметилбензол трихлорметилбензол
Алкильные группы, присоединенные к бензольному кольцу, легко окисляются такими окислителями, как дихромат натрия в серной кислоте, оксид хрома (VI) в уксусной кислоте, перманганат калия или азотная кислота. Наиболее часто для окисления боковых цепей используют соединения хрома (VI) и перманганат калия. Конечными продуктами являются ароматические карбоновые кислоты.
толуол бензойная кислота
изопропилбензол бензойная кислота (кумол)
1,4-диметилбензол 1,4-бензолдикарбоновая кислота (п -ксилол) (терефталевая кислота)
|
||||||||||
|
Последнее изменение этой страницы: 2017-01-26; просмотров: 731; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.108.54 (0.009 с.) |