
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Б. Влияние заместителей на электрофильное замещение в (правила ориентации)
Существенной особенностью реакций электрофильного замещения является то, что новые заместители вступают в бензольное кольцо в определенные положения по отношению к уже имеющимся заместителям. Закономерности, определяющие направления реакций замещения в бензольном ядре, называются правилами ориентации. При проведении реакции E+ с ареном, имеющим заместитель, отличаются два эффекта, зависящих лишь от имеющегося заместителя, и не зависящих от реагента. Заместитель может подавать электроны на бензольное кольцо и тем самым облегчать образование s-комплекса, или наоборот, т. е. заместитель будет облегчать или затруднять реакцию. Кроме того, он будет ориентировать присоединение электрофила таким образом, чтобы образующийся s-комплекс был наиболее стабильным или наименее нестабильным:
сравнительно устойчив очень неустойчив Ориентирующее влияние заместителей обусловлено их электронными эффектами (статический фактор) и стабильностью промежуточно образующихся аренониевых ионов – s-комплексов (динамический фактор). Статический фактор отражает распределение электроннной плотности в молекуле субстрата. Например в толуоле, где электронодонорная группа СН3 повышает электронную плотность на всех атомах углерода кольца, но особенно в орто- и пара -положениях, т.е. активирует эти положения больше, чем мета -положения. В нитробензоле электроноакцепторная нитрогруппа понижает электронную плотность кольца, причем орто- и пара -положения дезактивируются больше, чем мета -положения.
Динамический фактор, т.е. стабилизирующее или дестабилизирующее влияние заместителя на образующиеся в ходе реакции аренониевые ионы, имеет важнейшее значение. Дезактивирующие заместители дестабилизируют s-комплекс и увеличивают энергию активации стадии, приводящей к его образованию. Группы, активирующие бензольное кольцо, стабилизируют s-комплекс, снижают его энергию и энергию активации образования s-комплекса. Заместители, подающие электроны на бензольное кольцо и ориентирующие заместитель в орто- и пара-положения называют заместителями I рода. Заместители, оттягивающие электроны с бензольного кольца и ориентирующие заместитель в мета -положение называют заместителями II рода.
К ориентантам I относятся: OH, OR, OCOR, NH2, NHR. NR2, NHCOR, F, Cl, Br, I. К ориентантам II относятся: SO3H, NO2, COOH, COOR, CONH2, CHO, COR, CN, CCl3, CF3. В дизамещенных производных бензола ориентирующее влияние заместителей будет согласованным, если заместители направляют электрофильный реагент в одни и те же положения кольца. Возможны случаи и несогласованной ориентации, когда ориентирующее влияние одного заместителя не совпадает по направлению с влиянием другого заместителя. При несогласованной ориентации заместители конкурируют между собой, что приводит к образованию смеси продуктов. Но и в этом случае можно предсказать основное направление реакции, руководствуясь следующими обобщениями. Если в бензольном кольце имеются сильная и слабая активирующие группы, то ориентация в основном определяется сильной группой. Если в бензольном кольце имеются активирующая и дезактивирующая группы, то ориентация электрофильного реагента определяется главным образом активирующей группой. Атакующий электрофил, как правило, не замещает водород в кольце между двумя заместителями, находящимися в мета -положении относительно друг друга. Атаку электрофила затрудняют стерические препятствия, что ососбенно важно, когда с кольцом связаны объемные заместители.
Нитрование Нитрование аренов является первой стадией в синтезе большого количества соединений. При действии на бензол концентрированной азотной кислоты, а еще лучше смеси азотной и серной кислот 1:2 (нитрующая смесь) атом водорода бензола замещается на нитрогруппу:
Серная кислота играет роль катализатора, способствующего образованию нитроил-катиона (нитрониевого катиона).
нитроний Механизм 1. Реакция нитрониевого катиона с p системой ароматического кольца.
бензол и нитроний катион промежуточный циклогексадиенил катион
2. Потеря протона циклогексадиенил катионом.
циклогексадиенил катион нитробензол гидроний
Нитробензол путем длительного нагревания с использованием концентрированных кислот способен нитроваться до динитробензола, в основном мета.
При присоединении нитрония в о - или п -положение к нитрогруппе возникает очень неустойчивый s-комплекс, в то время как в м -положение – не очень неустойчивый:
очень неустойчивый
Не очень неустойчивый
Полинитросоединения сами по себе используются в качестве взрывчатых веществ. Нитрогруппа ароматических нитросоединений далее легко может быть восстановлена в аминогруппу, что дает возможность получать ароматические амины. Гидрированием нитробензола получают анилин.
анилин
Его получают также восстановлением железом или оловом в кислой среде. При этом сначала образуется соль – анилинийхлорид. При действии на него щелочи высвобождается анилин.
анилин
Гидрированием м -динитробензола получают м -фенилендиамин.
м -динитробензол м -фенилендиамин
Использование в качестве восстановителя сероводорода позволяет восстанавливать одну из двух нитрогрупп:
м -динитробензол м -нитроанилин Сульфирование
Сульфирование - реакция электрофильного замещения, в результате которой в ароматическое ядро вводится группа - SO2R, где R = OH, Hal, Ar, R. В качестве сульфирующих агентов чаще всего используют серную кислоту различных концентраций, олеум и хлорсульфоновую кислоту. Cульфирование бензола можно осуществлять, используя дымящуюся серную кислоту (серная кислота, содержащая триоксид серы):
Бензол сульфируется и просто в концентрированной серной кислоте, но только медленнее. Механизм сульфирования не так хорошо изучен, как механизм нитрования. Предполагается, что непосредственно сульфирующим реагентом является оксид серы (VI). В концентрированной серной кислоте SO3 возникает в результате следующей реакции:
Механизм 1. Бензол атакуется триоксидом серы
бензол и триоксид серы циклогексадиенильный катион
2. Потеря протона циклогексадиенил катионом.
промежуточный бензолсульфонат циклопентадиенильный катион
3. Передача протона от серной кислоты к бензолсульфонату.
бензолсульфонат бензолсульфоновая кислота
Особенностью реакции сульфирования является ее обратимость. Для осуществления обратной реакции удаления сульфогруппы через смесь бензолсульфокислоты с разбавленной серной кислотой пропускают перегретый водяной пар. Такая реакция называется десульфированием.
Обратимость сульфирования позволяет вводить в кольцо дейтерированную метку:
дейтеробензол
Галогенирование Без катализатора бензол не реагирует ни с хлором, ни с бромом. При добавлении же кислот Льюиса бензол легко бромируется и хлорируется.
бензол хлорбензол
Активным катализатором является не само железо, а хлорид железа (III) образующийся при взаимодействии железа с хлором.
Хлорид железа (III) является слабой кислотой Льюиса. Он соединяется с хлором с образованием кислотно-основного комплекса
кислотно-основный комплекс
При галогенировании в присутствии кислот Льюиса в качестве электрофилов выступают комплексы галогенов с кислотами Льюиса.
Механизм
циклодиенильный катион
2. Потеря протона циклодиенильным катионом
тетрахлорферрат
При хлорировании бензола побочно образуются ди- и трихлорбензолы:
1,2-дихлор- 1,4-дихлор- 1,2,4-трихлор- бензол бензол бензол
Нитрование хлорбензола приводит к образованию орто- и пара- хлорбензолов.
орто- хлорбензол пара- хлорбензол
Хлорирование нитробензола дает мта- хлорнитробензол
мета- хлорбензолов
Алкилирование
Важный метод синтеза алкилбензолов состоит в действии на ароматические соединения алкилгалогенидов при каталитическом участии галогенидов металлов, обычно хлорида алюминия. Этот способ называют алкилированием по Фриделю-Крафтсу. Катализатор обеспечивает образование катиона, который и атакует молекулу ароматического соединения. Алкилированием бензола трет- бутилхлоридом получают трет- бутилбензол:
трет- бутилхлорид трет- бутилбензол
Алкилгалогениды сами по себе недостаточно электрофильны чтобы реагировать с бензолом, а вот их кислотно-основные комплексы с хлоридом алюминия могут
кислотно-основный комплекс предварительно генерируя карбокатионы
трет- бутил катион тетрахлоралюминат Механизм 1. трет- Бутил катион атакует p-электроны бензола с образованием углерод-углеродной связи
циклодиенильный катион
Продуктом алкилирования бензола изобутилхлоридом является трет -бутилбензол:
изобутилхлорид трет- бутилбензол
Реакция проходит по сходному механизму:
Алкилированием бензола этилбромидом можно получить этилбензол:
этилбензол Механизм
Алкилирование бензола н-бутилхлоридом приводит к образованию двух продуктов
н-бутилхлорид н-бутилбензол втор -бутилбензол
Любой компонент смеси, способный образовывать карбокатион, может алкилировать бензол. Наиболее часто источниками карбокатионов служат алкены и спирты, генерирующие катионы при взаимодействии с сильными кислотами. Алкилированием бензола этиленом получают этилбензол:
Алкилированием бензола пропиленом получают кумол:
А. Хлорметилирование Частным случаем алкилирования является реакция бензола с формальдегидом и HCl в присутствии хлорида цинка приводящая к образованию бензилхлорида:
бензилхлорид Ацилирование В этой реакции, сходной с алкилированием по Фриделю-Крафтсу, ацилгалогенид реагирует с бензолом в присутствии избытка безводного хлорида алюминия. В качестве растворителей при ацилировании обычно используют нитробензол или сероуглерод.
Ацилхлориды получают из карбоновых кислот действием на ни8х SOCl2 или PCl5:
Ацилированием бензола пропионилхлоридом получают пропиофенон:
Пропионилхлорид пропиофенон Механизм:
Для получения моноалкиларенов не опасаясь перегруппировок, прибегают к ацилированию с последующим восстановлением карбонильной группы в метиленовую. Одним из методов такого восстановления является реакция Клеменсена. По Клеменсену кетон нагревают в соляной кислоте, содержащей амальгамированный цинк:
пропиофенон пропилбромид Применение реакции Фриделя-Крафтса имеет следующие ограничения: 1. Реакции алкилирования сопровождаются перегруппировками. 2. Реакции алкилирования сопровождаются образованием полиалкиларенов. 3. В реакцию Фриделя-Крафтса (алкилирования и ацилирования) не вступают соединения, содержащие электроноакцепторные группы. 4. В реакцию Фриделя-Крафтса не вступают арил- и винилгалогениды.
Алкилбензолы Алкилбензолы вступают в реакцию радикального хлорирования и бромирования боковой цепи. Эта реакция протекает по цепному механизму, как и радикальное галогенирование алканов, и включает стадии инициирования, роста и обрыва цепи. Для инициирования образования радикальных частиц используется освещение ультрафиолетовым светом (фотолиз) или высокие температуры – 450-500оС (термолиз). При фотохимическом или термическом хлорировании толуола возможно замещение всех трех атомов водорода, при этом каждый последующий атом замещается труднее предыдущего. Поэтому реакцию можно останавливать на любой стадии.
бензилхлорид дихлорметилбензол трихлорметилбензол
Использование в качестве бромирующего средства бромсукцинимида позволяет осуществлять бензильное бромирование алкиларенов в боковую цепь:
толуол N-бромосукцинимид бензилбромид сукцинимид
этилбензол 1-бром-1-фенилэтанэтан
Алкильные группы, присоединенные к бензольному кольцу, легко окисляются такими окислителями, как дихромат натрия в серной кислоте, оксид хрома (VI) в уксусной кислоте, перманганат калия или азотная кислота. Наиболее часто для окисления боковых цепей используют соединения хрома (VI) и перманганат калия. Конечными продуктами являются ароматические карбоновые кислоты.
толуол бензойная кислота
изопропилбензол бензойная кислота (кумол)
1,4-диметилбензол 1,4-бензолдикарбоновая кислота (п -ксилол) (терефталевая кислота)
|
||||||||
|
Последнее изменение этой страницы: 2017-01-26; просмотров: 2630; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.104.238 (0.073 с.) |


 (4)
(4)



 (5)
(5)

 (6)
(6) (6а)
(6а) (7)
(7) (8)
(8) (9)
(9)


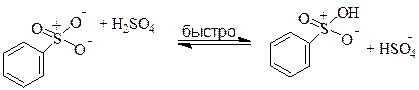
 (10)
(10) (11)
(11) (12)
(12)



 (13)
(13) (14)
(14) (15)
(15) (16)
(16)



 (17)
(17)
 (18)
(18)

 (19)
(19) (20)
(20) (21)
(21) (22)
(22)
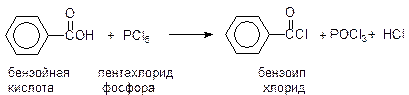

 (23)
(23)

 (24)
(24) (25)
(25)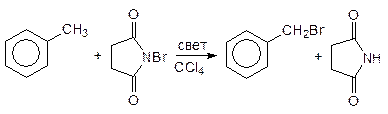 (26)
(26) (27)
(27) (28)
(28) (29)
(29)
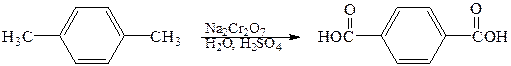 (30)
(30)


