
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
А. Аннулены. Правило ХюккеляСтр 1 из 4Следующая ⇒
АРЕНЫ (пособие для самостоятельной работы студентов)
А.И. Кузнецов 23 27.11.10
Оглавление А. Аннулены. Правило Хюккеля 2 Б. Стабильность бензола 2 В. Ароматичность 3 Г. Строение бензола 3 Д. Конденсированные ароматические углеводороды 5 Е. Ароматические ионы 5 Ж.Ароматические гетероциклические соединения 7 6.1. Электрофильное ароматическое замещение 6 А. Механизм электрофильного ароматического замещения 12 Б. Влияние заместителей на электрофильное замещение (правила ориентации) 13 6.1.1. Нитрование 9 6.1.2. Сульфирование 11 6.1.3. Галогенирование 12 6.1.4. Алкилирование 14 А. Хлорметилировани 16 6.1.5. Ацилирование 16 6.2. Алкилбензолы 17 А. Кумольный метод получения фенола и ацетона 19 6.2.1. Реакции электрофильного замещения алкилбензолов 19 А. Нитрование 19 Б. Сульфирование 21 В. Галогенирование 21 6.3. Реакции электрофильного замещения нафталина 22 6.4. Восстановление Аренов по Берчу 24 6.5.Окисление аренов 24 6.6. Стирол 25 А. Анионная полимеризация стирола 26 Фуллерены и нанотрубки 28
АРЕНЫ
История ароматических соединений началась в 1825 году, когда английский ученый Фарадей выделил бензол из осветительного газа. В 1834 году немецкий химик Митчерлих получил бензол нагреванием бензойной кислоты с оксидом кальция и установил, что он имеет формулу С6Н6.
В 1865 г Кекуле предложил формулу бензола. В конце 19 века в органической химии распространилась теория строения органических соединений (Бутлеров - Кекуле и Купер). В результате все соединения были разделены на алифатические и ароматические углеводороды.
А. Аннулены. Правило Хюккеля В случае циклических соединений сопряжение может быть циклическим кольцевым. Группа соединений с одинаковой эмпирической формулой (СН)n и циклической структурой называют аннуленами. Их номенклатура ясна из приводимых примеров. Некоторые из аннуленов обладают повышенной термодинамической стабильностью
[4]-аннулен [8]-аннулен [14]-аннулен
Хюккель вывел правило, по которому: ароматичностью обладают карбоциклы имеющие плоское строение и содержащие в замкнутой системе сопряжения (4n + 2) p-электронов. Из правила Хюккеля следует, что [2], [6] и [10]-аннулены должны быть ароматическими. Понятие ароматичности возникло раньше правила Хюккеля. Правило Хюккеля является лишь квантовомеханическим критерием ароматичности.
Б. Стабильность бензола Гидрирование бензола в присутствии платинового или никелевого катализатора приводит к образованию циклогексана:
бензол циклогексан
При этом продуктов неполного гидрирования (циклогексена и 1,3-циклогексадиена) не образуется. При гидрировании циклогексена выделяется 28,6 ккал/моль.
цикоогексен циклогексан
При гидрировании 3 молей циклогексена, таким образом, выделяется 28,6 х 3 = 85,8 ккал/моль. Если из этой суммы вычесть энергию, выделяющуюся при гидрировании одного моля бензола, содержащего то же количество кратных связей, что и три моля циклогексена (85,8 - 49,8 = 36 ккал. моль), получим энергию стабилизации или энергию резонанса в бензоле. Энергия стабилизации представляет собой разницу между вычисленной энергией, которая могла бы выделиться при гидрировании гипотетического 1,3,5-циклогексатриена в случае отсутствия в нем делокализации электронов и экспериментально найденной энергией, выделяющейся при гидрировании реального бензола.
В. Ароматичность Термин «ароматический» возник потому, что многие соединения - бензальдегид, бензиловый спирт, эфиры бензойной кислоты, содержащие бензольные кольца, были выделены из различного рода ладанов, ароматических масел и бальзамов. Ароматические соединения отличаются по свойствам от других ненасыщенных соединений:
Критериями ароматичности являются: - высокая термодинамическая стабильность; - ненасыщенный характер их молекул почти не проявляется; - они трудно вступают в реакцию присоединения; - соединение считается тем ароматиченее, чем менее реакционноспособны его двойные связи, и чем выше его термодинамическая стабильность; - ароматические соединения отличаются от алифатических соединений по их поведению по отношению к электрофильным реагентам: электрофильные реагенты при взаимодействии с ароматическими соединениями не присоединяются по их кратным связям, а замещают атомы водорода, связанные с ароматическими циклами;
- легкость образования аренов в различных реакциях; - устойчивость к действию окислителей. Г. Строение бензола
Данные современных физико-химических методов указывают на то, что все С-С и С-Н связи в бензоле эквивалентны. Согласно этим данным, бензол представляет собой правильный гексагон с длиной С-С связи 1,397 Å и валентным углом 120о. Образование s-связей С-С можно представить как результат продольного перекрывания sp 2-гибридных орбиталей углерода, при этом шесть негибридных p -орбиталей шести атомов углерода образуют замкнутую p-электронную систему за счет бокового перекрывания. Образующийся при этом секстет p-электронов обусловливает особые свойства и стабильность бензола.
Согласно теории МО, шесть атомных p -орбиталей атомов углерода комбинируются с образованием шести молекулярных p-орбиталей, из которых три являются связывающими, а три – разрыхляющими. Чтобы показать равномерность распределения электронной плотности в молекуле бензола, структурную формулу его часто изображают в виде шестиугольника с окружностью внутри:
Для оценки устойчивости плоских полностью сопряженных циклических p-систем по относительной энергии молекулярных орбиталей удобно пользоваться графическим методом по Фросту, Кулсону (Coulson). Систему представляют правильным многоугольником и вписывают в окружность таким образом, чтобы одна из вершин располагалась в точке пересечения вертикально проведенного диаметра с нижней частью круга. Точки, в которых вершины многоугольника касаются круга, считают уровнями энергии молекулярных орбиталей, а вертикальный диаметр - координатой энергии, на которой горизонтальный диаметр обозначает несвязывающий уровень. Рассмотрим с помощью круга Фроста уровни энергии бензола. В бензоле имеются три связывающие и три разрыхляющие p орбитали. Все три связывающие p орбитали бензола полностью заняты, и на каждой из них размещаются по два электрона с антипараллельными спинами. Все разрыхляющие p орбитали бензола в основном состоянии не заняты электронами.
Гексагон энергетические в цикле уровни МО Рис.1Диаграмма относительных уровней энергии p-молекулярных орбиталей бензола
Для плоского квадратного циклобутадиена расчет по Хюккелю или использование круга Фроста приводит к тому, что p-электроны располагаются на одной связывающей и двух несвязывающих орбиталях.
Рис. 2Диаграмма относительных уровней энергии p-молекулярных орбиталей циклобутадиена
Рассмотрим, что предсказывает теория Хюккеля для плоского циклооктатетраена, содержащего 8 p-электронов. Три p-орбитали циклооктатетраена являются связывющими, три - разрыхляющими и две - несвязывающими. Следовательно, плоский сопряженный циклооктатетраен должен быть бирадикалом. Циклооктатетраен неплоский, потому что он неароматичен.
Рис. 3 Диаграмма относительных уровней энергии p-молекулярных орбиталей циклооктатетраена
Е. Ароматические ионы Правило Хюккеля применимо не только для циклических, полностью сопряженных полиенов, но и для плоских циклических ионов, содержащих, как и полиены, (4 n + 2)p-электронов. Оно правильно предсказывает ароматический характер катиона циклопропенилия, двухзарядного катиона циклобутадиенилия (n = 0), аниона циклопентадиена и катиона циклогептатриена (n = 1), дианиона циклооктатетраена и т.д.
Пиридин пиррол фуран тиофен
Нитрование Нитрование аренов является первой стадией в синтезе большого количества соединений. При действии на бензол концентрированной азотной кислоты, а еще лучше смеси азотной и серной кислот 1:2 (нитрующая смесь) атом водорода бензола замещается на нитрогруппу:
Серная кислота играет роль катализатора, способствующего образованию нитроил-катиона (нитрониевого катиона).
нитроний Механизм 1. Реакция нитрониевого катиона с p системой ароматического кольца.
бензол и нитроний катион промежуточный циклогексадиенил катион
2. Потеря протона циклогексадиенил катионом.
циклогексадиенил катион нитробензол гидроний
Нитробензол путем длительного нагревания с использованием концентрированных кислот способен нитроваться до динитробензола, в основном мета.
При присоединении нитрония в о - или п -положение к нитрогруппе возникает очень неустойчивый s-комплекс, в то время как в м -положение – не очень неустойчивый:
очень неустойчивый
Не очень неустойчивый
Полинитросоединения сами по себе используются в качестве взрывчатых веществ. Нитрогруппа ароматических нитросоединений далее легко может быть восстановлена в аминогруппу, что дает возможность получать ароматические амины. Гидрированием нитробензола получают анилин.
анилин
Его получают также восстановлением железом или оловом в кислой среде. При этом сначала образуется соль – анилинийхлорид. При действии на него щелочи высвобождается анилин.
анилин
Гидрированием м -динитробензола получают м -фенилендиамин.
м -динитробензол м -фенилендиамин
Использование в качестве восстановителя сероводорода позволяет восстанавливать одну из двух нитрогрупп:
м -динитробензол м -нитроанилин Сульфирование
Сульфирование - реакция электрофильного замещения, в результате которой в ароматическое ядро вводится группа - SO2R, где R = OH, Hal, Ar, R. В качестве сульфирующих агентов чаще всего используют серную кислоту различных концентраций, олеум и хлорсульфоновую кислоту. Cульфирование бензола можно осуществлять, используя дымящуюся серную кислоту (серная кислота, содержащая триоксид серы):
Бензол сульфируется и просто в концентрированной серной кислоте, но только медленнее. Механизм сульфирования не так хорошо изучен, как механизм нитрования. Предполагается, что непосредственно сульфирующим реагентом является оксид серы (VI). В концентрированной серной кислоте SO3 возникает в результате следующей реакции:
Механизм 1. Бензол атакуется триоксидом серы
бензол и триоксид серы циклогексадиенильный катион
2. Потеря протона циклогексадиенил катионом.
промежуточный бензолсульфонат циклопентадиенильный катион
3. Передача протона от серной кислоты к бензолсульфонату.
бензолсульфонат бензолсульфоновая кислота
Особенностью реакции сульфирования является ее обратимость. Для осуществления обратной реакции удаления сульфогруппы через смесь бензолсульфокислоты с разбавленной серной кислотой пропускают перегретый водяной пар. Такая реакция называется десульфированием.
Обратимость сульфирования позволяет вводить в кольцо дейтерированную метку:
дейтеробензол
Галогенирование Без катализатора бензол не реагирует ни с хлором, ни с бромом. При добавлении же кислот Льюиса бензол легко бромируется и хлорируется.
бензол хлорбензол
Активным катализатором является не само железо, а хлорид железа (III) образующийся при взаимодействии железа с хлором.
Хлорид железа (III) является слабой кислотой Льюиса. Он соединяется с хлором с образованием кислотно-основного комплекса
кислотно-основный комплекс
При галогенировании в присутствии кислот Льюиса в качестве электрофилов выступают комплексы галогенов с кислотами Льюиса.
Механизм
циклодиенильный катион
2. Потеря протона циклодиенильным катионом
тетрахлорферрат
При хлорировании бензола побочно образуются ди- и трихлорбензолы:
1,2-дихлор- 1,4-дихлор- 1,2,4-трихлор- бензол бензол бензол
Нитрование хлорбензола приводит к образованию орто- и пара- хлорбензолов.
орто- хлорбензол пара- хлорбензол
Хлорирование нитробензола дает мта- хлорнитробензол
мета- хлорбензолов
Алкилирование
Важный метод синтеза алкилбензолов состоит в действии на ароматические соединения алкилгалогенидов при каталитическом участии галогенидов металлов, обычно хлорида алюминия. Этот способ называют алкилированием по Фриделю-Крафтсу. Катализатор обеспечивает образование катиона, который и атакует молекулу ароматического соединения. Алкилированием бензола трет- бутилхлоридом получают трет- бутилбензол:
трет- бутилхлорид трет- бутилбензол
Алкилгалогениды сами по себе недостаточно электрофильны чтобы реагировать с бензолом, а вот их кислотно-основные комплексы с хлоридом алюминия могут
кислотно-основный комплекс предварительно генерируя карбокатионы
трет- бутил катион тетрахлоралюминат Механизм 1. трет- Бутил катион атакует p-электроны бензола с образованием углерод-углеродной связи
циклодиенильный катион
Продуктом алкилирования бензола изобутилхлоридом является трет -бутилбензол:
изобутилхлорид трет- бутилбензол
Реакция проходит по сходному механизму:
Алкилированием бензола этилбромидом можно получить этилбензол:
этилбензол Механизм
Алкилирование бензола н-бутилхлоридом приводит к образованию двух продуктов
н-бутилхлорид н-бутилбензол втор -бутилбензол
Любой компонент смеси, способный образовывать карбокатион, может алкилировать бензол. Наиболее часто источниками карбокатионов служат алкены и спирты, генерирующие катионы при взаимодействии с сильными кислотами. Алкилированием бензола этиленом получают этилбензол:
Алкилированием бензола пропиленом получают кумол:
А. Хлорметилирование Частным случаем алкилирования является реакция бензола с формальдегидом и HCl в присутствии хлорида цинка приводящая к образованию бензилхлорида:
бензилхлорид Ацилирование В этой реакции, сходной с алкилированием по Фриделю-Крафтсу, ацилгалогенид реагирует с бензолом в присутствии избытка безводного хлорида алюминия. В качестве растворителей при ацилировании обычно используют нитробензол или сероуглерод. Ацилхлориды получают из карбоновых кислот действием на ни8х SOCl2 или PCl5:
Ацилированием бензола пропионилхлоридом получают пропиофенон:
Пропионилхлорид пропиофенон Механизм:
Для получения моноалкиларенов не опасаясь перегруппировок, прибегают к ацилированию с последующим восстановлением карбонильной группы в метиленовую. Одним из методов такого восстановления является реакция Клеменсена. По Клеменсену кетон нагревают в соляной кислоте, содержащей амальгамированный цинк:
пропиофенон пропилбромид Применение реакции Фриделя-Крафтса имеет следующие ограничения: 1. Реакции алкилирования сопровождаются перегруппировками. 2. Реакции алкилирования сопровождаются образованием полиалкиларенов. 3. В реакцию Фриделя-Крафтса (алкилирования и ацилирования) не вступают соединения, содержащие электроноакцепторные группы. 4. В реакцию Фриделя-Крафтса не вступают арил- и винилгалогениды.
Алкилбензолы Алкилбензолы вступают в реакцию радикального хлорирования и бромирования боковой цепи. Эта реакция протекает по цепному механизму, как и радикальное галогенирование алканов, и включает стадии инициирования, роста и обрыва цепи. Для инициирования образования радикальных частиц используется освещение ультрафиолетовым светом (фотолиз) или высокие температуры – 450-500оС (термолиз). При фотохимическом или термическом хлорировании толуола возможно замещение всех трех атомов водорода, при этом каждый последующий атом замещается труднее предыдущего. Поэтому реакцию можно останавливать на любой стадии.
бензилхлорид дихлорметилбензол трихлорметилбензол
Использование в качестве бромирующего средства бромсукцинимида позволяет осуществлять бензильное бромирование алкиларенов в боковую цепь:
толуол N-бромосукцинимид бензилбромид сукцинимид
этилбензол 1-бром-1-фенилэтанэтан
Алкильные группы, присоединенные к бензольному кольцу, легко окисляются такими окислителями, как дихромат натрия в серной кислоте, оксид хрома (VI) в уксусной кислоте, перманганат калия или азотная кислота. Наиболее часто для окисления боковых цепей используют соединения хрома (VI) и перманганат калия. Конечными продуктами являются ароматические карбоновые кислоты.
толуол бензойная кислота
изопропилбензол бензойная кислота (кумол)
1,4-диметилбензол 1,4-бензолдикарбоновая кислота (п -ксилол) (терефталевая кислота)
А. Нитрование Толуол нитруется гораздо легче, чем бензол, при этом последовательно образуются моно-, ди- и тринитротолуолы:
о -нитротолуол п -нитротолуол
При присоединении нитроил катиона в о - или в п -положение к метильной группе возникает устойчивый s-комплекс, в то время как в м -положение – не очень устойчивый:
устойчивый
неустойчивый
Нитроарены широко используются в качестве промежуточных продуктов в синтезе других классов соединений. Используя реакции нитрования и окисления в различной последовательности можно получить о-, м- и п- нитробензойные кислоты. Нитрованием толуола с последующим окислением метильной группы можно получать о- и п- нитробензойные кислоты.
Карбоксильная группа, как и нитрогруппа, является ориентантом второго рода, т.е. затрудняет реакцию электрофильного замещения и ориентирует заместитель в м -положение.
м -нитробензойная кислота
Нитрованием толуола получают тринитротолуол (ТНТ):
2,4,6-тринитротолуол
Используя тот факт, что при нагревании тринитробензойной кислоты она легко декарбоксилируется, можно предложить следующую схему получения тринитробензола из толуола:
2,4,6-тринитротолуол 2,4,6-тринитробензойная к-та 1,3,5-тринитробензол
Упр. 1. Напишите реакции получения из толуола (а) о -нитробензойной кислоты, (б) м -нитробензойной кислоты, (в) п -нитробензойной кислоты, (г) тринитробензойной кислоты и (д) тринитробензола. (е) Опишите механизм нитрования бензойной кислоты.
Б. Сульфирование
Сульфирование толуола приводит к образованию о- и п- толуолсульфокислот.
Сульфокислоты являются сильными кислотами, они растворимы в органических растворителях. п -Толуолсульфокислота часто используется в качестве катализатора вместо серной кислоты. Действием на п -толуолсульфокислоту пентахлорида фосфора получают тозилхлорид (Ts-Cl):
п -толуолсульфокислота п -тозилхлорид Ts-Cl
В. Галогенирование
Разная последовательность проведения реакций галогенирования толуола на свету или в присутствие катализатора приводит к образованию различных продуктов.
Упр. 2. Напишите реакции получения из толуола (а) 1-бром-2-(трихлорметил)бензола, (б) 1-бром-3-(трихлорметил)бензола, и (в) 1-бром-4-(трихлорметил)бензола. Ответ
1-бром-3-(трихлорметил)бензол Восстановление по Берчу Бензол может быть восстановлен действием щелочного металла и спирта в жидком аммиаке в 1, 4-циклогексадиен:
Механизм этой реакции, носящей имя австралийского химика Берча (Birch) напоминает механизм восстановления алкинов в алкены:
анионрадикал бензола
циклогексадиенил радикал
циклогексадиенил анион
Другими примерами восстановления ароматических соединений по Берчу являются:
метоксибензол (анизол) 1-метокси-1,4-циклогексадиен
о -ксилол 1,2-диметил-1,4-циклогексадиен
бензоат натрия 1,4-циклогексадиен-3-карбоновая кислота
Окисление аренов
Бензольное кольцо устойчиво к действию большинства окислителей, но оно подвергается озонированию. Восстановительный озонолиз приводит к образованию глиоксаля:
этандиаль (глиоксаль)
Окисление бензола кислородом воздуха дает малеиновый ангидрид:
малеиновый ангидрид малеиновая кислота
Окисление нафталина в тех же условиях приводит к образованию фталевого ангидрида.
Стирол
Стирол получают дегидрированием этилбензола.
Фуллерены и нанотрубки
В продуктах возгонки графита была найдена частица С60. Устойчивость этого кластера объясняется его сферической структурой. Оказалось, что кластер С60 – лишь один из представителей группы соединений, получивших название «фуллерены». Соединение С60 было названо букминстерфуллереном в честь известного архитектора Букминстера Фуллера. Его структура представляет собой шаровидную сеть, образованную набором 12 пятиугольников и 20 шестиугольников. В структуре фуллерена С70 имеется 25 шестиугольников.
фуллерен С60 фуллерен С70
Еще одной модификацией углерода являются нанотрубки со структурой, образованной свернутым углеродным «листом».
Вследствие упорядоченности атомов углерода в структуре нанотрубки этот материал, оказывается, по крайней мере, в 100 раз прочнее стали. Кроме возможности применения в новых конструкционных материалах нанотрубки могут выступать в качестве электрических проводников и полупроводников. Существенным недостатком нанотрубок является их полная нерастворимость, как в органических растворителях, так и в воде. Найдено, что обработка синтетическими полимерами сообщает нанотрубкам растворимость в органических растворителях и заметно меняет их химические свойства.
АРЕНЫ (пособие для самостоятельной работы студентов)
А.И. Кузнецов 23 27.11.10
Оглавление А. Аннулены. Правило Хюккеля 2 Б. Стабильность бензола 2 В. Ароматичность 3 Г. Строение бензола 3 Д. Конденсированные ароматические углеводороды 5 Е. Ароматические ионы 5 Ж.Ароматические гетероциклические соединения 7 6.1. Электрофильное ароматическое замещение 6 А. Механизм электрофильного ароматического замещения 12 Б. Влияние заместителей на электрофильное замещение (правила ориентации) 13 6.1.1. Нитрование 9 6.1.2. Сульфирование 11 6.1.3. Галогенирование 12 6.1.4. Алкилирование 14 А. Хлорметилировани 16 6.1.5. Ацилирование 16 6.2. Алкилбензолы 17 А. Кумольный метод получения фенола и ацетона 19 6.2.1. Реакции электрофильного замещения алкилбензолов 19 А. Нитрование 19 Б. Сульфирование 21 В. Галогенирование 21 6.3. Реакции электрофильного замещения нафталина 22 6.4. Восстановление Аренов по Берчу 24 6.5.Окисление аренов 24 6.6. Стирол 25 А. Анионная полимеризация стирола 26 Фуллерены и нанотрубки 28
АРЕНЫ
История ароматических соединений началась в 1825 году, когда английский ученый Фарадей выделил бензол из осветительного газа. В 1834 году немецкий химик Митчерлих получил бензол нагреванием бензойной кислоты с оксидом кальция и установил, что он имеет формулу С6Н6.
В 1865 г Кекуле предложил формулу бензола. В конце 19 века в органической химии распространилась теория строения органических соединений (Бутлеров - Кекуле и Купер). В результате все соединения были разделены на алифатические и ароматические углеводороды.
А. Аннулены. Правило Хюккеля В случае циклических соединений сопряжение может быть циклическим кольцевым. Группа соединений с одинаковой эмпирической формулой (СН)n и циклической структурой называют аннуленами. Их номенклатура ясна из приводимых примеров. Некоторые из аннуленов обладают повышенной термодинамической стабильностью
[4]-аннулен [8]-аннулен [14]-аннулен
Хюккель вывел правило, по которому: ароматичностью обладают карбоциклы имеющие плоское строение и содержащие в замкнутой системе сопряжения (4n + 2) p-электронов. Из правила Хюккеля следует, что [2], [6] и [10]-аннулены должны быть ароматическими. Понятие ароматичности возникло раньше правила Хюккеля. Правило Хюккеля является лишь квантовомеханическим критерием ароматичности.
Б. Стабильность бензола Гидрирование бензола в присутствии платинового или никелевого катализатора приводит к образованию циклогексана:
бензол циклогексан
При этом продуктов неполного гидрирования (циклогексена и 1,3-циклогексадиена) не образуется. При гидрировании циклогексена выделяется 28,6 ккал/моль.
цикоогексен циклогексан
При гидрировании 3 молей циклогексена, таким образом, выделяется 28,6 х 3 = 85,8 ккал/моль. Если из этой суммы вычесть энергию, выделяющуюся при гидрировании одного моля бензола, содержащего то же количество кратных связей, что и три моля циклогексена (85,8 - 49,8 = 36 ккал. моль), получим энергию стабилизации или энергию резонанса в бензоле. Энергия стабилизации представляет собой разницу между вычисленной энергией, которая могла бы выделиться при гидрировании гипотетического 1,3,5-циклогексатриена в случае отсутствия в нем делокализации электронов и экспериментально найденной энергией, выделяющейся при гидрировании реального бензола.
В. Ароматичность Термин «ароматический» возник потому, что многие соединения - бензальдегид, бензиловый спирт, эфиры бензойной кислоты, содержащие бензольные кольца, были выделены из различного рода ладанов, ароматических масел и бальзамов. Ароматические соединения отличаются по свойствам от других ненасыщенных соединений:
Критериями ароматичности являются: - высокая термодинамическая стабильность; - ненасыщенный характер их молекул почти не проявляется; - они трудно вступают в реакцию присоединения; - соединение считается тем ароматиченее, чем менее реакционноспособны его двойные связи, и чем выше его термодинамическая стабильность; - ароматические соединения отличаются от алифатических соединений по их поведению по отношению к электрофильным реагентам: электрофильные реагенты при взаимодействии с ароматическими соединениями не присоединяются по их кратным связям, а замещают атомы водорода, связанные с ароматическими циклами; - легкость образования аренов в различных реакциях; - устойчивость к действию окислителей. Г. Строение бензола
Данные современных физико-химических методов указывают на то, что все С-С и С-Н связи в бензоле эквивалентны. Согласно этим данным, бензол представляет собой правильный гексагон с длиной С-С связи 1,397 Å и валентным углом 120о. Образование s-связей С-С можно представить как результат продольного перекрывания sp 2-гибридных орбиталей углерода, при этом шесть негибридных p -орбиталей шести атомов углерода образуют замкнутую p-электронную систему за счет бокового перекрывания. Образующийся при этом секстет p-электронов обусловливает особые свойства и стабильность бензола.
Согласно теории МО, шесть атомных p -орбиталей атомов углерода комбинируются с образованием шести молекулярных p-орбиталей, из которых три являются связывающими, а три – разрыхляющими. Чтобы показать равномерность распределения электронной плотности в молекуле бензола, структурную формулу его часто изображают в виде шестиугольника с окружностью внутри:
Для оценки устойчивости плоских полностью сопряженных циклических p-систем по относительной энергии молекулярных орбиталей удобно пользоваться графическим методом по Фросту, Кулсону (Coulson). Систему представляют правильным многоугольником и вписывают в окружность таким образом, чтобы одна из вершин располагалась в точке пересечения вертикально проведенного диаметра с нижней частью круга. Точки, в которых вершины многоугольника касаются круга, считают уровнями энергии молекулярных орбиталей, а вертикальный диаметр - координатой энергии, на которой горизонтальный диаметр обозначает несвязывающий уровень. Рассмотрим с помощью круга Фроста уровни энергии бензола. В бензоле имеются три связывающие и три разрыхляющие p орбитали. Все три связывающие p орбитали бензола полностью заняты, и на каждой из них размещаются по два электрона с антипараллельными спинами. Все разрыхляющие p орбитали бензола в основном состоянии не заняты электронами.
Гексагон энергетические в цикле уровни МО
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-26; просмотров: 901; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.140.108 (0.296 с.) |
 (1)
(1)
 (2)
(2) (3)
(3)








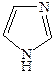


 (4)
(4)



 (5)
(5)

 (6)
(6) (6а)
(6а) (7)
(7) (8)
(8) (9)
(9)


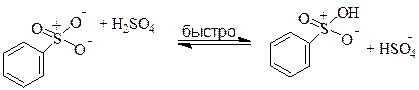
 (10)
(10) (11)
(11) (12)
(12)



 (13)
(13) (14)
(14) (15)
(15) (16)
(16)



 (17)
(17)
 (18)
(18)

 (19)
(19) (20)
(20) (21)
(21) (22)
(22)
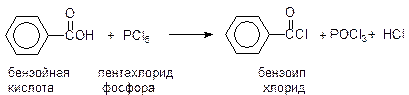

 (23)
(23)

 (24)
(24) (25)
(25)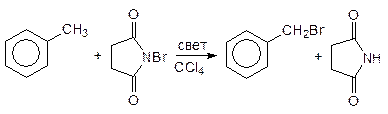 (26)
(26) (27)
(27) (28)
(28) (29)
(29)
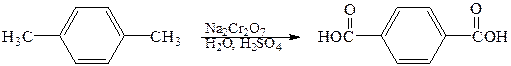 (30)
(30) (33)
(33)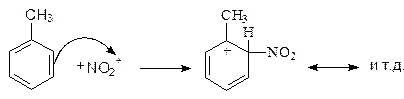

 (34)
(34) (35)
(35) (36)
(36) (37)
(37) (38)
(38) (39)
(39) (40)
(40) (41)
(41)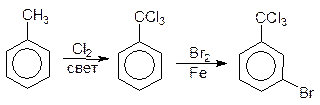 (42)
(42) (49)
(49)



 (50)
(50) (51)
(51) (52)
(52) (53)
(53) (54)
(54)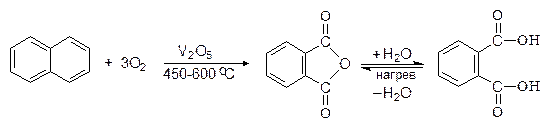 (55)
(55)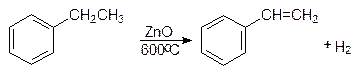 (56)
(56)






