
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение концентрации раствора тиосульфата натрия
1. Готовят три пробы: – в конические колбы отмеряют пипеткой по 10см3 0,05 Н раствора бихромата калия; – в эти же колбы мерным цилиндром добавляют по 2см3 10% раствора йодида калия; – растворы подкисляют 10см3 5% раствора соляной кислоты; – растворы взбалтывают, колбы закрывают и выдерживают в тёмном месте не менее 5мин для завершения реакции взаимодействия бихромата калия с йодидом калия; – к растворам добавляют по ~100см3 дистиллированной воды. 2. Чистую сухую бюретку заполняют приготовленным раствором тиосульфата натрия. 3. Титруют приготовленные пробы до лимонно-желтого окрашивания, затем добавляют к раствору 1–2см3 раствора крахмала и дотитровывают до исчезновения синего окрашивания. 4. В случае получения явно выпадающих результатов, проводят отбор и титрование дополнительных проб до получения трёх совпадающих результатов. 5. Результаты титрования (V(Na2S2O3)) записывают в таблицу 2.5. 6. Для каждого опыта рассчитывают нормальность раствора тиосульфата натрия, результаты (CN(Na2S2O3)) записывают в таблицу 2.5. 8. Находят среднее из полученных значений ( 9. Концентрацию тиосульфата натрия записывают на соответствующей колбе. Таблица 2.5 (образец) CN(K2Cr2O7) = __________V(K2Cr2O7) = __________
Определение содержания меди (II) в растворе 1. В три конические колбы при помощи пипетки отбирают по 2см3 раствора, содержащего неизвестное количество соли Cu(II). Растворы подкисляют 10см3 5% раствора соляной кислоты. В каждую колбу при помощи мерного цилиндра добавляют по 10см3 10% раствора йодида калия. В результате протекания реакции происходит восстановление ионов меди до одновалентного состояния и выпадает белый осадок CuI. 2. Колбы закрывают и выдерживают в тёмном месте не менее 5мин. 3. Приготовленные пробы титруют до лимонно-желтого окрашивания, затем добавляют к раствору 1–2см3 раствора крахмала и дотитровывают до исчезновения синего окрашивания. 5. Результаты титрования (V(Na2S2O3)) записывают в таблицу 2.6. 6. Находят среднее из полученных значений ( Таблица 2.6 (образец) CN(Na2S2O3) = __________V(пробы) = __________
При составлении отчёта необходимо написать уравнения реакций, происходящих в процессе титрования, и указать эквиваленты бихромата калия, тиосульфата натрия и соли Cu(II) в данной реакции.
Вариант 4. Комплексонометрическое титрование Перед тем как приступать к эксперименту необходимо составить электронные уравнения, происходящих процессов, определить эквиваленты участников процесса и определить стехиометрические коэффициенты в уравнениях реакций.
|
|||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 535; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.97.157 (0.004 с.) |
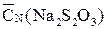 ).
).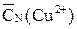 ).
).


