
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Оборудование аналитической лаборатории.Стр 1 из 4Следующая ⇒
Оборудование аналитической лаборатории. Приготовление растворов. Цель работы: Ознакомление с основным оборудованием аналитической лаборатории общего назначения. Приготовление установочных растворов заданной концентрации и рабочих растворов для проведения титриметрического анализа.
Общие сведения
Весы
Аналитические весы – прибор, предназначенный для определения массы образцов с точностью до четвертого знака после запятой. Аналитические весы являются обязательным компонентом любой аналитической лаборатории. Наиболее простыми в устройстве и надёжными в работе являются рейтерные аналитические весы (рис.1.3.). Важнейшей частью аналитических весов является коромысло, снабженное тремя агатовыми призмами. Средняя призма своим ребром опирается на колонку весов. На двух крайних призмах расположены серьги, соединенные с чашами весов. К середине коромысла прикреплена стрелка, нижний конец которой движется вдоль шкалы с делениями, находящейся внизу колонки. Аналитические весы, также как технохимические, снабжены арретиром. Арретир поднимает, или опускает коромысло при помощи дисковой рукоятки. Дисковая рукоятка, арретира прикреплена к нижней части поверхности плиты, на которой монтируется колонка и шкаф весов. При помощи набора разновесов (рис.1.2.), содержащего граммо́вые и миллиграммо́вые гирьки, можно определять массу взвешиваемого предмета с точностью до 0,01г. Тысячные и десятитысячные доли определяют при помощи рейтера. Рейтер это тонкая изогнутая проволочка массой 0,01г. Перед началом взвешивания рейтер должен находиться на крючке, прикрепленном к горизонтальному стержню. При помощи этого стержня рейтер можно помещать в любую точку коромысла. На коромысле нанесена шкала с делениями (рейтерная планка), по которой определяют третий и четвёртый знаки после запятой.
После этого пересчитывают количество разновесов, определяют положение рейтера на рейтерной планке и записывают массу взвешиваемого предмета.
1. Перед взвешиванием следует убедиться в исправности и уравновешенности весов, а также в отсутствии на чашках посторонних предметов и загрязнений. 2. Взвешиваемый предмет всегда помещают на левую чашку весов, разновесы – на правую. 3. Все действия с чашками весов и с рейтером производятся при выключенных весах. 4. Взвешивание производится при закрытых дверцах весов. 5. Разновесы берутся только пинцетом. 6. В нерабочем состоянии весы должны находиться в ненагруженном (арретированном состоянии). 7. После окончания работы следует убрать с чашек весов разновесы и взвешиваемый предмет, снять рейтер с рейтерной планки и закрыть дверцы весов. В аналитической практике для взятия навесок обычно используется метод отсыпания. Он заключается в том, что в предварительно взвешенной посуде для взятия навесок отвешивается необходимое количество вещества, затем навеска пересыпается или переливается в другую посуду, а посуда для взвешивания с остатками вещества повторно взвешивается. Величина точной навески определяется как разность массы посуды с веществом и посуды после взвешивания.
Наряду с рейтерными весами в аналитической практике применяются также демпферные аналитические весы (рис.1.4.). Основными отличиями этого типа весов от рейтерных аналитических весов являются:
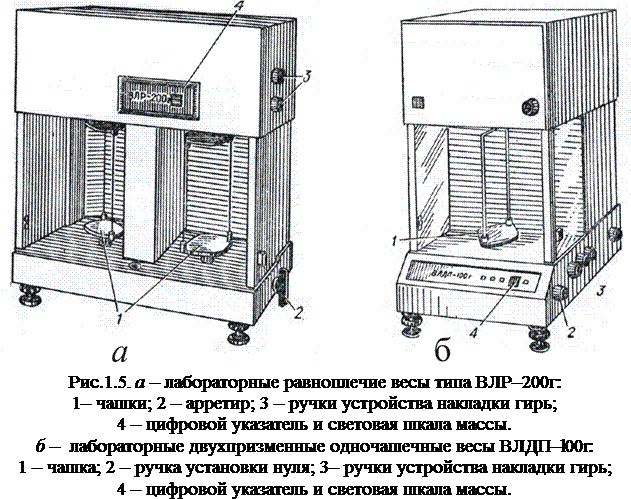
– наличие демпферов (рис.1.4.(3).), сглаживающих колебание коромысла и повышающих скорость достижения равновесия; – наличие устройства накладки гирь, при помощи которого можно устанавливать разновесы, соответствующие десятым и сотым грамма; – наличие световой шкалы массы, на которой высвечиваются значения тысячных и десятитысячных грамма. При взвешивании на демпферных аналитических весах используются только граммовые разновесы. Использование демпферных весов позволяет значительно сократить время взвешивания, однако усложнение конструкции приводит к снижению её надёжности. Так, например, после перемещения демпферных весов с места на место, требуется проведение их дополнительной настройки и поверки. На рис.1.5. представлены более современные модификации двухчашечных и одночашечных аналитических весов, принцип их работы и правила взвешивания существенно не отличаются от описанных выше моделей.
Мерная посуда
Применяемая при проведении анализов мерная посуда должна быть обязательно гостирована. При работе с мерной посудой должны соблюдаться следующие правила: 1. Мерная посуда не должна подвергаться нагреванию. 2. При проведении анализов должна использоваться только тщательно вымытая мерная посуда. 3. Загрязнённая мерная посуда моется с использованием соды или хромовой смеси (раствор бихромата калия в смеси H2SO4 с водой 1:1) затем тщательно промывается водопроводной водой, ополаскивается не менее трёх раз дистиллированной водой и сушится на воздухе. При сушке допускается использование легколетучих растворителей, например, ацетона, и продувание холодным воздухом. 4. При работе с мокрой мерной посудой она предварительно ополаскивается 1–2 раза рабочим раствором. 5. Отсчёт делений на мерной посуде производится по нижней границе мениска. В случае непрозрачных растворов допускается отсчёт по верхней границе мениска. 6. При произведении отсчёта глаз наблюдателя должен находиться в горизонтальной плоскости (рис.1.10 (а).). 7. При работе с бюреткой, её носик должен быть заполнен рабочим раствором (рис.1.10 (б).). 8. При работе с пипеткой, её заполнение производится при помощи резиновой груши. Категорически не допускается затягивать рабочий раствор в пипетку ртом! 9. На рис.1.10 (в) показано правильное положение руки при работе с пипеткой. 10. Раствор из пипетки должен выливаться свободно. Не допускается принудительное выдувание раствора из пипетки. При окончании выливания раствора следует прикоснуться носиком пипетки к внутренней стенке колбы (рис.1.10 (в).). 11. При приготовлении раствора в мерной колбе, перемешивание раствора осуществляется до полного растворения растворяемого вещества и только затем объем раствора доводится до метки. 12. Если процесс растворения сопровождается заметным тепловым эффектом, то доведение раствора до метки производится только после того, как он приобретёт комнатную температуру.
Приготовление растворов Большинство методов проведения анализа связано с использованием растворов с точно известной концентрацией – титрованных растворов. Существует три метода приготовления таких растворов:
– взятие точной навески вещества. Точную навеску вещества растворяют в мерной колбе, затем доводят объем раствора водой до метки. Зная массу растворенного вещества и объем полученного раствора, рассчитывают его молярную или молярную концентрацию эквивалента. Титрованные растворы, полученные таким образом, (стандартные или точные растворы) применяют в титриметрии для количественного определения тех или иных веществ и для установки концентрации других титровальных растворов. Следует учитывать, что описанный способ приготовления титрованных растворов применим далеко не всегда. Его нельзя применять для приготовления титрованных растворов веществ, находящихся в исходном состоянии в виде растворов, точная концентрация которых неизвестна, например, HCl, H2SO4, HNO3 и др., в случае веществ, образующих кристаллогидраты, а также гигроскопичных веществ и неустойчивых веществ, например, NaOH. В этих случаях используют второй способ приготовления растворов.
– использование фиксанала (рис.1.11.). Фиксаналом называется специально запаянная ампула, содержащая определенное количество вещества. Для приготовления раствора определённой концентрации ампулу разбивают над специальной воронкой, снабженной пробивным устройством, содержимое ее количественно переводят в мерную колбу и доливают водой до метки. Обычно фиксаналы рассчитаны на приготовление 1дм3 раствора. Концентрация получаемого раствора указывается на фиксанале. Методика проведения работы Вариант 1. Приготовление растворов для кислотно-основного титрования Вариант 2. Приготовление растворов для перманганатометрического титрования Вариант 3. Приготовление растворов для йодометрического титрования Вариант 4. Приготовление растворов для комплексонометрического титрования
Вопросы к лабораторной работе №1 1. Основные элементы устройства аналитических весов. Принцип их работы. 2. В чём заключаются отличия в устройстве рейтерных и демпферных аналитических весов? 3. Правила взвешивания на аналитических весах. 4. Основные виды лабораторной мерной посуды. Правила работы с мерной посудой. 5. Способы приготовления растворов известной концентрации. 6. Взятие навески методом отсыпания. 7. Способы выражения концентрации растворов. 8. Эквивалент вещества. Расчёт эквивалента и числа эквивалентов вещества. 9. Расчёт навесок веществ, необходимых для приготовления растворов заданной концентрации. Лабораторная работа № 2 Титриметрический анализ. Цель работы: Ознакомление с основными видами титриметрического анализа. Определение концентраций веществ в растворах титриметрическим методом.
Общие сведения Титримеррический метод анализа основан на реакциях взаимодействия определяемых веществ с веществами-титрантами. Титрантом называется вещество, раствор которого используется для количественного определения концентрации титруемого раствора титриметрическим методом. Концентрация раствора титранта должна быть точно определена и оставаться неизменной в течение достаточно длительного времени. Периодически должна проводиться поверка концентрации раствора титранта по установочным растворам. К реакциям, используемым в титриметрическом анализе, предъявляются следующие требования: – реакция должна проходить как можно полнее, т.е. равновесие реакции должно быть максимально смещено в сторону образования продуктов реакции. Таким требованиям отвечают реакции для которых Kравн.≥ 105; – протекание реакции должно сопровождаться изменением физических свойств раствора, которые могут быть зафиксированы визуальным или физико-химическим способом; – скорость реакции должна быть достаточно высока; – не должны происходить побочные реакции, искажающие результаты титрования.
Прибавление раствора титранта к раствору титруемого вещества завершается достижением точки эквалентности. Точкой эквивалентности называется момент, когда число молей (точнее число эквивалентов) добавленного титранта становится равно числу молей титруемого вещества, содержащегося в растворе. В момент достижения точки эквивалентности в растворе исчезают последние молекулы титруемого вещества, при этом раствор утрачивает свойства присущие этому веществу. Изменение свойств раствора в точке эквивалентности происходит скачкообразно. Изменение свойств раствора в процессе титрования описывается кривой титрования. Кривая титрования представляет собой зависимость некоторого свойства раствора от объёма добавленного раствора титранта. На рисунке 2.1. приведен пример кривой потенциометрического титрования. Установление точки эквивалентности производится либо визуальным способом (по изменению окраски раствора), либо путём определения момента изменения физико-химического свойства раствора при помощи соответствующих приборов.
Визуальное определение точки эквивалентности требует, как правило, применения индикаторов. Индикатором называется вещество, изменяющее окраску в точке эквивалентности. Изменение окраски происходит в результате реакции перехода индикатора из одной формы в другую. В качестве индикаторов используются вещества различные формы которых имеют различную достаточно интенсивную окраску, что позволяет использовать при титровании небольшое количество индикатора не искажающее результатов титрования. В момент достижения точки эквивалентности происходит резкое изменение окраски раствора. Физико-химическое определение точки эквивалентности производится путем измерения в процессе титрования электропроводности раствора (кондуктометрическое титрование), ЭДС гальванической цепи, содержащей индикаторный электрод (потенциометрическое титрование), оптической плотности раствора (спектрофотометрическое титрование). В момент достижения точки эквивалентности происходит резкое изменение указанных свойств раствора.
В зависимости от типа применяемой реакции методы титриметрического анализа делят на:
– окислительно-восстановительное титрование (редоксметрия); – комплексонометрическое титрование.
В основе кислотно-основного титрования лежит реакция нейтрализации, происходящая при взаимодействии растворов кислот с растворами щелочей. Таким образом этот метод применяется для определения концентраций веществ, обладающих кислотными или основными свойствами. Титрование проводят раствором соляной кислоты, либо едкого натра. В качестве установочных растворов применяют растворы карбоната натрия Na2CO3, бифталата калия C6H4COOKCOOH, щавелевой кислоты (COOH)2, бензойной кислоты C6H4COOH, приготовленные по точным навескам. В качестве индикатора используются вещества, окраска которых изменяется в зависимости от pH раствора. Каждый кислотно-основный индикатор характеризуется своим pH перехода. Для титрования различных веществ подбираются различные индикаторы. Комбинация различных индикаторов позволяет определять концентрации нескольких веществ при их совместном содержании в растворе. Обычно используется фенолфталеин (при титровании кислоты щелочью) и метиловый оранжевый (при титровании щелочи кислотой). При потенциометрическом определении точки эквивалентности используется гальваническая цепь с переносом состоящая из стеклянного электрода (индикаторный) и хлорсеребряного (вспомогательный). Более подробное описание гальванических цепей и электродов см. в л.р. №3. Редоксметрия основана на окислительно-восстановительных реакциях, происходящих между титруемым веществом и титрантом. Этот метод используется для определения концентраций веществ проявляющих либо окислительные, либо восстановительные свойства. Наиболее распространёнными титрантами для редоксметрии являются перманганат калия (пермангонатометрия) и йод (йодометрия). Перманганатометрия является одной из разновидностей редоксметрического (окислительно-восстановительного) титрования, позволяющей определять содержание в растворе веществ, обладающих восстановительными свойствами. Основным рабочим раствором при проведении перманганатометричиских определений является раствор перманганата калия. Титрование обычно проводят в кислой среде. Раствор перманганата калия является достаточно неустойчивым, при хранении его концентрация может изменяться. В качестве установочного раствора для определения точной концентрации раствора перманганата калия используется раствор оксалата натрия Na2C2O4. В процессе титрования раствора оксалата натрия раствором перманганата калия в кислой среде происходит реакция, протекающая по схеме: Na2C2O4 + KMnO4 + H2SO4 → MnSO4 + CO2↑ + Na2SO4 + K2SO4 + H2O Растворы перманганата калия имеют довольно интенсивную окраску, поэтому метод не требует применения специальных индикаторов. Йодометрия наряду с перманганатометрией является одним из наиболее распространённых методов редоксметрического титрования. Йодометрическое титрование позволяет определять содержание в растворах как веществ, обладающих восстановительными свойствами, так и веществ являющихся окислителями. Основным рабочим раствором в йодометрии является раствор йода в растворе KI. Растворение йода происходит за счёт реакции комплексообразования: I20 + I– → [I3] – Такой раствор содержит как йод в виде простого вещества I20 (окисленная форма), так и йод в восстановленной форме I–. При взаимодействии с окислителями или восстановителями происходит переход йода из одной формы в другую: I20 + 2e ↔ 2I– При взаимодействии раствора с восстановителями количество I20 уменьшается, а с окислителями – увеличивается. Количество йода, находящегося в растворе определяется путём титрования этого раствора раствором тиосульфата натрия. При этом происходит реакция, проходящая по схеме: Na2S2O3 + I2 → Na2S4O6 + Na I Определение восстановителей производится методами прямого и обратного титрования. Прямое титрование заключается в непосредственном оттитровывании раствора восстановителя раствором йода с известной концентрацией. Обратное титрование осуществляется путём прибавления к раствору восстановителя избытка раствора йода с известной концентрацией. При этом часть йода вступает в реакцию с восстановителем, а часть остаётся в растворе. Оставшийся йод оттитровывают раствором тиосульфата натрия. Определение окислителей производится методом косвенного титрования. Метод заключается в обработке раствора окислителя раствором йодида калия. Количество выделившегося при этом йода эквивалентно содержанию окислителя в растворе, оно определяется путем титрования раствором тиосульфата натрия. В качестве установочного раствора для определения точной концентрации раствора тиосульфата натрия используется раствор бихромата калия K2Cr2O7. При взаимодействии йодида калия с бихроматом калия происходит реакция, проходящая по схеме: K I + K2Cr2O7 + HCl → CrCl3 + I2 + KCl + H2O В качестве индикатора при йодометрическом титровании применяют раствор крахмала, который даже с небольшим количеством йода даёт интенсивное синее окрашивание.
В основе комплексонометрического титрования лежат реакции взаимодействия ионов металлов с комплексонами. Комплексонами называются органические вещества, образующие прочные устойчивые соединения (комплексы) с ионами металлов. Наиболее распространённым веществом, применяемым в комплексонометрии в качестве титранта является динатриевая соль этилендиаминтетрауксусной кислоты, известная под названием комплексон III или трилон Б:
При взаимодействии с ионами металлов происходит замещение двух ионов водорода в молекуле трилона Б и образование двух координационных связей с атомами азота. В результате образуется устойчивое комплексное соединение стехиометрического состава 1:1:
При комплексонометрическом титровании используются металл-индикаторы, которые также представляют собой органические вещества, способные образовывать с ионами металлов окрашенные комплексные соединения. Устойчивость комплексов металлов с металл-индикаторами, однако, гораздо ниже устойчивости комплексов металлов с титрантом. В качестве металл-индикаторов используются эриохром черный Т, мурексид и др. Комплексонометрическое титрование заключается в том, что трилон Б связывает ионы металла, вытесняя их из комплексов с металл-индикатором. Когда к титруемому раствору прибавлено эквивалентное количество титранта в растворе не остаётся комплексов метлла с индикатором и наблюдается изменение его окраски. В качестве установочного раствора применяется раствор сульфата магния.
Обработка результатов титрования производится по общей формуле:
где: V(титр.) – объём титранта, пошедший на титрование, CN(титр.) – нормальная концентрация раствора титранта, V(X) – объём пробы, взятой для титрования, C(X) – нормальная концентрация титруемого раствора. Методика проведения работы Вариант 1. Кислотно-основное титрование Перед тем как приступать к эксперименту необходимо составить электронные уравнения, происходящих процессов, определить эквиваленты участников процесса и определить стехиометрические коэффициенты в уравнениях реакций. Вариант 2. Перманганатометрическое титрование Перед тем как приступать к эксперименту необходимо составить электронные уравнения, происходящих процессов, определить эквиваленты участников процесса и определить стехиометрические коэффициенты в уравнении реакции. Вариант 3. Йодометрическое титрование Перед тем как приступать к эксперименту необходимо составить электронные уравнения, происходящих процессов, определить эквиваленты участников процесса и определить стехиометрические коэффициенты в уравнениях реакций. Вариант 4. Комплексонометрическое титрование Перед тем как приступать к эксперименту необходимо составить электронные уравнения, происходящих процессов, определить эквиваленты участников процесса и определить стехиометрические коэффициенты в уравнениях реакций.
Вопросы к лабораторной работе №2 1. Основной принцип титриметрического анализа. 2. Требования, предъявляемые к реакциям, используемым в титриметриии. 3. Кривая титрования. 4. Точка эквивалентности, способы её определения. Индикаторы. 5. Кислотно-основное титрование. 6. Редоксметрия. Разновидности окислительно-восстановительного титрования. 7. Комплексонометрия. 8. Приготовление растворов для титриметрии и установление их концентрации. Лабораторная работа № 3 Ионометрия Цель работы: Ознакомление с ионометрическим методом определения концентрации ионов в растворе. Изучение принципов действия электродов различного рода. Проведение калибровки электродной системы. Определение концентрации ионов в растворе.
Общие сведения
В основу ионометрического метода определения концентрации ионов в растворе положено измерение электродвижущей силы (ЭДС) гальванического элемента, в состав которого входит электрод, обратимый по отношению к определяемому иону. Обратимость электрода по отношению к данному иону означает, что потенциал данного электрода зависит от концентрации этого иона в растворе. Ионы, от активности (концентрации) которых зависит потенциал данного электрода называются потенциалопределяющими ионами.
При погружении электрода в раствор электролита на его поверхности возникает двойной электрический слой. Причиной возникновения двойного электрического слоя являются процессы диффузии ионов с поверхности электрода в раствор и адсорбции ионов из раствора на поверхности электрода, т.е. происходит обмен ионами. Эти процессы сопровождаются изменением степени окисления одного, или нескольких участников процесса. Таким образом, на поверхности электрода протекает окислительно-восстановительная реакция, которая может быть описана общей схемой: [Окисл.] + n·e ↔ [Восстан.] где: [Окисл.] и [Восстан.] – окисленная и восстановленная форма вещества соответственно. Окислительно-восстановительная реакция, протекающая на поверхности электрода называется электродным процессом. Протекание обменных процессов завершается установлением равновесия и возникновением на поверхности электрода областей, имеющих противоположные электрические заряды (рис.3.1). Результатом возникновения двойного электрического слоя является появление разности электрических потенциалов между точками, находящимися в глубине электрода (φ1) и в растворе (φ2). Электрическим потенциалом называется работа по переносу единичного электрического заряда из данной точки пространства на бесконечность. Разность электрических потенциалов между фазой электрода и фазой раствора называется электродным потенциалом (φ = φ1 – φ2). Значение электродного потенциала может быть рассчитано по уравнению Нернста:
где: φ0 – стандартный электродный потенциал; n – число электронов, пронимающих участие в электродном процессе; R – универсальная газовая постоянная (8,31 F – постоянная Фарадея (96500 T – абсолютная температура; a [Окисл.] и a [Восстан.] – активности окисленной и восстановленной форм соответственно. При стандартной температуре (25°C), после преобразования уравнение Нернста принимает вид:
Стандартный электродный потенциал представляет собой электродный потенциал в стандартном растворе, в котором активность всех компонентов раствора равна 1. Величина стандартного электродного потенциала определяется электродным процессом и не зависит от концентрации компонентов раствора. Следует иметь в виду, что значения стандартных электродных потенциалов очень существенно зависят от состава растворителя. Значения стандартных электродных потенциалов различных электродных процессов приводятся в справочной литературе. Расчёт или определение коэффициентов активности нередко сопряжены со значительными трудностями, поэтому на практике часто используется уравнение Нернста в упрощенной форме:
Электроды В зависимости от вида ионов, к которым обратим данный электрод и механизма электродных процессов все электроды делятся на: - электроды, обратимые к катионам (электроды I-го рода); - электроды, обратимые к анионам (электроды II-го рода); - окислительно-восстановительные электроды; - ионоселективные мембранные электроды. Электроды I-го рода выполняются из металла, к ионам которого обратим данный электрод. Электродный процесс описывается общим уравнением: Men++ n·e ↔ Me0 Окисленной формой в данном случае являются ионы металла Men+, а восстановленной – металл в виде простого вещества Me0. Электродный потенциал этого типа электродов определяется уравнением:
Металлические электроды не находят широкого применения в ионометрии главным образом из за побочных реакций, происходящих на поверхности электрода (образование оксидов, гидроксидов, выделение менее активных металлов и др.) которые искажают значение электродного потенциала. Из электродов этого типа практическое применение находят главным образом серебряные и ртутные электроды. Электроды II-го рода представляют собой металлические электроды, погружённые в раствор, содержащий потенциалопределяющие анионы и осадок труднорастворимой соли, образованной потенциалопределяющими анионами и металлом электрода. Рассмотрим принцип работы этого типа электродов на примере самого распространённого электрода II-го рода – хлорсеребряного электрода. Хлорсеребряный электрод выполняется из серебряной проволоки на поверхность которой наносится слой труднорастворимой соли AgCl, которая диссоциирует по уравнению: AgCl ↔ Ag+ + Cl– Активность ионов серебра связана с активностью ионов хлора в растворе соотношением: Пр = a (Ag+) · a (Cl–) где: Пр – произведение растворимости данной соли – величина постоянная при постоянной температуре. Потенциал серебряного электрода является функцией активности ионов серебра:
Подставляя в это выражение активность ионов серебра, выраженную через произведение растворимости AgCl, получим:
Первые два слагаемых правой части уравнения являются константами и могут быть объединены в общую константу φ0(AgCl). В окончательном варианте уравнение имеет вид:
Таким образом потенциал хлорсеребряного электрода является функцией активности ионов хлора, т.е. хлорсеребряный электрод обратим к этим ионам. Наряду с хлорсеребряным электродом практическое применение в ионометрии находят и другие электроды II-го рода. В основном они используются как электроды сравнения и внутренние электроды мембранных электродов. Окислительно-восстановительные электроды выполняются из инертных металлов, обычно из платины. Потенциал окислительно-восстановительного электрода определяется соотношением окисленной и восстановленной форм веществ, участвующих в окислительно-восстановительной реакции, происходящей в растворе. Например, в растворе происходит окислительно-восстановительная реакция:
которая может быть представлена как разность двух полуреакций:
Каждая из полуреакций характеризуется своим электродным потенциалом, выражения для которых в соответствие с уравнением Нернста будут иметь вид:
Следует обратить внимание на то, что активности всех веществ возводятся в степени, соответствующие стехиометрическим коэффициентам этих веществ в уравнении реакции. Активность воды считается величиной постоянной и вносится в значение стандартного электродного потенциала.
Суммарный электродный потенциал будет равен:
Окислительно-восстановительные электроды применяются в аналитической химии для проведения потенциометрического титрования. Ионоселективные мембранные электроды представляют собой системы, состоящие из внутреннего (обычно хлорсеребряного электрода), находящегося в растворе KCl постоянной концентрации и отделённого от исследуемого раствора ионоселективной мембраной. Ионоселективная мембрана обладает способностью селективно поглощать потенциалопределяющие ионы. В результате протекания ионообменного процесса, между мембраной электрода и раствором устанавливается равновесие, которое характеризуется определёнными равновесными активностями потенциалопределяющего иона в мембране и в растворе. Образовавшийся двойной электрический слой (рис.3.1.) является причиной возникновения электродного потенциала величина которого пропорциональна активности потенциалопределяющего иона в растворе. На рис.3.2. показана конструкция ионоселективного мембранного электрода. Потенциал ионоселективного электрода складывается из потенциала внутреннего хлорсеребряного электрода и скачка потенциала между мембраной и исследуемым раствором:
В зависимости от знака заряда потенциалопределяющего иона, перед вторым членом уравнения стоит „+” или „–”. Поскольку величины
Теоретический расчёт величины стандартного электродного потенциала ионоселективного электрода не представляется возможным, поскольку каждая мембрана имеет свой, несколько отличный от других состав, и толщину. Теоретический учёт действия этих факторов невозможен, поэтому стандартные электродные потенциалы каждого ионоселективного электрода определяются по экспериментальным данным. Наличие в растворе посторонних ионов может оказать влияние на величину потенциала ионоселективного электрода. В этом случае уравнение Нернста принимает вид:
где K – коэффициент селективности данного электрода по отношению к данному мешающему иону –
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 1964; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.79.70 (0.167 с.) |

 В нерабочем состоянии весы должны быть арретированы. В таком состоянии на левую чашу весов помещают взвешиваемый предмет, а на правой чашке размещают разновесы. После поднятия коромысла по отклонению стрелки определяют, каким образом следует изменить количество разновесов (уменьшить или увеличить). Стрелка весов всегда отклоняется в сторону меньшего веса. Изменяя количество разновесов и положение рейтера, достигают отклонения стрелки весов влево или вправо на одинаковое число делений.
В нерабочем состоянии весы должны быть арретированы. В таком состоянии на левую чашу весов помещают взвешиваемый предмет, а на правой чашке размещают разновесы. После поднятия коромысла по отклонению стрелки определяют, каким образом следует изменить количество разновесов (уменьшить или увеличить). Стрелка весов всегда отклоняется в сторону меньшего веса. Изменяя количество разновесов и положение рейтера, достигают отклонения стрелки весов влево или вправо на одинаковое число делений.

 В состав аналитической лаборатории входит набор разнообразной мерной посуды, это: мерные колбы, бюретки, пипетки, мерные цилиндры, мензурки и др.
В состав аналитической лаборатории входит набор разнообразной мерной посуды, это: мерные колбы, бюретки, пипетки, мерные цилиндры, мензурки и др.



 – предварительное приготовление раствора приблизительно требуемой концентрации. Сначала готовят раствор вещества приблизительно требуемой концентрации, затем устанавливают его точную концентрацию путём титрования раствором другого вещества с точно известной концентрацией (установочного раствора). Например, концентрацию раствора NaOH можно установить в результате титрования его раствором щавелевой кислоты, приготовленным по точной навеске.
– предварительное приготовление раствора приблизительно требуемой концентрации. Сначала готовят раствор вещества приблизительно требуемой концентрации, затем устанавливают его точную концентрацию путём титрования раствором другого вещества с точно известной концентрацией (установочного раствора). Например, концентрацию раствора NaOH можно установить в результате титрования его раствором щавелевой кислоты, приготовленным по точной навеске.



 Электродный потенциал
Электродный потенциал
 );
); );
);











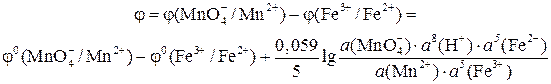

 Зависимость потенциала мембраны от активности потенциалопределяющего иона описывается уравнением Нернста:
Зависимость потенциала мембраны от активности потенциалопределяющего иона описывается уравнением Нернста:
 и
и  не зависят от активности потенциалопределяющего иона, их сумма может быть внесена в величину стандартного электродного потенциала ионоселективного электрода:
не зависят от активности потенциалопределяющего иона, их сумма может быть внесена в величину стандартного электродного потенциала ионоселективного электрода:

 .
.


