
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Каков потенциал водородного электрода, заполненного
Раствором HCl c C 0.1 моль/л? 1. - 0,41 В 2. - 0,041 В 3. - 0,059 В 4. + 0,059 В Относительно какого электрода чаще всего измеряются Стандартные электродные потенциалы? 1. Стандартный каломельный электрод 2. Стандартный водородный электрод 3. Стандартный хлорсеребрянный электрод 4. Стеклянный электрод Укажите формулу для расчета электродного потенциала до точки эквивалентности для окислительно-восстановительной реакции 6Cu+ + Cr2O72- + 14H+ → 6Cu2+ +2Cr3+ + 7H2O 1. φ = φ0 + 0.059/1 lg[Cu2+]/[Cu+] 2. φ = φ0 + 0.059/6 lg[Cr2O72-]/[Cr]2 3. φ = φ0 + 0.059/6 lg[Cr2O72-][H+]14 / [Cr]2 4. φ = φ0 + 0.059/1 lg[Cu+]/[Cu2+] Тема: Кондуктометрия 1. При титровании смеси HCl и CH3COOH построен график. Найдите С(1/z CH3COOH), если С(1/z NaOH) 0,1 моль/л, а объем смеси 10 мл? L
1 2 3 4 5 6 7 8 9 10 11 12 13 14 V NaOH 1. С(1/z) 0,25 моль/л 2. С(1/z) 0,025 моль/л 3. С(1/z) 0,05 моль/л 4. С(1/z) 0,1 моль/л 2. Найдите удельную электропроводимость раствора уксусной кислоты с С (1/z) 0.001 моль/л, если степень ионизации 0,13 и λ ¥ = 390 Ом-1см2моль-1 1. 50,7 2. 5,07 * 10-8 3. 5,07 * 10-3 4. 5,07 * 10-5 3. Математическое выражение закона Кольрауша: 1. l = c*1000/С 2. c = К /R 3. l¥ = ПК+ПА 4. Е = jК-jА 4. При кондуктометрическом анализе определяют: 1. Концентрацию ионов водорода 2. Сопротивление раствора 3. Электродный потенциал 4. Температуру раствора В каких единицах измеряется электрическая проводимость? 1. Ом 2. В-1 3. Ампер 4. Ом – 1 ТИПОВЫЕ ЗАДАЧИ ДЛЯ ПОДГОТОВКИ К ЭКЗАМЕНАМ
Тема: Способы выражения концентрации растворов. 1. Какую массу калий хлорида и воды необходимо взять для приготовления 500 г раствора с массовой долей 15%. Ответ: 75 г HCl, 425 мл Н2О 2. Из раствора серной кислоты массой 400 г с массовой долей 40% выпарили 100 мл воды. Определите массовую долю (в %) кислоты в полученном растворе. Ответ: 53,3% 3. В 1 литре воды растворено 600 г КОН. Плотность полученного раствора равна 1,395 г/мл. Найти: а) массовую долю раствора, б) молярную концентрацию, в) молярную концентрацию эквивалента, г) моляльность. Ответ: 37,5%, С 9,34 моль/л, С (1/z) 9,34 моль/л, моляльность 10,7 моль/1000 г Н2О 4. Смешали растворы натрий хлорида массой 200 г и w % = 25% и 300 г раствора с w 40%. Определить массовую долю NaCl в полученном растворе. Ответ: 34% 5. Как можно приготовить 300 г раствора натрий хлорида с w 14% из растворов NaCl с w 22% (плотность 1,168 г/мл) и с w 10% (плотность 1,073 г/мл).
Ответ: 86,5 мл: 186,4 мл 6. Сколько граммов иода и миллилитров спирта (плотность 0,8 г/мл) необходимо для приготовления 200 г спиртового раствора иода с w 5%. Ответ: 10 г, 237,5 мл 7. Сколько литров H2SO4 с C(1/z) 0,1 моль/л можно приготовить из 20 мл H2SO4 с w 90% (плотность 1,82 г/мл). Ответ: 6 л 686 мл 8. К 25 мл раствора H2SO4 с w 96% (плотность 1,82 г/мл) прибавили 100 мл воды. Найти w %, молярную концентрацию и молярную концентрацию эквивалента полученного раствора, если его плотность равна 1,225 г/мл. Ответ: 30,124%, С 3,765 моль/л, С (1/z) 7,53 моль/л 9. Приготовьте 60 г раствора азотной кислоты с w 7% из раствора HNO3 с массовой долей 10% (плотность 1,056 г/мл) и воды. Сколько мл раствора азотной кислоты с w 10 % надо взять для этого. Ответ: 39, 8 мл 10. Из раствора натрий хлорида массовой долей 40% приготовить 400 г раствора NaCl с массовой долей 10%. Ответ: смешать 100 г раствора NaCl с w 40% и 300 мл Н2О 11. Рассчитайте массу вещества, необходимую для приготовления раствора с а) массовой долей 2% (плотность 1,015г/мл) и объем раствора 0,250л б) массовой долей 5% (плотность 1,007г/мл) и объем раствора 800мл; Ответ: 5,07 г, 40,28 г. 12. В 60г воды растворили 20 мл 40% фосфорной кислоты (плотность 1,254г/мл). Чему равна массовая концентрация раствора Ответ:11,79% 13. Какой объем раствора сульфата меди с массовой долей 8% (плотность 1,01г/мл) можно приготовить из 120 мл раствора с массовой долей сульфата меди 42% (плотность 1,36г/мл) Ответ: 848 мл 14. Определить объем раствора серной кислоты с массовой долей 70% (плотность 1,4г/мл), который нужно добавить к 1,2 л воды для получения раствора с массовой долей 10% Ответ: 142 мл 15. Сколько г воды нужно для приготовления 10% раствора хлорида бария из 35 г двухводного кристаллогидрата хлорида бария? Ответ: 263,4 г 16. В 90 г воды растворили 10 г двухводного хлорида бария. Вычислите массовую долю хлорида бария в растворе. Ответ: 8,52%
|
||||||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 120; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.216.163 (0.009 с.) |
 Ом-1
Ом-1
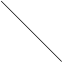

 0
0


