
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 2. 9. Применение ферментов в медицине
1. Широкое применение в медицинской практике ферменты находят в качестве диагностических (энзимодиагностика) и терапевтических (энзимотерапия) средств. Ферменты также используются в качестве специфических реактивов для определения ряда метаболитов. Например, фермент глюкозооксидазу применяют для количественного определения глюкозы в моче и крови; фермент уреазу используют для оценки содержания в биологических жидкостях мочевины; с помощью различных дегидрогеназ выявляют наличие соответствующих субстратов, например пирувата, лактата, этилового спирта и т.д. 2. Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека. • Принципы энзимодиагностики основаны на следующих закономерностях: - в норме в сыворотке крови содержатся ферменты, выполняющие специализированные функции, например, участвующие в свертывающей системе крови. Клеточные ферменты практически не проникают из неповрежденных клеток в кровь. В минимальных количествах некоторые ферменты клеток могут определяться в крови; - при повреждении мембран клеток (воспаление, некроз) в крови или других биологических жидкостях (например, в моче) увеличивается количество внутриклеточных ферментов поврежденных клеток, активность которых можно зарегистрировать специальными биохимическими тестами; - для энзимодиагностики используют ферменты, имеющие преимущественную или абсолютную локализацию в определенных органах (органоспецифичность); - количество высвобождаемого фермента должно быть пропорционально степени повреждения ткани и достаточно для определения его активности; - активность ферментов в биологических жидкостях, обнаруживаемых при повреждении клеток, отличается от нормальных значений и стабильна в течение достаточно длительного времени (сутки); - появление в плазме крови ферментов, имеющих только цитозольную локализацию, свидетельствует о воспалительном процессе; при обнаружении митохондриальных или ядерных ферментов можно говорить о более глубоких повреждениях клетки, например некрозе. • Ферменты, катализирующие одну и ту же химическую реакцию, но с разной первичной структурой белка, называют изоферментами. Они отличаются друг от друга кинетическими параметрами, условиями активации, особенностями связи апофермента и кофермента. Природа появления изоферментов разнообразна, но чаще всего обусловлена различиями в структуре генов, кодирующих эти изоферменты или их субъединицы. На различиях в физико-химических свойствах и основаны методы определения изоферментов. Изоферменты часто являются органоспецифичными, так как в каждой ткани содержится преимущественно один тип изоферментов. Следовательно, при повреждении органа в крови появляется соответствующая форма изофермента. Обнаружение определенных изоферментных форм ферментов позволяет использовать их для диагностики заболеваний.
Например, фермент лактатдегидрогеназа (ЛДГ) катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты) (рис. 2.31). Лактатдегидрогеназа - олигомерный белок с мол. массой 134 000, состоящий из четырех субъединиц двух типов - М (от англ. muscle - мышца) и Н (от англ. heart - сердце). Комбинация этих субъединиц лежит в основе формирования пяти изоформ лактатдегидрогеназы (рис. 2.32, А). ЛДГ1 и ЛДГ2 наиболее активны в сердечной мышце и почках, ЛДГ4 и ЛДГ5 - в скелетных мышцах и печени. В остальных тканях имеются другие варианты этого фермента. Изоформы ЛДГ различаются друг от друга электрофоретической подвижностью, что позволяет устанавливать тканевую принадлежность изоформ ЛДГ (рис. 2.32, Б). Для диагностики заболеваний сердца печени и мышц необходимо исследование изоформ ЛДГ в плазме крови методом электрофореза. На рис. 2.32, В представлены электрофореграммы
А - строение различных изоформ ЛДГ; Б - распределения на электрофореграмме и относительные количества изоформ ЛДГ в различных органах; В - содержание изоформ ЛДГ в плазме крови в норме и при патологии (электрофореграммы - слева и фотометрическое сканирование - справа) плазмы крови здорового человека, больного инфарктом миокарда и больного гепатитом. Выявление в плазме крови тканеспецифических изоформ ЛДГ широко используется в качестве диагностического теста.
Другим примером может служить креатинкиназа. Креатинкиназа (КК) которая катализирует реакцию образования креатинфосфата (рис. 2.33). Молекула КК представляет собой димер, состоящий из субъединиц двух типов М (от англ. muscle - мышца) и В (от англ. brain - мозг). Эти субъединицы образуют три изофермента: ВВ, МВ, ММ. Изофермент ВВ находится преимущественно в головном мозге, ММ - в скелетных мышцах и МВ - в сердечной мышце. Изоформы КК имеют разную электрофоретическую подвижность (рис. 2.34). Определение активности КК в плазме крови имеет значение при диагностике инфаркта миокарда (происходит повышение уровня МВ-изоформы). Количество изоформы ММ может повышаться при травмах и повреждениях скелетных мышц. Изоформа ВВ не может проникнуть через гематоэнцефалический барьер, поэтому в крови практически не определяется даже при инсультах и диагностического значения не имеет.
• Энзимодиагностика используется для установления диагноза при заболеваниях различных органов. Набор анализов зависит от возможностей конкретной биохимической лаборатории и постоянно совершенствуется. Наиболее распространены следующие энзимодиагностические тесты: - при заболеваниях сердца (инфаркт миокарда) - лактадегидрогеназа, креатинкиназа, аспартатаминотрансфераза, аланинаминотрансфераза. Одним из первых белков при инфаркте миокарда в крови появляется белок - тропонин; - при заболеваниях печени - аланинаминотрансфераза, аспартатаминотрансфераза, ацетилхолинэстераза, гамма-глутамилтранспептидаза. При заболеваниях поджелудочной железы - панкреатическая амилаза, липаза; - при заболеваниях простаты - кислая фосфатаза. 3. Применение ферментов в качестве лекарственных препаратов активно развивают в следующих направлениях: • заместительная терапия - использование ферментов в случае их недостаточности; • элементы комплексной терапии - применение ферментов в сочетании с другой терапией. Заместительная энзимотерапия эффективна при желудочно-кишечных заболеваниях, связанных с недостаточностью секреции пищеварительных соков. Например, пепсин используют при гастритах со сниженной секреторной функцией. Дефицит панкреатических ферментов также в значительной степени может быть компенсирован приемом внутрь препаратов, содержащих основные ферменты поджелудочной железы (фестал, энзистал, мезимфорте и др.). В качестве дополнительных терапевтических средств ферменты используются при ряде заболеваний. Протеолитические ферменты (трипсин, химотрипсин) применяют при местном воздействии для обработки гнойных ран с целью расщепления белков погибших клеток, для удаления сгустков крови или вязких секретов при воспалительных заболеваниях дыхательных путей. Ферментные препараты рибонуклеаза и дезоксирибонуклеаза используются в качестве противовирусных препаратов при лечении аденовирусных конъюнктивитов, герпетических кератитах. Ферментные препараты стали широко применяться при тромбозах и тромбоэмболиях для разрушения тромба. С этой целью используют препараты фибринолизина, стрептолиазы, стрептодеказы, урокиназы.
Фермент гиалуронидазу (лидазу), катализирующий расщепление гиалуроновой кислоты, используют подкожно и внутримышечно для рассасывания спаек и рубцов после ожогов и операций. Фермент аспарагиназа (разрушает аминокислоту Асн в крови) используется при онкологических заболеваниях крови, ограничивая поступление аминокислоты Асн в опухолевые клетки. Лейкозные клетки не способны к самостоятельному синтезу этой аминокислоты, поэтому снижение ее содержания в крови нарушает рост этих клеток. ТЕМА 2.10. ЭНЗИМОПАТИИ В основе многих заболеваний лежит нарушение функционирования ферментов в клетке - так называемые энзимопатии. Различают энзимопатии первичные (наследственные) и вторичные (приобретенные). Приобретенные энзимопатии, как и вообще протеинопатии, по-видимому, наблюдаются при всех заболеваниях. При первичных энзимопатиях дефектные ферменты наследуются в основном, по рецессивно-аутосомному типу. При этом нарушается метаболический путь, содержащий дефектный фермент (рис. 2.35). Развитие заболевания в этом случае может происходить по одному из «сценариев»: • нарушается образование конечных продуктов, что вызывает недостаток определенных веществ (например, при альбинизме не вырабатывается пигмент в клетках кожи); • накапливаются субстраты-предшественники, оказывающие токсическое действие на организм (например, при алкаптонурии накапливается промежуточный метаболит - гомогентезиновая кислота, которая откладывается в суставах, вызывая в них воспалительные процессы).
Рис. 2.37. Схема образования в клетке пуриновых нуклеотидов
|
||||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 681; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.105.124 (0.008 с.) |
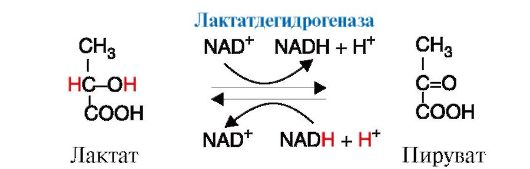 Рис. 2.31. Реакция, катализируемая лактатдегидрогеназой (ЛДГ)
Рис. 2.31. Реакция, катализируемая лактатдегидрогеназой (ЛДГ)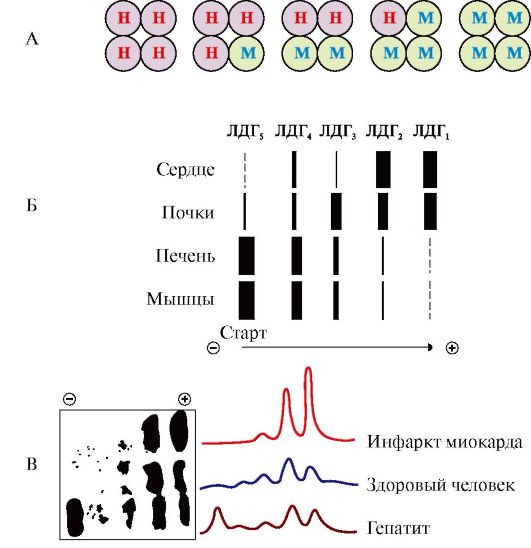 Рис. 2.32. Изоформы лактатдегидрогеназы:
Рис. 2.32. Изоформы лактатдегидрогеназы: Рис. 2.33. Реакция, катализируемая ферментом креатинкиназа (КК)
Рис. 2.33. Реакция, катализируемая ферментом креатинкиназа (КК)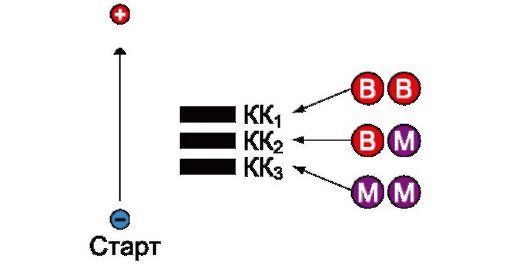 Рис. 2.34. Структура и электрофоретическая подвижность различных изоформ креатинкиназы
Рис. 2.34. Структура и электрофоретическая подвижность различных изоформ креатинкиназы Рис. 2.35. Метаболический путь с энзимопатией фермента Е3
Рис. 2.35. Метаболический путь с энзимопатией фермента Е3 Рис. 2.36. Регуляции активности ТАГ-липазы
Рис. 2.36. Регуляции активности ТАГ-липазы
 Для ответа на
Для ответа на


