Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Патофизиология системы крови.Содержание книги Поиск на нашем сайте ПАТОФИЗИОЛОГИЯ СИСТЕМЫ КРОВИ. Дизэритропоэтические и Гемолитические анемии
Учебно-методическая разработка для студентов медико-диагностического факультета
Гомель 2013
Составитель: Атаманенко И.А. ПАТОФИЗИОЛОГИЯ СИСТЕМЫ КРОВИ. Дизэритропоэтические и гемолитические анемии
1. Актуальность темы: В клинической медицине общий и биохимический анализы крови являются ведущими методами лабораторной диагностики, позволяющими (зачастую самостоятельно) устанавливать диагноз большинства гематологических заболеваний, включая все виды анемий. Дизэритропоэтические и гемолитические анемии различны по этиологии, механизмам развития, клинико-гематологической картине, поэтому изучение этих видов анемий особенно важно в практической деятельности врачи. 2. Цель занятия: 1. Изучить этиологию, патогенез и основные проявления дизэритропоэтических анемий. 2. Изучить этиологию, патогенез и основные проявления гемолитических анемий.
3. Задачи занятия: 1. Знать основные причины, механизмы развития и клинические проявления дизэритропоэтических анемий. 2. Знать классификацию, этиологию и патогенез гемолитических анемий. 3. Уметь по гемограмме выносить заключение о качественных и количественных изменениях крови. 4. Знать основные нарушения и компенсаторно-приспособительные процессы в организме при анемиях и полицитемиях.
4. Основные учебные вопросы (план): 1. Дизэритропоэтические анемии:классификация. 2. Дефицитные анемии. Анемии при недостатке витамина В12 и фолиевой кислоты: этиология, патогенез, клинические проявления. 3. Ахрестические анемии: причины, механизмы развития, клинические проявления. 4. Анемии в результате подавления эритропоэза токсическими воздействиями, ионизирующей радиацией, аутоиммунными процессами. 5. Апластические анемии. Этиология, патогенез. Основные клинические проявления. 6. Метапластические анемии: этиология, патогенез, проявления. 7. Гемолитические анемии: определение понятия, классификация. 8. Наследственные гемолитические анемии. Эритроцитопатии (мембранопатии): этиология, патогенез, клинические проявления, проявления в органах кроветворения и в периферической крови. 9. Эритроэнзимопатии (ферментопатии): этиология, патогенез, клинические проявления, проявления в органах кроветворения и в периферической крови. 10. Гемогобинопатии: этиология, патогенез, клинические проявления, проявления в органах кроветворения и в периферической крови. 11. Приобретенные гемолитические анемии: виды, причины, механизмы развития, проявления в органах кроветворения и в периферической крови. 12. Роль аутоиммунных процессов в патогенезе анемий. Аутоиммунные гемолитические анемии. 13. Эритроцитозы: этиология, патогенез, основные проявления. 14. Болезнь Вакеза: этиология, патогенез, проявления в органах кроветворения и в периферической крови. 15. Нарушения и компенсаторно-приспособительные процессы в организме при анемиях и полицитемиях.
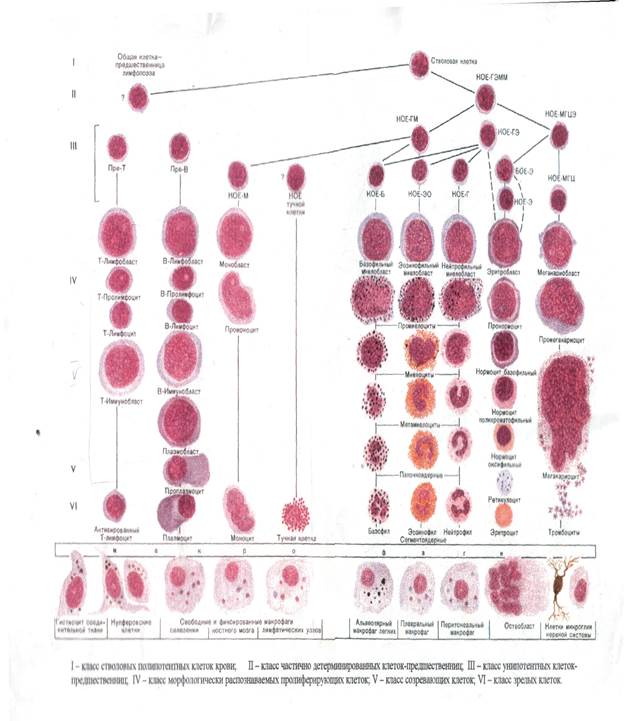
4. Вспомогательные материалы по теме: Схема нормального кроветворения
Эритроцитарные индексы Для характеристики анемии с помощью автоматических счетчиков используются расчетные индексы эритроцитов. Средний объем эритроцита (mean corpuscular volume – MCV). Единица измерения: fL (фемтолитр, 1 фл = 1 мкм3). В норме показатель составляет 80-100 фл (10-15л) или 80-100 мкм3
где HCT – гематокритный показатель в %, RBC – число эритроцитов в млн. в 1 мм3 крови.
MCV < 80 фл свидетельствует о микроцитозе, MCV > 100 фл. – о макроцитозе. Среднее содержание гемоглобина в эритроците (среднекорпускулярное содержание гемоглобина-mean corpuscular hemoglobin – MCH). Единица измерения: пикограмм. В норме –25,4 – 34,6 пг/клетка или (25,4 – 34,6)×10-15 кг/клетка;
где Hb – кол-во гемоглобина в крови (г/л), RBC – число эритроцитов в 1 л крови. Средняя концентрация гемоглобина в эритроците (mean cell hemoglobin concentration – МСНС). Повышение МСНС фактически быть не может, т.к. повышение концентрации гемоглобина выше физиологического может закончиться кристаллизацией его и гемолизом эритроцита. Единицы измерения: г/л. В норме – 0,3 – 0,38 кг/л
где Hb – кол-во гемоглобина в крови (г/л), HCT – гематокритный показатель (%). При В12- и фолиеводефицитной анемиях МСНС будет в норме, а гиперхромия в данном случае будет обусловлена увеличением объема эритроцитов. Ширина распределения эритроцитов по объему (red cell distribution width – RDW) Показатель гетерогенности эритроцитов по объему, характеризует степень анизоцитоза. По этому параметру анизоцитоз улавливается прибором значительно быстрее, чем при визуальном просмотре мазка крови. В то же время, показатель RDW характеризует колебания объема клеток внутри популяции и не связан с абсолютной величиной объема эритроцитов. Поэтому, при наличии в крови популяции эритроцитов с измененным, но достаточно однородным размером (например, микроциты), значения RDW могут быть в пределах нормы. Единицы измерения: % - процент отклонения объема эритроцитов от среднего значения в популяции (% разброса). В норме – 11,5 – 14,5 % Эритроциты в норме распределяются по диаметру в виде так называемой кривой Прайс–Джонса. Медиана кривой приходится на 7,2 мкм, размах составляет не более 4 мкм (5–9 мкм). При микроцитарных (средний диаметр эритроцита до 7,2 мкм) и макроцитарных (средний диаметр — более 8,3 мкм) состояниях имеются соответствующие сдвиги кривой Прайс–Джонса (рис. 1).
Рисунок 1. – Кривые Прайс–Джонса (распределение эритроцитов по диаметру) в норме и при патологии. Сплошная линия — норма, пунктирная линия слева — при микроцитарной анемии, штрихпунктирная линия справа — при макроцитарной анемии (по Л. В. Козловской, М. А. Мартыновой) ПОКАЗАТЕЛИ КРОВИ В НОРМЕ
* наиболее употребляемая размерность показателя Дизэритропоэтические анемии
ü Дефицитные анемии – при дефиците веществ, необходимых для нормального кроветворения (дефицит микроэлементов (железо, медь, кобальт), витаминов (В12, В6, В2, фолиевая кислота) и белков) ü Ахрестические – при неспособности костного мозга усваивать гемопоэтические факторы
В12-дефицитные и фолиеводефицитные анемии. Витамин В12 и фолиевая кислота — кофакторы синтеза ДНК. Их дефицит сопровождается нарушением процессов пролиферации клеток с высоким кругооборотом — клеток крови, клеток кишечного эпителия и как следствие развитием анемии, характеризующейся наличием и костном мозгу мегалобластов, расстройствами пищеварения. Сочетанный дефицит витамина В12 и фолиевой кислоты встречается редко, чаще наблюдается изолированный дефицит витаминов. Этиология. Дефицит витамина В12 чаще развивается в результате нарушения его всасывания при снижении секреции внутреннего фактора Касла вследствие атрофии слизистой желудка либо после резекции желудка (агастрические анемии). У большинства на больных с дефицитом витамина В12 обнаруживаются антитела, направленные против обкладочных клеток желудка и внутреннего фактора Касла. В12- и фолиеводефицитные состояния могут разминаться также при инвазии широким лентецом, поглощающим большое количество витамина В12, при беременности, нарушении всасывания витамина В12 в кишечнике, реже — при недостатке поступления с пищей (табл. 2). Таблица 2. Причины развития мегалобластных анемий
Рисунок 2. – Схема метаболизма витамина В12 в организме Патогенез В12-дефицитной анемии В норме витамин В12 (внешний антианемический фактор) образует комплекс с гастромукопротеином (внутренним антианемическим фактором), который взаимодействует со специфическими рецепторами в нижней и средней частях подвздошной кишки, что обеспечивает всасывание витамина В12. Около 1 % витамина В12 может всосаться независимо от внутреннего фактора. Один из коферментов витамина В12 — метилкобаламин участвует в нормальном кроветворении. С его участием из уридинмонофосфата образуется тимидинмонофосфат, входящий в состав ДНК. Для синтеза тимидинмонофосфата необходима также фолиевая кислота. При отсутствии метилкобаламина ДНК не образуется, нарушаются процессы деления активно регенерирующих клеток, наиболее резко проявляющиеся со стороны эритропоэза; нормобластический тип кроветворения переходит в мегалобластический. Для последнего характерны сравнительно меньшее число митозов (вместо трех митозов, свойственных нормобластическому эритропоэзу, происходит один), удлинение времени митотического цикла, ранняя гемоглобинизация мегалобластов, снижение осмотической резистентности мегалоцитов, сокращение продолжительности их жизни, увеличение неэффективного эритропоэза, сокращение продолжительности жизни эритроцитов, повышение активности гемолитических свойств плазмы крови, что ведет к развитию билирубинемии. Появляются экстрамедуллярные очаги мегалобластического кроветворения. Нарушается также лейко- и тромбоцитопоэз. Второй кофермент — дезоксиаденозилкобаламин участвует в обмене жирных кислот, в превращении метилмалоновой кислоты в янтарную. При дефиците витамина В12 в организме накапливается метилмалоновая кислота, вызывающая дистрофию заднебоковых столбов спинного мозга, развитие фуникулярного миелоза, нарушение функции центральной нервной системы. В периферической крови: выраженная гиперхромная анемия (ЦП > 1,0). Количество эритроцитов снижается в большей степени, чем Нb, обнаруживают лейкопению с нейтропенией, относительный лимфоцитоз, тромбоцитопению. В мазке: мегалобласты, мегалоциты, анизоцитоз, пойкилоцитоз, макроцитоз, эритроциты с тельцами Жолли, кольцами Кабо, базофильной зернистостью, гигантские полисегментоя-дерные нейтрофилы, снижается число ретикулоцитов (увеличение его свидетельствует о ремиссии), СОЭ увеличивается. В костном мозге иногда отсутствуют оксифильные мегалобласты, преобладают базофильные формы («синий костный мозг»). В клетках отмечаются дегенеративные изменения. Нарушения в желудочно-кишечном тракте и нервной системе усугубляют течение анемии. Развиваются глоссит Гунтера (воспаление с последующим формированием «лакированного» языка в связи с атрофией его сосочков), стоматит, гастроэнтероколит. Неврологический синдром проявляется психическими расстройствами (бред, галлюцинации), шаткой походкой, парестезиями, болевыми ощущениями, онемением конечностей, парапарезами, возникновением патологических рефлексов и др. В12-ахрестическая анемия При данной анемии процесс выработки внутреннего антианемического фактора не нарушается, отсутствуют изменения со стороны пищеварительной и нервной систем. Развитие этой анемии связывают с нарушением метаболизма метилкобаламина, в результате чего костный мозг утрачивает способность утилизировать гемопоэтические вещества, возникает мегалобластический эритропоэз. Картина крови, как при В12- и фолиеводефицитной анемиях. Содержание витамина В12 в плазме крови бывает нормальным или повышенным. В тропических и субтропических странах встречается тяжелый прогрессирующий энтероколит инфекционной природы — СПРУ. Он протекает с нарушением всасывания в кишечнике витамина В12 и фолиевой кислоты, дисбактериозом, синдромом мальабсорбции, пенистым поносом, истощением, белковым голоданием. Все эти явления связаны со снижением, вплоть до полного подавления, процесса выработки воспаленной кишечной стенкой белка-акцептора, ответственного за перенос витамина В12 и фолиевой кислоты через кишечную стенку, быстрым прохождением витаминов по кишечнику из-за диареи, а также нарушением образования фолиевой кислоты вследствие дисбактериоза. Картина крови аналогична таковой при В12 и фолиеводефицитных анемиях. Сидероахрестические анемии Сидероахрестические (сидеробластные) анемии (САА) – группа наследственных или приобретенных анемий, при которых нарушается активность ферментов, участвующих в синтезе или утилизации порфиринов. Недостаточное образование порфиринов приводит к нарушению использования железа. Патогенез В основе патогенеза САА лежит дефект ферментов, участвующих в синтезе протопорфирина и гемма. Дефицит активности ферментов способствует нарушению образования протопорфирина на различных этапах. В результате в эритрокариоцитах КМ уровень протопорфирина снижается. Нарушается утилизации железа: оно не может соединиться с протопорфирином и включиться в структуру гемоглобина. Железо откладывается в митохондриях эритрокариоцитов, формируя большое количество кольцевидных сидеробластов, развивается неэффективный эритропоэз, внутримозговой гемолиз эритроцитов и как следствие – анемия. В связи с нарушением синтеза гемма увеличивается содержание железа в сыворотке, оно откладывается в органах и тканях с последующим развитием эритропоэтического гемосидероза. Таблица 3. Классификация сидероахрестических анемий.
Наследственные формывстречаются редко, развиваются в результате мутации гена, кодирующего синтез фермента, участвующего в синтезе ыраж. Чаще встречаются приобретенные формы, связанные с интоксикацией. Развиваются при применении противотуберкулезных препаратов, обладающих антагонистическим действием по отношению к пиридоксину, при дефиците витамина В6, хроническом алкоголизме, при свинцовом отравлении (сатурнизме) в результате блокирования свинцом сульфгидрильных групп ферментов, участвующих в синтезе ыраж, при хронических заболеваниях. В периферической крови: анизоцитоз (микроциты), пойкилоцитоз (мишеневидные эритроциты), гипохромия эритроцитов, ретикулоциты в норме или снижены, а при свинцовой интоксикации повышены (гемолиз эритроцитов), базофильная пунктация цитоплазмы (иногда кодоцитоз). Содержание лейкоцитов, тромбоцитов, лейкоцитарная формула остаются нормальными, если не нарушается функция печени. В костном мозге увеличивается количество сидеробластов – нормобласты с включением гранул негемового железа. Биохимический анализ – наблюдаются ыраженные изменения параметров метаболизма железа, свидетельствующие о его преизбытке в организме: содержание железа в сыворотке крови значительно увеличено (62,7 – 98,5 мкмоль/л), снижение ОЖСС, увеличение степени насыщения трансферрина железом, увеличение уровня сывороточного ферритина. Клинические проявления САА обусловлены анемическим синдромом и синдромом перегрузки железом. Железо накапливается в печени и селезенке, они увеличиваются в размере. Развивается цирроз, сахарный диабет, сердечная недостаточность, евнухоидизм, гиперпигментация кожных покровов. Характерным признаком наследственных форм САА является появление красного оттенка зубов. Клиническая картина при свинцовом отравлении характеризуется поражением нервной системы (энцефалопатии, полиневриты, парезы). Кожа пациентов имеет землисто-сероватый оттенок («свинцовая бледность»), схваткообразные абдоминальные боли «свинцовые колики», лиловая кайма на деснах — следствие отложения в клетках свинца «свинцова кайма»). Апластические анемии Апластические анемии (АА) – группа заболеваний, обусловленных врожденным или приобретенным дефектом гемопоэтической стволовой клетки, приводящим к уменьшению или отсутствию продукции гемопоэтических клеток, жировому замещению КМ и, как следствие, панцитопении в периферической крови. Классификация: 1. Наследственные и врожденные АА: ü а. Блекфана – Даймонда (угнетение только красного ростка); ü а. Фанкони (угнетение всех ростков гемопоэза); ü а. Эстрена – Дамешека (угнетение всех ростков гемопоэза); ü Врожденный дискератоз (нейтропения); ü а. Швахмана – Даймонда – Оски (нейтропения); ü Ретикулярный дисгенез (нейтропения); ü Амегакариоцитарная тромбоцитопения (тромбоцитопения). 2. Приобретенные (угнетение всех ростков гемопоэза): ü Идиопатическая; ü Вторичная, возникающая в результате воздействия одного из возможных экзогенных или эндогенных этиологических факторов: физические – радиация, токи высокой частоты, вибрация; химические – миелотоксические вещества, медикаменты (левомицетин, сульфаниламиды, противотуберкулезные, противодиабетические), препараты золота, соли тяжелых металлов, краски и т. д. инфекционные – вирусы (герпеса, гепатита), бактерии, грибы. Среди эндогенных факторов значение имеют нарушения функций желез внутренней секреции, системные заболевания соединительной ткани (СКВ, ревматоидный артрит и др.), беременность. Патогенез: наследственный (врожденный) или приобретенный дефект полипотентной стволовой клетки; изменение стромального микроокружения, что приводит к нарушению развития и созревания гемопоэтической стволовой клетки (ГСК); недостаточная продукция гемопоэтических ростовых факторов; клеточная и/или гуморальная иммунная супрессия ГСК; прогрессирующее гуморальное нарушение репарации теломер хромосом (вследствие мутации теломеразы). Клиническая картина обусловлена развитием панцитопении и состоитиз трех основных синдромов: анемического, геморрагического и инфекционного. 1. Анемический синдром характеризуется бледностью кожни и видимых слизистых оболочек, повышенная утомляемость, слабость, тахикардия, одышка. 2. Геморрагический синдром характеризуется патехиально-пятнистым типом кровоточивости (геморрагические высыпания на коже, слизистых полости рта носовые и десневые кровотечения и т.п.). 3. Инфекции бактериальные и грибковые развиваются в результате нейтропении (ангины, пневмонии, сепсис). 4. Врожденные формы АА сопровождаются врожденными пороками развития и различными аномалиями органов и систем (косоглазие, полидактилия и др.) Картина периферической крови: панцитопения (выраженная анемия, Нb — 20–80 г/л; нормохромия, макроцитоз, сниженное количество ретикулоцитов, лейкопения, абсолютная нейтропения, относительный лимфоцитоз, тромбоцитопения, увеличена СОЭ до 30-50 мм/ч); Костный мозг. Уменьшение объема гемопоэтической ткани, замещение костного мозга жировой тканью. Биохимический анализ крови: увеличение содержания в сыворотке железа, ферритина, снижение ОЖСС, обжего белка. Определение уровня фетального гемоглобина в венозной крови – проводится с целью диагностики анемии Фанкони (повышается при а. Фанкони) Метапластические анемии Данная патология возникает при разрастании в костном мозге клеток, не имеющих отношения к эритропоэзу (острый лейкоз, множественная миелома, миелофиброз, остеомиелосклероз, метастазы опухолей). Картина крови определяется основным заболеванием. Мембранопатии Основным патогенетическим звеном гемолитических анемий этой группы является генетический дефект белково-липидной структуры мембраны эритроцитов, что приводит к изменению формы и эластичности клеток. В результате нарушается способность эритроцитов деформироваться в узких участках кровотока, в частности при переходе из межсинусных пространств селезенки в синусы. В процессе циркуляции эритроциты постепенно теряют оболочку и, в конечном счете, разрушаются макрофагами РЭС. Из группы мембранопатий наиболее часто встречаемым заболеванием является наследственный микросфероцитоз (болезнь Минковского-Шоффара), в основе которого лежит наследственный дефект белков мембраны (анкирина, спектрина, белка полосы 3, 4, 2), способствующий повышенной ее проницаемости для ионов натрия. Избыток натрия, а вместе с ним и воды увеличивает объем эритроцитов и придает им характерную шаровидную форму (сфероцитоз). Утрата части клеточной оболочки приводит к уменьшению размеров эритроцитов и образованию микросфероцитов (микросфероцитоз). В результате прогрессирующей фрагментации мембраны после двух-трех последующих прохождений через селезеночные синусы микросфероциты подвергаются внутриклеточному гемолизу. Одной из причин укорочения продолжительности жизни микросфероцитов (до 7–14 дней) служит также истощение их ферментных ресурсов (расход АТФ, глюкозы) в процессе удаления из клеток избытка воды. Аномалия передается с аутосомной хромосомой и наследуется по доминантному типу, т.е. болезнь проявляется не только у гомозигот, но и у гетерозигот. Гемолитические кризы возникают при воздействии холода, эмоциональном стрессе, беременности, инфекциях. Центральное место в клинической картине занимают три ведущих симптома (триада Шоффара): желтуха, бледность кожи и слизистых, спленомегалия (у 75–80% больных). Картина периферической крови: ü Нормохромная, нормоцитарная гиперрегенераторная анемия различной степени выраженности: вне криза Нв – 100-110 г/л, в период гемолитического криза – до 40-50 г/л; МСНС повышена в 50% случаев до 38-39%; ü микросфероцитоз, анизоцитоз, пойкилоцитоз, мишеневидные эритроциты; ретикулоцитоз вне криза – 3-10%, сразу после криза – более 10 %. ü Лейкоцитарная формула вне криза – в норме, в период гемолитического криза – лейкоцитоз с нейтрофилезом, СОЭ в период криза увеличена. Биохимический анализ: гипербилирубинемия, увеличение активности лактатдегидрогеназы и концентрации железа, реже – сывороточного ферритина. Осмотическая резистентность эритроцитов снижена. Энзимопатии Обусловлены наследственным дефицитом ряда ферментов эритроцитов. В мире насчитывается несколько сотен миллионов человек (примерно 1/20 человечества) — носителей наследственного дефицита глюкозо-6-фосфатдегидрогеназы (Гл-6-ФДГ). При недостатке Гл-6-ФДГ блокируется реакция окисления глюкозо-6-фосфата в пентозофосфатном цикле, вследствие чего уменьшается образование восстановленной формы глутатиона, предохраняющего SH-группы глобина и мембраны эритроцитов от повреждающего действия различного рода окислителей. Это сопровождается снижением устойчивости эритроцитов к действию активных форм кислорода, окислительной денатурацией гемоглобина и белков мембраны эритроцитов с последующим внутрисосудистым гемолизом клеток. Описано около 90 различных мутантных форм Гл-6-ФДГ, из которых основными являются европейская форма дефицита (активность фермента в пределах 90% от нормы), африканская (10–15%) и средиземноморская (менее 1%). Дефицит Гл-6-ФДГ наследуется как сцепленный с Х-хромосомой признак, в связи, с чем заболевают в основном мужчины. Клинически носительство дефицита Гл-6-ФДГ проявляется острыми гемолитическими кризами при приеме некоторых лекарств, обладающих окислительными свойствами: хинин, сульфаниламиды, производные салициловой кислоты и др., при употреблении в пищу конских бобов и стручковых растений (фавизм), а также на фоне заболевания вирусным гепатитом или гриппом. В период гемолитического криза у больных выявляются признаки внутрисосудистого гемолиза — повышение температуры тела, бледность, умеренная желтушность кожи и склер, головная боль, рвота, диарея. Вследствие гемоглобинурии возможно развито острой почечной недостаточности. Картина периферической крови: ü Нормохромная, нормоцитарная анемия; ü анизо- и пойкилоцитоз (дегмациты), базофильная пунктация, тельца Гейнца-Эрлиха в эритроцитах, ü ретикулоцитоз, ü лейкоцитоз со сдвигом лейкоцитарной формулы влево. Исследования КМ: гиперклеточный, реактивная гиперплазия эритроидного ростка. Биохимический анализ крови – повышение содержания в сыворотке неконьюгированного билирубина, резкое увеличение свободного гемоглобина в крови и снижение гаптоглобина. Гемоглобинопатии Связаны с наследственным нарушением синтеза гемоглобина. «Качественные» гемоглобинопатии и сопровождаются изменением первичной структуры молекулы гемоглобина; «количественные» гемоглобинопатии характеризуются нарушением количественного соотношения НЬА и HbF в крови из-за недостаточности образования отдельных полипептидных цепей глобина. Как и носительство дефицита Гл-6-ФДГ, наследственные гемоглобинопатии относятся к числу наиболее распространенных в человеческой популяции генетических аномалий. Среди известных форм гемоглобинопатии наибольшее значение в практическом отношении представляют гемоглобиноз S (серповидно-клеточная анемия) и талассемия.
Серповидно-клеточная анемия (СКА) (гемоглобиноз S). Заболевание возникает в связи с наследованием патологического гемоглобина S, в котором гидрофильная глутаминовая кислота в 6-м положении β-цепи глобина замещена на гидрофобный валин. Это приводит к смене электрического заряда и полимеризации гемоглобина в условиях гипоксии, снижению его растворимости с образованием тактоидов (веретенообразных остроконечных кристаллов), которые растягивают оболочку эритроцитов. В результате клетки приобретают форму «серпа», теряют пластичность, повышают вязкость крови, замедляют кровоток, вызывают стаз. Стаз, в свою очередь, приводит к развитию гипоксемии, еще более повышая уровень «серпления» эритроцитов. Острыми концами серповидные эритроциты могут повреждать другие измененные и неизмененные эритроциты, что сопровождается внутрисосудистым гемолизом. Часть серповидных эритроцитов разрушается в селезенке. Средняя продолжительность жизни эритроцитов при серповидно-клеточной анемии не превышает 17 дней. Патогенез СКА см. на рис.2.
Рисунок 2 – Схема патогенеза СКА
Тяжелая анемия проявляется лишь у гомозиготных по HbS носителей. Усиление образования серповидных эритроцитов с развитием гемолитического криза отмечается при действии низких температур, патологических состояниях, сопровождающихся ацидозом, инфекциях, дегидратации, лихорадке, голодании, заболеваниях легких, в условиях гипоксии. Вследствие компенсаторной спленомегалии у ряда пациентов в силу неизвестных причин вероятна массивная секвестрация эритроцитов в селезенке, что может стать причиной развития гипотензии и внезапного летального исхода. У гетерозигот заболевание протекает, как правило, бессимптомно. Поскольку серповидные эритроциты являются непригодными для жизнедеятельности малярийных плазмодиев, люди-носители аномального HbS — обладают резистентностью к малярии. Картина периферической крови: ü нормохромная, нормоцитарная анемия, концентрация гемоглобина 60-80 г/л; ü анизо- и пойкилоцитоз (серповидные, мишеневидные эритроциты, овалоциты, шизоциты) ü полихроматофилия эритроцитов, базофильная пунктация эритроцитов, единичные нормобласты, ü ретикулоцитоз более 5%, ü лейкоцитоз до 12-20×1012, нейтрофилез, сдвиг формулы влево; ü тромбоцитоз; ü СОЭ снижена. Исследавания костного мозга: гиперклеточный, преобладают клетки красного ряда. Биохимический анализ: гипербилирубинемия, повышение активности лактатдегидрогеназы, увеличение сывороточного железа и ферритина, гемосидероз развивается редко. Гетероиммунные (гаптеновые) Гемолитические анемии формируются в связи с появлением на поверхности эритроцитов больного нового антигена (гаптена). Гаптенами могут служить лекарственные препараты и вирусы. Изоиммунные Гемолитические анемии характеризуются тем, что антитела против антигенных детерминант эритроцитов попадают в организм больного извне. Примером являются посттрансфузионные гемолитические анемии и гемолитическая болезнь новорожденного. Гемолитическая болезнь плода и новорожденного (ГБН) развивается в результате несовместимости матери и плода по антигенам эритроцитов системы Rh (D) (у Rh- положительных детей от Rh-отрицательных матерей) или по антигенам эритроцитов системы АВ0 (у детей с группой крови А, В или АВ, матери которых имеют группу крови 0). Первая беременность Rh-отрицательной матери Rh-положительным плодом обычно протекает нормально. Во время родов происходит иммунизация матери антигенами эритроцитов плода с выработкой антиэритроцитарных антител (анти Rh (D)-IgG), которые в период второй беременности Rh-положительным плодом фиксируются на эритроцитах плода и обусловливают гибель эритроцитарных клеток путем внутриклеточного гемолиза с развитием эритробластоза плода. Основными симптомами ГБН являются желтуха, гепато- и спленомегалия, в тяжелых случаях - отеки, асцит (из-за недостаточности кровообращения). Наиболее опасным симптомом анемии служит «ядерная желтуха» с признаками поражения нервной системы вследствие токсического действия непрямого билирубина, к которым относятся нистагм, судорожные подергивания, крик высокой тональности. Встречаются случаи мертворождения. Трансиммунные Гемолитические анемии развиваются при проникновении в организм новорожденного антиэритроцитарных антител матери, страд
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 159; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.211.240 (0.017 с.) |