
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вихідною речовиною для цього способу служать природні продукти, багаті на крохмаль: картопля, зерна пшениці, жита, кукурудзи тощо, а також целюлоза.Содержание книги
Поиск на нашем сайте
Індивідуальна робота
на тему: "Біотехнологія етанолу "
Виконали: Студент ІV курсу Групи 4118-1Б Карпенко Ю.В.
Запоріжжя ЗМІСТ ВСТУП.. 3 ІСТОРІЯ ВІДКРИТТЯ.. 4 ЗАГАЛЬНА ХАРАКТЕРИСТИКА.. 5 КЛАСИФІКАЦІЯ.. 5 РОЗПОВСЮДЖЕННЯ.. 6 ФІЗИКО-ХІМІЧНІ ВЛАСТИВОСТІ. 7 МЕТОДИ ВИЯВЛЕННЯ, ВИДІЛЕННЯ І АНАЛІЗУ ЕТАНОЛУ.. 10 СТАНДАРТИЗАЦІЯ ВИДІЛЕНОЇ РЕЧОВИНИ.. 23 БІОСИНТЕЗ. 24 БІОЛОГІЧНА ТА ФАРМАКОЛОГІЧНА РОЛЬ. 25 ВИСНОВКИ.. 27 СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ.. 29
ВСТУП Кожний з нас чув слово «спирт» і в принципі знає, що воно означає. А ось хімічне трактування спиртів: «Спирти це органічні сполуки, в молекулах яких міститься одна або декілька гідроксильних груп, сполучених з вуглеводневим радикалом». Назви спиртів походять від назв радикалів, а також з назв вуглеводів додаванням закінчення -ол (метанол, етанол, пропанол, бутанол і т.д.) Нижчі спирти рідини, вищі з числом вуглецевих атомів більше 12 - тверді речовини. Всі спирти легше за воду. Найбільш відомі і що часто застосовуються на практиці з граничних одноатомних спиртів - це метанол і етанол. Археологічні розкопки свідчать, що в епоху стародавніх цивілізацій уміли виготовляти вино і пиво. Схоже, що алкоголь був першою речовиною, синтезованою людиною. Перша літературна згадка про власне етиловий спирт, як «горючу воду», отриману перегонкою вина, відноситься до VIII в. А елементний склад етанолу був визначений на початку XIX в. ІСТОРІЯ ВІДКРИТТЯ Етиловий спирт, вірніше рослинний хмільний напій, що його містить, був відомий людству з глибокої давнини. Вважається, що не менш ніж за 8000 років до нашої ери люди виготовляли легкі спиртні напої з фруктів і меду. Вперше спирт з вина отримали в 6-7 століттях арабські хіміки, а першу пляшку міцного алкоголю (прообразу сучасної горілки) виготовив перський алхімік Ар-Рази в 860 році. У Європі етиловий спирт був отриманий із продуктів бродіння в 11-12 столітті, в Італії. До Росії спирт вперше потрапив у 1386 році, коли генуезьке посольство привезло його з собою під назвою «аква віта» і презентувала царського двору. У 1660 році англійський хімік і богослов Роберт Бойль вперше отримав зневоднений етиловий спирт, а також відкрив його деякі фізичні і хімічні властивості, зокрема виявивши здатність етанолу бути високотемпературним пальним для пальників. Абсолютний (безводний) етиловий спирт був отриманий у 1796 році російським хіміком Т.Є. Ловіцем. У 1842 році німецький хімік Я.Г. Шіль відкрив, що спирти утворюють Гомологічний ряд, відрізняючись на деяку постійну величину. Щоправда, він помилився, описавши її як C2H2. Через два роки, інший хімік Шарль Жерар встановив вірне гомологічної співвідношення CH2 і передбачив формулу і властивості невідомого в ті роки пропілового спирту. У 1850 році англійський хімік Олександр Вільямсон, досліджуючи реакцію алкоголятів з етил йодидом, встановив, що етиловий спирт є похідним від води з одним зміщенням воднем, експериментально підтвердив формулу C2H5OH. Вперше синтез етанолу дією сірчаної кислоти на етилен здійснив у 1854 році французький хімік Марселен Бертло. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
Діючий компонент алкогольних напоїв, що є психоактивным речовиною, що й впливає як депресант на центральну нервову систему людини.
РОЗПОВСЮДЖЕННЯ Етиловий спирт - природній продукт спиртового шумування органічних продуктів, що містять вуглеводи, що часто утворюється в прокисших ягодах і фруктах без усякої участі людини. Крім того, этанол є природнім метаболітом і втримується в тканинах і крові тварин і людину. Фізичні властивості Зовнішній вигляд: у звичайних умовах являє собою безбарвну летучу рідину з характерним заходом. Слід уникати популярної помилки: часто змішують властивості 95,57 % спирту й абсолютизованого. Їхні властивості майже однакові, але величини починають різнитися, починаючи з 3 - 4- й значущої цифри.
Суміш 95,57 % этанола + 4,43 % води є азеотропної, тобто не розділяється при перегонці. Хімічні властивості Взаємодіє з лужними металами з утворенням этилатів (або в загальному випадку - алкоголятів) і водню. 2C2H5OH + 2K = 2С2Н5ОК + Н2. Реагує з карбоновими кислотами з утвором складних ефірів: RCOOH + HOCH2CH3 → RCOOCH2CH3 + H2O Вступає в реакцію дегідратації в присутності сірчаної кислоти (при 120 °C) з утвором діетилового ефіру: 2 CH3CH2OH → CH3CH2OCH2CH3 + H2O Згоряє на повітрі й у кисні з виділенням тепла: C2H5OH + 3 O2 → 2 CO2 + 3H2O Взаємодіє з гідридами й гидроксидами лужних металів з утвором этилатів: CH3CH2OH + NaH → CH3CH2ONa + H2 CH3CH2OH + NaOH → CH3CH2ONa + H2O Вступає в реакцію гідрогалогенування в присутності хлориду цинку: CH3CH2OH + HСl → CH3CH2Cl + H2O В основі біотехнологічного одержання етилового спирту, кормових і харчових дріжджів, пивоварства й виноробства лежить процес шумування - один з різновидів біологічного окиснення субстрату в гетеротрофних мікроорганізмів. Біотехнологічні бродильні процеси вивчені порівняно давно. Однак деякі процеси шумування реалізовані на практиці тільки зараз. В основі шумування лежить універсальна реакція перетворення джерела вуглецю глюкози в ключовий проміжний продукт- пировиноградную кислоту, з якої синтезуються подальші продукти, включаючи етиловий спирт. Збудниками спиртового шумування можуть бути дріжджі - сахаромицеты, деякі мицелиальные гриби (Aspergіllus oryzae) і бактерії (Erwіnіa amylovora, Sarcіnaventrіcula, Zymomonas mobіlіs, Z. anaerobіa). Біомаса Енергія субстрату в процесі шумування розподіляється так: 90% переходить в этанол і по 5% - у біомасу й теплоту. Глюкокиназа, 6- фосфатдегидрогеназа, фосфоглюконатдегидро- геназа, 4- 6- фосфоглюконатальдолаза; 5 - дегидрогеназа фосфо- гліцеринового альдегіду; 6 - фосфоглицераткиназа, 7- фосфоглицеромутаза, 5- енолаза, 9 - пируваткиназа, 10 - фруктокиназа, 11- фосфогексоизомераза, 12 - левансахараза, 13 - глюконокиназа, 14 – глюкозофруктозотрансгидрогеназа Тому що швидкість росту біомаси Zymomonas mobіlіs невелика, у середовищі звичайно накопичується 2-3 г/л біомаси, що негативно впливає на продуктивність системи. У зв'язку із цим практикують або штучну іммобілізацію кліток, або використовують флокулирующие штами, наприклад штамом ZM-4, отриманим П. Роджерсом, Л. Аркури із сотр. Використовуючи іммобілізовані клітки Zymomonas mobіlіs у середовищі, що містить 10 % глюкози, досяглися в противоточном режимі продуктивності системи по этанолу 152 г/(л-ч). Максимальна продуктивність при роботі з Saccharomyces cerevіsіae 80 г/ (л x ч). На жаль, на мелассных середовищах продуктивність Z. mobіlіs нижче. Великі успіхи по одержанню этанола при культивуванні Z. mobіlіs досягнуті в Канаді (Н. Lawford et. al., 1989). У результаті цілеспрямованої селекції флокулирующего штаму й оптимізації процесу ферментації продуктивність системи по этанолу становить до 200 г/(л-ч), що майже на 2 порядку перевищує продуктивність ферментаційного процесу на більшості спиртових заводів. При одержанні этанола хімічним шляхом з этилена продуктивність становить 80 г/(л-ч). Зараз у біотехнології этанола широко застосовують флокулирующие штами, які дозволяють підвищити концентрацію біомаси до 40-60 г/л. Однак виникають проблеми, пов'язані з інтенсивним виділенням диоксида вуглецю, який коалестирует і порушує гомогенность процесу. Щоб запобігти цим небажаним явищам створена багатоступінчаста вертикальна колона. Усередині неї встановлений ряд усічених конусів, звернених більшою підставою до верху. Через нижній отвір конуса нагору піднімається рідка фаза із продуцентом, а газ накопичується в просторі між верхньою зовнішньою частиною конуса й циліндром. Звідти через патрубок виводиться З2 з биореактора в загальний вертикальний колектор. При переробці мелассы тростинного цукру з концентрацією цукру 160 г/л за допомогою флокулирующей культури Saccharomyces uvapum биореактор працює 460 год при D = 0,18 год -1. Зміст этанола 7-8 % об. Зміст кліток в 1 мол сброженного субстрату не більш 10. За допомогою колонного ферментатора в досвідах Кастро досягнута продуктивність по этанолу на глюкозному середовищу 22,5 г/(л-л- ч), на мелассной середовищу - 9,6 г/(л-ч), на крохмальній - 2,2 г/(л-ч). Необхідно відзначити, що при ферментації крохмалю були сполучені процеси оцукрювання за допомогою іммобілізованої амилоглюкозидазы й спиртового шумування за допомогою дріжджів. Цікаві результати при сбраживании висококонцентрованих крохмальних субстратів отримані в умовах сполученого процесу оцукрювання й спиртового шумування за допомогою культур Rhіzopus sp. і Saccharomyces у біореакторі із циркуляцією газу. При концентрації субстрату 265 г/л через 3 сут этанола втримувалося 11 % про. Такий вихід досягається за рахунок того, що при циркуляції этанольные й водяні пари переходять у газ. Этанол з газу можна конденсувати при концентрації субстрату в системі 400 г/л, зміст этанола в конденсаті досягає 35,2 %. У зв'язку з обмеженням ресурсів традиційної сировини для виробництва этанола зараз розробляються процеси на основі нових замінників цукру. До них можна віднести синтетичний газ, одержуваний з вугілля. Як відомо, цей газ складається із CO, Н2 і CO2. Виділені бактерії, здатні конвертувати CO і Н2 до этанола згідно з рівняннями: 6CO + ЗН2О - C2Н5OH + 4CO2; 6Н2 + 2CO2 - C2Н5OН + ЗН2O. При одержанні этанола із синтетичного газу велике значення має оптимізація массообмена між газової, рідкої й твердої фазами. У колонному апарату можна одержати концентрацію этанола 2-3 %. Важливим досягненням в області раціонального використання рослинної сировини є розкриття біохімічних і генетичних основ биоконверсии ксилозы в этанол. Мікроорганізми, здатні трасформировать D- Ксилозу в этанол, повинні мати два ферменти. Перший фермент - Nadh-Зави- Симая ксилозоредуктаза - катализирует перетворення D- Ксилози в ксиліт, другий -- Nad- Залежна ксилитдегидрогеназа - окиснить ксиліт в D- Ксилулозу. Остання через пентозный шунт і по гликолизному шляхи може конвертуватися в этанол. Однак цей біохімічний механізм важко піддається регуляції, тому методами генетичної інженерії необхідно було ввести в клітки ген, що кодує синтез ксилозоизомеразы - ферменту, що забезпечує пряму конверсію D-Кси- лози в D- Ксилулозу. Такий ген був трансплантований у дріжджі Schіzosaccharomyces pombe за допомогою ксилозоизомеразной плазмиды Е. coll. Ген інтегрувався із хромосомальной ДНК дріжджів і забезпечив експресію ксилозоизомеразы, що дозволило сбраживать ксилозу до этанола. У результаті продуктивність штаму по этанолу збільшилася з 0,063 до 0,177 г/(л-л- ч). У такий спосіб стало можливим за допомогою Schіzosaccharomyces pombe сбраживать в этанол не тільки D- Глюкозу, одержувану після гідролізу целюлози, але й D- Ксилозу, одержувану після гідролізу гемицеллюлозы. Продуктивність безперервної системи підвищується значно при використанні іммобілізованих або флокулирующих кліток або при рециркуляції біомаси. Подальшого підвищення продуктивності можна досягтися, виводячи этанол з ферментаційного середовища при флеш-ферментации. Ці приклади наочно показують, що за допомогою технологічних методів можна значно інтенсифікувати процес виробництва спирту. Селекція этанолтолерантных штамів - другий шлях інтенсифікації, але менш результативний. Спиртове шумування лежить також в основі пивоварства. Пиво відносять до так званих солодових слабко алкогольних напоїв, одержуваних у результаті сбраживания дріжджами екстрактів з насінь хлібних злаків (солоду). У подібних екстрактах утримуються сбраживаемые вуглеводи. У різних сортах пива перебувають этанол, вуглеводи (глюкоза, мальтоза, мальтотриаоза, мальтотетраоза, декстрини), азотисті речовини (аміди, амінокислоти, пептони), диоксид вуглецю- продукти ферментативного гідролізу осоложенного зерна; гіркоти, смоли, Танин, ефірні масла - із суцвіть жіночих особин хмелю, сліди неорганічних солей і жиру. Фарбування, аромат і міцність пива залежать від штаму дріжджів (Saccharomyces cerevіsіae, S. carlsbergensіs і ін.). На практиці найчастіше застосовують ячмінний солод. Для його готування зерна ячменя воложать, пророщують при 15 - 25'З доти, поки зародковий листок стає в 3 - 4 рази довше зерна ячмінь, що потім проріс, висушують до кінцевої вологості солоду 5%; У такому виді солод може добре зберігатися, при цьому він має специфічні фарбування й аромат. Солод світлого кольору виходить при більш низькій температурі висушування, більш темного кольору - при підвищеній температурі (світлі сорти пива містять менше вуглеводів, чому темні сорти). Відділений від проростків сухий солод може бути використаний не тільки в пивоварстві, але й у винокурінні (одержанні спирту), у кондитерському виробництві. Якщо пиво виготовляють із солоду, води (без яких-.або "дополнителей"), те наступним етапом є затирання, коли прагнуть перевести в розчин найбільшу частину вмісту солоду. Затирання частіше здійснюють або настоюванням, або виварюванням. По першому методу солод дроблять, розмішують у воді при температурі 38 - 50'З (витримують 1 годину), коли активізуються бактеріальні ферменти протеазы, потім температуру підвищують до 65- 70'С и залишають затор на кілька хвилин для гідролізу крохмалю. Після цього температуру підвищують до 75 - 77'Із для денатурації ферментів і затор фільтрують. По другому методу (виварювання) розмелений солод вносять у теплу (40'З) воду, розмішують і поступово підвищують температуру затору до 75'З; близько 1/3 такого затору відбирають і нетривало кип'ятять, після чого його повертають в основний затор. При цьому ферменти руйнуються, клітинні стінки набухають, крохмаль "розпускається" (розріджується), чим полегшує його гідроліз в основному заторі. Кип'ятіння й повернення частини затору можна повторювати 2 - 3 рази. Пиво, отримане на настоенном заторі, більш ароматне, оскільки в нього переходить менше гірких речовин. Пивні дріжджі відносять до розряду флокулирующих, що осідають при посвітлінні молодого пива й наприкінці дображивания; вони не сбраживают декстрини (ці полімерні вуглеводи вносять певний вклад у створення смаку пива). В останні роки вдалося перенести ген Вас.subtіlіs, що детермінує -глюканазу в пивні дріжджі S.cerevіsіaе. Цей рекомбинантный штам виявився здатним переробляти крохмаль безпосередньо в этанол. Із традиційних алкогольних напоїв можна згадати російський хлібний квас, що містить менш 0,5% этанола, популярний у Японії алкогольний продукт Саку (12 - 24% этанола), таэте - алкогольний напій, що приготовляемый з молока й віддавна застосовуваний у Скандинавських країнах - містить менш 2% этанола, і інші. Спиртове шумування перебуває також в основі виноробства. Вина звичайно одержують із соку спілого незіпсованого винограду, відділеного або невідокремленого від мезги (наприклад, при виготовленні червоних вин). Індукторами шумування є різні раси Saccharomyces cerevіsіae. У винах, крім этанола, утримуються: білки, пігменти, неорганічні солі, летучі й нелетучі органічні кислоти, Танин, у деяких сортах - вуглеводи, гліцерин. Вина класифікують по-різному. Так розрізняють: сортові- по сорту винограду, купажные - із суміші сортів; солодкі й сухі - по змісту цукру; натуральні й кріплені, їдальні й десертні - по змісту спирту; гристі й неігристі - по змісту вуглекислоти; білі й червоні - по кольору; ординарні й марочні - по строках витримки. Як пояснення до класифікації можна відзначити, що в сухому вині цукор фактично повністю сброжен, а якщо він є, то в такій кількості, що не відчувається на смак. У солодких винах цукор вираження відчувається на смак. Натуральні вина містять, як правило, 9-11% этанола, рідше-- 13%. У кріплені сухі вина додають коньяк або винний спирт. Столові вина містять менш 14% спирту, десертні - більш 14% (у середньому близько 20%J і деяка кількість цукру. Гристі вина містять значну кількість диоксида вуглецю, що утворюється при дображивании провина в товстостінних посудинах або, що додається до натуральних вин; до гристих відносять шампанське - продукт вторинного шумування провина, коли до не до вину, що бродило, перед розливом у герметизированные пляшки додають лікер до змісту цукру 2,2%, У Росії розроблена технологія виробництва шампанського безперервним методом. У шампанському втримується не тільки підвищену кількість вуглекислоти, але й ряд коштовних метаболітів, що позначаються на специфічному смаку цього вина. Вина, що випускаються в продаж на першому році після виготовлення, називають ординарними, а витримані не менш 1,5 років високі якості, що й зберігають свої, - марочними. Відомі так звані плодові вина (крім виноградних), одержуваних при спиртовому шумуванні соків зрілих плодів: ягідне, яблучне й ін. На виноградних ягодах поселяються різні мікроорганізми (дріжджі, нитчатые гриби, бактерії), які необхідно придушити, тому що в противному випадку буде важко гарантувати одержання вина високої якості. Як інгібітор мікробів - контаминантов давно й ефективно використовують сірчистий газ або сульфіт, наприклад, у вигляді метабисульфита калію (приблизно від 0,1 до 0,2% SO2), що не пригнічують виробничий штам дріжджів у його активну фазу. Пастеризація тут виявляється менш сприятливою. Концентрація цукру у винограді - важливий фактор для ферментації (концентрація його в суслі вище 28% буде гальмувати шумування). Певну роль відіграють вихідне значення рн і температура. Щоб уникнути підвищеної кислотності готового вина, було запропоновано встановлювати рн сусла нижче 3,6; оптимальна температура для більшості рас дріжджів 27 - 29'З, але є й психрофільні види, сбраживающие виноградне сусло при 10'С. При низькій температурі й повільному шумуванні формується більш яскравий букет вина, чому при короткочасному шумуванні й підвищеній температурі. Аэрирование сусла можливо й доцільно на самому початку процесу, щоб швидше наросла біомаса кліток для ведення наступного анаэробного процесу. Кількість суспензії, що привноситься в сусло, дріжджів звичайно становить 1% за обсягом. У випадку застосування биореакторов більших ємностей для виробництва столових вин, що бродить сік примусово прохолоджують, використовуючи теплообмінники, змійовики або інші обладнання. Мезга (оболонки виноградних ягід, насіння, часточки стебел і т.п.) привносить певні складності у зв'язку з теплообміном при шумуванні - утвір "шапки". Очищення вин при природньому збіріганні і дозріванні не завжди завершується його повним посвітлінням. У цих випадках використовується очищення шляхом посвітління, старіння й зі зревания до розливу в пляшки. Доповненням до посвітління є фільтрація (у тому числі -, що стерилізує), пастеризація, охолодження - для видалення винного каменю й колоїдів. Стандартизація спирту проходить за ГОСТ 3639-7(Розчини водно-спиртові. Методи визначення концентрації етилового спирту). Розведення алкогольних напоїв водою можна встановити органолептичним методом (при наявності води понад 30 %). При додаванні меншої кількості води встановити таку фальсифікацію органолептичним методом досить важко. У цьому випадку можна використати простий фізичний метод визначення густини водно-спиртового розчину за допомогою ареометра. У табл. 5.42 наведені дані щодо густини водних розчинів етилового спирту й відповідні цим даним вміст спирту за масою й об'ємом.
З найбільшою імовірністю й точністю наявність будь- яких домішок у горілці, вині й лікеро- горілчаних виробах можна визначити методами хроматографії, яка дозволяє ідентифікувати понад декілька десятків різних сторонніх домішок в алкогольних напайках. Газорідинні хроматографи й хромато-мас- спектрометри, обладнані комп'ютерними системами й банком мас- спектральних даних, дозволяють за декілька хвилин провести повний якісний і кількісний аналіз наспіваю з метою визначення в ньому різних органічних домішок. Алі проведення такого аналізу можливе лише в спеціалізованих лабораторіях, обладнаних спеціальними дорогоцінними приладами й висококваліфікованим персоналом. Цей метод внесень у діючі стандарти на методи визначення якості алкогольних напоїв. Разом з Тім існує цілий ряд простих методів, які дозволяють визначити в алкогольних напайках сивушні олії, фурфурол, альдегіди, кетони у звичайних хімічних лабораторіях і навіть у домашніх умовах при наявності відповідних хімічних реактивів. Визначити в горілці фурфурол можна таким способом. Налити в склянку 20 мол горілки, додати 3 краплі концентрованої соляної кислоти й перемішати скляною паличкою. Потім у цю суміш додати 10 крапель безбарвного ананіліну. Якщо розчин набуває яскраво- червоного кольору, який за забарвленням нагадує малиновий сироп, значити проба містить фурфурол у великій кількості. Сивушні олії мають специфічний запах, який набуває й напій, якщо в ньому міститься понад 0,1 % про. цих речовин. Визначити ці домішки можна легко - досить декілька крапель горілки розтерти між долонями; поява специфічного заходу говорити про наявність сивушних олій. Чиста горілка, у якій сивушні олії відсутні, такого запаху не має. У чисту скляну пробірку налити до половини її об'єму досліджуваний безбарвний алкогольний напій, додати 2-3 краплі концентрованої сірчаної кислоти й стільки ж бензолу. Суміш обережно треба нагріти до появи ознак кипіння, потім повільно охолодити. Якщо зразок не містить сивушних олій, те суміш набуває жовтуватого забарвлення. У тому випадку, коли суміш забарвлюється в темно-бурий колір з зелену- вати відтінком, можна робити обґрунтований висновок - напій має у своєму складі сивушні олії. В основі стандартного методу визначення сивушних олій (ДЕРЖСТАНДАРТ 5964-82 "Спирт етиловий. Правила приймання й методи аналізу") лежить реакція, що відбувається між сивушними оліями, розчином саліцилового альдегіду й сірчаною кислотою. Внаслідок цієї реакції утворюються забарвлені речовини. У дві пробірки об'ємом по 45 мол налити по 10 мол особливо чистої сірчаної кислоти й обережно по стінках долити декілька крапель (3-4) 1 % розчину в безсивушному й безальдегідному спирті саліцилового альдегіду. Потім в одну пробірку долити 5 мол досліджуваного спирту, а в другові - 5 мол типового розчину суміші вищих спиртів (амілового, бутилового, пропілового, гексилового). Пробірки закрити пробками, суміш перемішати й залишити при температурі 20°С на 20 хв. Після цього візуально порівняти забарвлення контрольного й дослідного зразків на білому фоні. Забарвлення дослідного зразка при відсутності в ньому сивушних олій винне бути менш інтенсивним, ніж забарвлення контрольного зразка. Порівняти інтенсивність забарвлення розчинів можна за допомогою фото-електро- колориметра в зеленому світлі. При такому порівнянні можна визначити й кількість сивушних олій. Виявлення альдегідів і кетонів у складі горілки базується на їхній здатності забарвлювати обезбарвлений сірчистою кислотою розчин фуксину. Для приготування обезбарвленого розчину фуксину 0,22 г основного фуксину розтирають у ступці з невеликою кількістю (5-6 крапель) дистильованої води, суміш без втрат переносять у мірну колбу й додають 150 див дистильованої води з температурою 95-98°С. Для повного розчинення фуксину колбу ставлять на водяну баню (95-98°С) на 1 рік. Розчин охолоджують до 20°С, переносять у склянку з темного скла, доводять об'єм до відмітки 400 див, долають 20 див розчину сірчистого натру з густиною 1,290 г/см і 3 див концентрованої сірчаної кислоти густиною 1,830 г/см. Цей розчин витримують 12 год. при температурі 8-10°С, а потім використовують для проведення аналізів. При визначенні наявності альдегідів водно-спиртовий розчин винний мати не більше 40 % спирту. Тому, якщо досліджується горілка міцністю 40 %, те її водою не розводять. 20 див досліджуваної горілки наливають у пробірку, додають 1 див виготовленого раніше фуксинсірчаного розчину з масовою часткою оцтової кислоти 2%. Пробірку закривають пришліфованою пробкою, перемішують, потім додають ще 2 див фуксинсірчаного реактиву, знову перемішують і ставлять на водяну баню з температурою 20 С на 30 хв. Внаслідок реакції утворюється комплексна сполука, що має червоно- фіолетове забарвлення, інтенсивність якого може бути використана для кількісної оцінки вмісту альдегідів з допомогою спектрофотометра при дожині хвилі 536 нм. Галізація провина. Це спроба виправити провина низької якості з підвищеною кислотністю. Для цього в надмірно кисле вино додають воду, а потім нормалізують таку суміш по міцності й кислотності відповідно до вимоги стандартів. Використання консервантів для прискорення технологічного процесу. Частіше за всі використовується саліцилова кислота для консервування дешевих вин, що можуть швидко прокисати, а також вин, які не проходили стадії витримки й зберігання. Підфарбовування вин використовують для приховування інших підробок (розведення водою). Алі відомі випадки, коли малоцінні білі вина перефарбовувалися в червоні. Для цієї мети використовують як природні (ягоди бузини, чорниці, настій Буряка), так і синтетичні (індигокармін, анілінову та антраценову фарби, фуксин) фарбні речовини. У промисловості, поряд з мікробіологичним спобом, використовують гідратацію этилена. Гідратацію можна вести по двом схемам: 1)пряма гідратація при температурі 300 °C, тиску 7 Мпа, у якості каталізатора застосовують ортофосфорну кислоту, нанесену на силікагель, активоване вугілля або азбест: CH2=CH2 + H2O → C2H5OH. 2)гідратація через стадію проміжного ефіру сірчаної кислоти, з наступним його гідролізом (при температурі 80-90 °С и тиску 3,5 Мпа): CH2=CH2 + H2SO4 → CH3-CH2-OSO2OH (этилсерна кислота). CH3-CH2-OSO2OH + H2O → C2H5OH + H2SO4. Паливо Этанол може використовуватися як паливо, у т.ч. для ракетних двигунів, двигунів внутрішнього згоряння в чистому виді. Обмежене в силу своєї гигроскопичності (відшаровується) використовується в суміші із класичними нафтовими рідкими паливами. Застосовується для вироблення високоякісного палива й компонента бензинів - Этил-Тре- Бутилового ефіру. Хімічна промисловість Служить сировиною для одержання багатьох хімічних речовин, таких, як ацетальдегід, діетиловий ефір, тетраэтилсвинец, оцтова кислота, хлороформ, етилацетат, этилен і ін.; Широко застосовується як розчинник (у лакофарбовій промисловості, у виробництві товарів побутової хімії й багатьох інших областях); Медицина · У медицині етиловий спирт у першу чергу використовується як розчинник, экстрагент і антисептик. · по своїй дії етиловий спирт можна віднести до антисептиків; · як знезаражуючий засіб, що й підсушує, зовнішньо; · дубильні властивості, що підсушують і, 96%-го етилового спирту використовуються для обробки операційного поля або в деяких методиках обробки рук хірурга; · розчинник для лікарських засобів, для готування настойок, екстрактів з рослинної сировини й ін.; · консервант настойок і екстрактів (мінімальна концентрація 18 %); · піногасник при подачі кисню, штучної вентиляції легенів; · у зігрівальних компресах; · для фізичного охолодження при лихоманці (для розтирання); · можливе застосування як компонента парентерального харчування (у вигляді 5 % розчину) в ослаблених хворих з обліком високої енергетичної цінності речовини · компонент загальної анестезії в ситуації дефіциту медикаментозних засобів · Як піногасник при набряку легенів у вигляді інгаляції 33 % розчину. · Этанол є протиотрутою при отруєнні деякими токсичними спиртами, такими як метанол і этиленгликоль. Його дія обумовлена тим, що фермент алкогольдегидрогеназа, при наявності декількох субстратів (наприклад, метанол і этанол) здійснює лише конкурентне окиснення, завдяки чому після своєчасного (майже негайного, слідом за метанолом/этиленгликолем) приймання этанола зменшується поточна концентрація токсичних метаболітів (для метанолу - формальдегіду й мурашиної кислоти, для этиленгликоля - щавлевої кислоти). · Парфумерія й косметика Є універсальним розчинником різних речовин і основним компонентом парфумів, одеколонів, аерозолів і т.п. Входить до складу різноманітних засобів, включаючи навіть такі як зубні пасти, шампуні, засоби для душу, і т.д.. Харчова промисловість Поряд з водою, є необхідним компонентом спиртних напоїв (горілка, скроні, джин і ін.). Також у невеликих кількостях утримується в ряді напоїв, одержуваних шумуванням, але, що не зараховуються до алкогольних (кефір, квас, кумис, безалкогольне пиво й ін.). Зміст этанола у свіжому кефірі мізерно (0,12 %), але в, що довго стояв, особливо в теплому місці, може досягтися 1 %. У кумисі втримується 1-3 % этанола (у міцному до 4,5 %), у квасі - від 0,6 до 2,2 %. ВИСНОВКИ Серед алкалоїдів ми знаходимо і найсильніші отрути (стрихнін, бруцин, нікотин), і корисні ліки (пілокарпін – засіб для лікування глаукоми, астропін – засіб для розширення зіниці, хінін – препарат для лікування малярії, папаверин – судинорозширювальний засіб, що допомагає при гіпертонії). До алкалоїдів відносяться і широко застосовувані збудливі речовини – кофеїн, теобромін, теофілін. Цікаво, що деякі алкалоїди є протиотрутами відносно своїх родичів. Так, у 1952 р. з однієї індійської рослини був виділений алкалоїд резерпін, що дозволяє лікувати не тільки людей що отруїлися ЛСД або іншими галюциногенами, але і хворих, що страждають шизофренією. Таким чином, можна сказати, що алкалоїди – досить великий клас органічних сполук, що чинять різноманітну дію на організм людини. У цьому полягає їхня важлива роль, яку грають алкалоїди в хімічній науці в цілому й у повсякденному житті зокрема. Індивідуальна робота
на тему: "Біотехнологія етанолу "
Виконали: Студент ІV курсу Групи 4118-1Б Карпенко Ю.В.
Запоріжжя ЗМІСТ ВСТУП.. 3 ІСТОРІЯ ВІДКРИТТЯ.. 4 ЗАГАЛЬНА ХАРАКТЕРИСТИКА.. 5 КЛАСИФІКАЦІЯ.. 5 РОЗПОВСЮДЖЕННЯ.. 6 ФІЗИКО-ХІМІЧНІ ВЛАСТИВОСТІ. 7 МЕТОДИ ВИЯВЛЕННЯ, ВИДІЛЕННЯ І АНАЛІЗУ ЕТАНОЛУ.. 10 СТАНДАРТИЗАЦІЯ ВИДІЛЕНОЇ РЕЧОВИНИ.. 23 БІОСИНТЕЗ. 24 БІОЛОГІЧНА ТА ФАРМАКОЛОГІЧНА РОЛЬ. 25 ВИСНОВКИ.. 27 СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ.. 29
ВСТУП Кожний з нас чув слово «спирт» і в принципі знає, що воно означає. А ось хімічне трактування спиртів: «Спирти це органічні сполуки, в молекулах яких міститься одна або декілька гідроксильних груп, сполучених з вуглеводневим радикалом». Назви спиртів походять від назв радикалів, а також з назв вуглеводів додаванням закінчення -ол (метанол, етанол, пропанол, бутанол і т.д.) Нижчі спирти рідини, вищі з числом вуглецевих атомів більше 12 - тверді речовини. Всі спирти легше за воду. Найбільш відомі і що часто застосовуються на практиці з граничних одноатомних спиртів - це метанол і етанол. Археологічні розкопки свідчать, що в епоху стародавніх цивілізацій уміли виготовляти вино і пиво. Схоже, що алкоголь був першою речовиною, синтезованою людиною. Перша літературна згадка про власне етиловий спирт, як «горючу воду», отриману перегонкою вина, відноситься до VIII в. А елементний склад етанолу був визначений на початку XIX в. ІСТОРІЯ ВІДКРИТТЯ Етиловий спирт, вірніше рослинний хмільний напій, що його містить, був відомий людству з глибокої давнини. Вважається, що не менш ніж за 8000 років до нашої ери люди виготовляли легкі спиртні напої з фруктів і меду. Вперше спирт з вина отримали в 6-7 століттях арабські хіміки, а першу пляшку міцного алкоголю (прообразу сучасної горілки) виготовив перський алхімік Ар-Рази в 860 році. У Європі етиловий спирт був отриманий із продуктів бродіння в 11-12 столітті, в Італії. До Росії спирт вперше потрапив у 1386 році, коли генуезьке посольство привезло його з собою під назвою «аква віта» і презентувала царського двору. У 1660 році англійський хімік і богослов Роберт Бойль вперше отримав зневоднений етиловий спирт, а також відкрив його деякі фізичні і хімічні властивості, зокрема виявивши здатність етанолу бути високотемпературним пальним для пальників. Абсолютний (безводний) етиловий спирт був отриманий у 1796 році російським хіміком Т.Є. Ловіцем. У 1842 році німецький хімік Я.Г. Шіль відкрив, що спирти утворюють Гомологічний ряд, відрізняючись на деяку постійну величину. Щоправда, він помилився, описавши її як C2H2. Через два роки, інший хімік Шарль Жерар встановив вірне гомологічної співвідношення CH2 і передбачив формулу і властивості невідомого в ті роки пропілового спирту. У 1850 році англійський хімік Олександр Вільямсон, досліджуючи реакцію алкоголятів з етил йодидом, встановив, що етиловий спирт є похідним від води з одним зміщенням воднем, експериментально підтвердив формулу C2H5OH. Вперше синтез етанолу дією сірчаної кислоти на етилен здійснив у 1854 році французький хімік Марселен Бертло. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
Діючий компонент алкогольних напоїв, що є психоактивным речовиною, що й впливає як депресант на центральну нервову систему людини. | ||||||||||||||||||||||||
|
| Поделиться: |

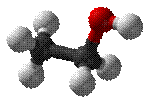 Этано́л (эти́ловый спирт, метилкарбино́л, ви́нный спирт, часто в просторіччі просто "спирт" або алкого́ль) - емпірична формула C2H6O, інші варіанти: C2H5OH або CH3-CH2-OH, другий представник гомологічного ряду одноатомних спиртів.
Этано́л (эти́ловый спирт, метилкарбино́л, ви́нный спирт, часто в просторіччі просто "спирт" або алкого́ль) - емпірична формула C2H6O, інші варіанти: C2H5OH або CH3-CH2-OH, другий представник гомологічного ряду одноатомних спиртів. Назви этанол і етиловий спирт указують на те що дане з'єднання містить у своїй основі этил - радикал этана. При цьому слово спирт (суфікс -ол) у назві вказує на зміст гідроксильної групи (-OH), характерної для спиртів.
Назви этанол і етиловий спирт указують на те що дане з'єднання містить у своїй основі этил - радикал этана. При цьому слово спирт (суфікс -ол) у назві вказує на зміст гідроксильної групи (-OH), характерної для спиртів.


