Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Низкомолекулярные (олигопептиды) пептиды содержат не более 10 ⇐ ПредыдущаяСтр 3 из 3
Аминокислотных остатков. Полипептиды: в их составе от 10 до 100 аминокислотных остатка.
СТРОЕНИЕ ПЕПТИДНОЙ СВЯЗИ
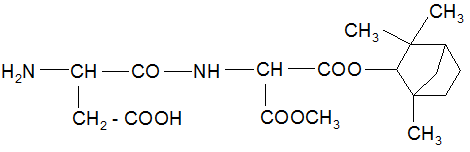
Длина связи С – N = 0,132 нм Плоское строение, транс-конфигурация СВОЙСТВА Олигопептиды – кристаллические вещества, разлагаются при нагревании до 200 – 3000С. Хорошо растворимы в воде, разбавленных Кислотах и щелочах, не растворяются в Органических растворителях. Олигопептиды – амфолиты:
Основное свойство олигопептидов – способность к гидролизу – Полному или частичному расщеплению пептидной связи. Гидролиз может быть кислотным, щелочным, ферментативным.
Олигопептиды – эффективные комплексоны. Олигопептиды характеризуются Окислительно-восстановительными свойствами Глутатион GSH (Glu – Cys – Glu):
Качественные реакции: Биуретовая, нингидринная, ксантопротеиновая, сульфгидрильная. Биологические и физиологические функции Пептиды – гормоны (напр, нейропептиды): вазопрессин, инсулин, гастрин, окситоцин. Пептиды – регуляторы иммунитета. Пептиды – яды высокой токсичности. 4. Некоторые пептиды обладают выраженными вкусовыми качествами (представленный дипептид слаще сахара в 33000 раза)
БЕЛКИ - это ВМС с молярной массой от 10 тыс. до десятков миллионов
ПРОСТЫЕ БЕЛКИ (ПРОТЕИНЫ): - альбумины (растворимые); - глобулины (нерастворимы, растворяются в разбавленных Растворах солей). СЛОЖНЫЕ БЕЛКИ (ПРОТЕИДЫ) Классификация в зависимости от небелковой части: - нуклеопротеиды (гидролизуются на белок и нуклеиновую кислоту); - фосфопротеиды (гидролизуются на простой белок и фосфорную кислоту); - гликопротеиды (гидролизуются на простой белок и углевод). В соответствии с формой белки делятся на - глобулярные (глобулы сферической или эллипсоидной Формы): миоглобин, гемоглобин. - фибриллярные (длинные асимметричные волокна – Фибриллы): кератин волос, кожи, ногтей; миозин мышечной Ткани, коллаген сухожилий и костной ткани.
Уровня пространственной организации белковых молекул.
I. Первичная структура белка; Определяется составом и последовательностью Аминокислотных остатков его цепи. Стабильность конформаций обусловлена возникновением дополнительных связей: • ион – ионные взаимодействия; • водородные связи; • гидратация полярных групп; • дисульфидные связи; • ванн-дер-ваальсовы взаимодействия между неполярными заместителями; • гидрофобные взаимодействия. II. Вторичная структура белка
|
|||||
|
Последнее изменение этой страницы: 2017-01-18; просмотров: 207; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.251.37 (0.006 с.) |
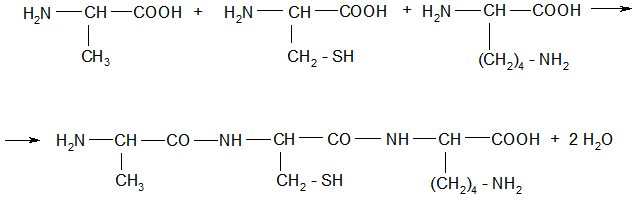 аланилцистеиниллизин Ala – Cys – Lis
аланилцистеиниллизин Ala – Cys – Lis




 2 GSH 2 GS – SG + 2H+ + 2e
2 GSH 2 GS – SG + 2H+ + 2e