
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення цинку (ІІ) у задачі
Задачу отримують у мірну колбу ємністю 100 мл, додають 1 мл 0.1 Н НСl та доводять водою до риски (розчин № 8). В 3 колби ємністю 25 мл вміщують аліквотні частини розчину №8 (10 мл), додають 1 мл розчину ПАР та 10 мл буферного розчину, доводять водою до риски і через 15 хв вимірюють оптичну густину розчину в кюветі з l=2 см проти розчину порівняння (розчин № 1). Концентрацію Zn(II) в розчині № 8 (Сх, моль/л) знаходять за градуювальним графіком. Вміст Zn(II) (в мг) в розчині задачі розраховують за формулою:
де Ar – атомна маса Zn(II), г/моль; Vзаг, Vзад та Vал – об’єми розчину, що фотометрують (25 мл), розчину № 8 (100 мл) та аліквотної частини (10 мл) відповідно. Отримані результати обробляють методами математичної статистики. Лабораторна робота № 20 СПЕКТРОФОТОМЕТРИЧНЕ ВИЗНАЧЕННЯ ФЛУОРИДУ З ВИКОРИСТАННЯМ КОМПЛЕКСУ АЛЮМІНІЮ (III) З АРСЕНАЗО I Для флуориду не характерне утворення забарвлених сполук з іонами металів, цей аніон утворює міцні безбарвні комплексні сполуки. Тому для фотометричного визначення аніонів, зокрема флуориду, часто застосувують конкурентну реакцію руйнування забарвленого комплексу металу з органічним фотометричним реагентом. Алюміній (ІІІ) взаємодіє з арсеназо І при рН розчину 3.4-5.0 з утворенням забарвленого у фіолетовий колір комплексу середньої стійкості:
Флуоридні комплекси Аl(ІІІ) характеризуються високою стійкістю (рК1=7,1; рК2=4,78; рК3=3,85; рК4=2,70; рК5=1,67; рК6=0,47). В присутності флуориду забарвлений комплекс руйнується з утворенням безбарвних флуоридних комплексів Al(ІІІ):
де n=1-3 залежно від вмісту флуориду в розчині. Наприклад, при вмісті флуориду 50 мкг - 5 мг у кінцевому об'ємі 50-70 мл утворюється безбарвний комплекс [AlF2]+. Реагент арсеназо І має розвинену хромофорну систему, а отже, поглинає електромагнітне випромінювання у видимій області спектру. Максимум в спектрі поглинання комплексу зсунутий батохромно порівняно зі спектром реагенту. Руйнування комплексу алюмінію (III) у присутності флуориду супроводжується зміною забарвлення розчину, що дозволяє застосувати дану реакцію для фотометричного визначення флуориду. Межа визначення флуориду становить 0,025 мкг/мл. Визначенню заважають іони, що утворюють стійкі флуоридні комплекси, зокрема: титан (IV), торій (IV), цирконій (IV), ферум (III) тощо, а також аніони, що взаємодіють з алюмінієм (оксалати, фосфати, тартрати, цитрати, тощо).
Максимальна різниця у спектрах поглинання комплексу та реактиву лежить в межах λ=575-580 нм. Прилади, реактиви та посуд 1. Робочий розчин хлориду алюмінію, 4.10-4 моль/л 2. Розчин Арсеназо І, 4.10-4 моль/л 3. Стандартний розчин Флориду, 200 мкг/мл. Перед роботою 2.5 мл стандартного розчину розбавляють водою у мірній колбі ємн. 25 мл. Вміст флуориду у робочому розчині становить 20 мкг/мл 4. Ацететаний буферний розчин, рН 4,5 5. Мірні колбі ємністю 25 мл (10 шт.) 6. Піпетки на 5 мл та 2 мл 7. Кювети з товщиною шару 1 см (2 шт). 8. Спектрофотометр СФ-46 або фотоелектроколориметр КФК 2МП. Хід роботи: Побудова градуювального графіка. В мірні колби ємністю 25 мл вносять (обов’язково дотримуючись порядку зливання реактивів) 4 мл розчину арсеназо І, 3,5 мл робочого розчину Алюмінію, 2 мл ацетатного буферного розчину з рН 4,5 та відповідно 0; 0,2; 0,4; 0,8; 1,2 та 1,5 мл робочого розчину флуориду, розбавляють водою до риски, ретельно перемішують і залишають на 20 хв. Через 20 хв вимірюють оптичну густину розчину при λ=580 нм (або при 590 нм на КФК) у кюветах з товщиною шару 1 см. При використанні у якості розчину порівняння дистильованої води градуювальний графік має вигляд прямої, що спадає. При вимірюванні поглинання розчину №1 серії проти розчинів з різним вмістом Флориду (табл.) градуювальний графік має вигляд висхідної прямої. За отриманими одним із способів даними будують градуювальний графік (ГГ) у координатах „А - СF-, мг/мл”. Визначення вмісту флуориду в учбовій задачі. Задачу отримують у мірну колбу ємністю 25 мл (Vзадачі), доводять до риски водою і ретельно перемішують. В 3 мірні колби ємністю 25 мл вводять по 4,0 мл розчину арсеназо, по 3,5 мл розчину алюмінію, по 2,0 мл ацетатного буферного розчину та по 5,0 мл розчину задачі (Vал). Розчин розбавляють водою до мітки і ретельно перемішують. Через 20 хв вимірюють оптичну густину розчинів як зазначено вище. За градуювальним графіком знаходять концентрацію флуориду у розчині Сх, мг/мл. Вміст флуориду у задачі розраховують за формулою:
де Vзаг - об’єм розчину, який фотометрують (25 мл). Отримані результати обробляють методами математичної статистики.
ТЕМА 12. СПЕКТРОСКОПІЧНІ МЕТОДИ АНАЛІЗУ. ФОТОМЕТРІЯ ПОЛУМ’Я. Лабораторна робота № 21
ВИЗНАЧЕННЯ КАЛІЮ ТА НАТРІЮ У СОКАХ МЕТОДОМ ФОТОМЕТРІЇ ПОЛУМ’Я
Одночасне визначення Натрію та Калію методом фотометрії полум’я ґрунтується на суттєвій різниці спектрів випромінювання цих елементів при їх збудженні у полум’ї газового пальника: довжина хвилі випромінювання атомів натрію становить 589 нм, а калію - 768 нм. Це дозволяє виконувати аналіз суміші вказаних елементів без їх попереднього розділення. Використання методу добавок надає можливості проводити визначення кожного з елементів у розчинах з багатокомпонентним складом. Прилади та реагенти
1. Натрію хлорид, калію хлорид (сухі солі) 2. Стандартні розчини Калію та Натрію готують розчиненням точних наважок їх хлоридів у воді. Препарати відповідних солей зважують на аналітичних терезах у стаканах ємністю 20-50 мл: NaCl – масою ~ 0,13 г, KCl – 0,1 г. Після цього наважки розчиняють у дистильованій воді та переносять у мірні колби ємністю 500 мл, доводять водою до риски та ретельно перемішують. Точну концентрацію стандартних розчинів розраховують за масою взятих наважок. 3. Колби мірні ємністю 100 та 500 мл. 4. Піпетки на 5, 10 та 20 мл. 5. Фотометр полуменевий Хід роботи: Побудова градуювальних графіків. Для побудови градуювального графіка у 5 мірних колб ємністю 100 мл вносять 2; 5; 10; 15; 20 мл стандартного розчину солі натрію, розбавляють водою до мітки та перемішують. Аналогічно готують серію розчинів для визначення Калію. За допомогою перемикача, що розташований на панелі фотометра, встановлюють світлофільтр для певного елемента (K або Na). Стандартні розчини крізь капіляр фотометру подають у полум’я пальника і записують показання гальванометру (у відносних одиницях). Вимірювання здійснюють переходячи від менш концентрованих до більш концентрованих розчинів. При переході до розчинів іншого елементу змінюють світлофільтр та промивають систему, опускаючи капіляр в стакан з дистильованою водою. На основі отриманих даних будують градуювальні графіки в координатах: „Показання гальванометру (відн.од.)– концентрація елементу, мг/л”. Визначення калію та натрію у модельних розчинах. Задачу, одержують у мірну колбу ємн. 100 мл, розбавляють водою до риски та перемішують. Встановлюють світлофільтр на Натрій, опускають капіляр приладу у розчин та записують показання гальванометру. Промивають систему, перемикають світлофільтр на Калій і знову розпилюють розчин у полум’ї пальника. Записують показання гальванометру. Вміст K та Na у задачі знаходять за відповідними градуювальними графіками. Визначення вмісту Калію та Натрію у соках за методом добавок. Для визначення концентрації калію та натрію у соках за методом добавок готують серію розчинів. Для цього у три мірні колби ємністю 100 мл вносять по 5 мл попередньо відфільтрованого соку (без м’якоті), у другу та третю з них додають відповідно 5 та 10 мл стандартного розчину калію хлориду, доводять водою до риски та перемішують. Аналогічно готують серію розчинів для визначення Натрію. Концентрацію K чи Na знаходять методом добавок графічно або за формулою:
де Сх-концентрація елементу, що визначається, Іх та Іх+доб- покази приладу при фотометруванні досліджуваного розчину без та з добавкою стандартного розчину відповідного елементу. Використовуючи знайдене значення Сх та враховуючи всі зроблені розбавлення, розраховують вміст досліджуваного елементу у пробі, мг/л.
Тема 13. аналіз сплаву. Лабораторна робота № 22
ВИЗНАЧЕННЯ КУПРУМУ В СПЛАВІ ЕЛЕКТРОГРАВІМЕТРИЧНИМ МЕТОДОМ
Електроваговий аналіз грунтується на виділенні металу з розчину під дією електричного струму з наступним зважуванням одержаного на електроді осаду. При електролізі розчину солі купруму на платинових електродах відбуваються такі реакції: на катоді:
на аноді:
Напруга виділення становить близько 2 В. Електролітичне осадження Купруму проводять з розчинів, що містять сульфатну і нітратну кислоти. Оскільки нітратна кислота відновлюється легше за водень на платиновому катоді, під час осадження міді відбувається паралельно така реакція:
Дана реакція запобігає утворенню пухкого осаду міді, що має місце під час виділення водню, а також попереджає відновлення більш електронегативних металів (кадмій, цинк) одразу ж після осадження міді. За таких умов на катоді одержують чистий щільний осад металічної міді. На повноту осадження шкідливо впливає присутність у розчині слідів нітритної кислоти, яка окиснює виділений на катоді метал. Для запобігання відновлення нітратної кислоти до нітритної в кінці електролізу до розчину перед початком електролізу додають трохи сухої сечовини.
Прилади, реактиви, посуд 1. Мідний сплав 2. Нітратна кислота (1:1) 3. Сульфатна кислота, конц. 4. Спирт або ацетон 5. Сечовина, суха 6. Хімічні стакани ємн. 200 та 100 мл, фарфорова чашка 7. Піпетки, циліндр мірний, фільтри "синя стрічка", лійка для фільтрування 8. Мірні колби ємн. 100 мл 9. Платинові електроди: сітчастий катод та анод у вигляді спіралі 10. Установка для електролізу, магнітна мішалка 11. Аналітичні терези
Хід роботи: Наважку сплаву 0,2-0,5 г, зважену на аналітичних терезах, вміщують у хімічний стакан, додають 10-15 мл HNO3 (1:1), накривають фарфоровою чашкою та нагрівають на пісчаній бані до повного розкладання сплаву. Чашку знімають і обмивають струменем води, збираючи промивні води в той самий стакан. Розчин кип’ятять до повного видалення оксидів азоту (до об'єму
Осад відфільтровують крізь щільний фільтр у мірну колбу ємн. 100 мл і ретельно промивають 8-10 разів гарячею HNO3 (1: 1). Об'єм фільтрату у колбі доводять до мітки дистильованою водою і перемішують. Мірною піпеткою відбирають 50 мл фільтрату і переносять у стакан на 100 мл, додають 3-5 крапель H2SO4 (конц.), 1-2 г сечовини. Занурюють у розчин попередньо зважений на аналітичних терезах катод та анод, ставлять стакан на магнітну мішалку і проводять електроліз при силі струму 2,0- 2,5 А і напрузі 2,5-3,0 В при інтенсивному перемішуванні. Через 10 хв після зникнення блакитного забарвлення розчину, до нього додають трохи води і спостерігають, чи не відбуватиметься виділення міді на поверхні катоду, свіжо покритого шаром води. Якщо через 3-5 хв платина більше не покривається осадом міді, електроліз припиняють. Для цього катод виймають з розчину, не вимикаючи струму, промивають водою з промивали над стаканом і негайно занурюють послідовно у два інші стакани з дистильованою водою. Струм вимикають, катод промивають спиртом і висушують у сушильній шафі впродовж 5-10 хв при 105- 110о С. Охолоджують в ексикаторі та зважують на аналітичних терезах. Закінчивши аналіз, катод занурюють у стакан з розбавленою азотною кислотою. Після повного розчинення купруму електрод промивають водою і висушують. За одержаними даними розраховують процентний вмість міді у сплаві. При цьому враховують, що електролізу піддавали лише половину розчину сплаву.
|
||||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 382; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.94.251 (0.019 с.) |
 ,
,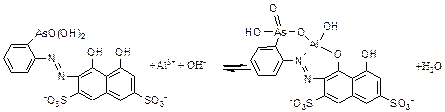
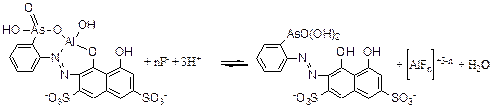 ,
,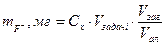 ,
,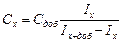

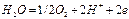 .
. 
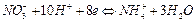 .
. 10-15 мл), розбавляють гарячею водою до 30- 50 мл і залишають стояти доки олов' яна кислота (якщо вона утворилась), повністю не зкоагулює на дні.
10-15 мл), розбавляють гарячею водою до 30- 50 мл і залишають стояти доки олов' яна кислота (якщо вона утворилась), повністю не зкоагулює на дні.


