
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення нікелю(ІІ) з диметилгліоксимом
Визначення грунтується на осадженні нікелю(ІІ) диметилгліоксимом в присутності амоніаку з утворенням яскраво-червоного диметилгліоксимату нікелю, який практично не розчиняється у надлишку диметилгліоксиму, розведених розчинах амоніаку та солях амонію:
Осад помітно розчиняється у мінеральних кислотах, концентрованих лугах, розчинах ціанідів, етанолі, гарячій воді. Гравіметричною формою є диметилгліоксимат нікелю Ni(C4H7N2O2)2. Елементи, здатні за умов осадження нікелю(ІІ) утворювати гідроксиди, необхідно попередньо маскувати.
Прилади, реактиви, посуд 1. Диметилгліоксим, 1%-ний аміачний розчин 2. Стакан скляний, ємністю 100 (150) мл 3. Паличка скляна 4. Циліндр мірний, ємністю 25 мл 5. Фільтр скляний, № 3 або 4 6. Колба Бунзена, ємністю 1 л 7. Компресорна установка УК 40-2М 8. Сушильна шафа Хід роботи:
Осадження. До розчину задачі у скляному стакані ємністю 100–150 мл додають приблизно 50 мл гарячої дистильованої води і нагрівають на піщаній бані до 80–90 °С. До нагрітого розчину додають 25 мл аміачного розчину диметилгліоксиму і перемішують. При цьому повинен відчуватися запах амоніаку. Нагрівають вміст стакану, перемішуючи скляною паличкою, до початку кипіння і залишають на 1 год у витяжній шафі. Після цього перевіряють повноту осадження Нікелю, додаючи до розчину кілька краплин диметилгліоксиму. Фільтрування і висушування. Осад фільтрують під вакуумом крізь заздалегідь висушений і зважений скляний фільтр, ретельно змиваючи його залишки зі стінок та дна стакану гарячою дистильованою водою з промивалки. Промивають осад на фільтрі 2 рази гарячою дистильованою водою. Скляний фільтр з осадом висушують у сушильній шафі впродовж 30–35 хв при 100–120 °С до постійної маси і зважують. Вміст нікелю (в г) розраховують за формулою:
де g – маса гравіметричної форми Ni(C4H7N2O2)2, г; FNi – гравіметричний фактор (FNi = 0,2032).
Тема 2. Титриметричні методи аналізу. Метод Нейтралізації
Лабораторна робота № 4
Визначення хлороводневої та фосфорної кислот у суміші методом кислотно-основного титрування
Роздільне визначення соляної та фосфорної кислот у суміші титруванням стандартним розчином гідроксиду натрію можливе внаслідок проходження реакції між титрантом та компонентами суміші, що аналізується у дві стадії. На першій стадії одночасно титруються хлороводнева кислота за рівнянням (1) та фосфорна кислота до однозаміщеної солі за рівнянням (2):
Друга стадія взаємодії обумовлена реакцією:
Для титрування хлороводневої кислоти та фосфорної до дигідрофосфату використовують індикатор метиловий червоний або бромкрезоловий зелений. Для титрування хлороводневої кислоти та фосфорної до гідрофосфату використовують фенолфталеїн. Прилади, реактиви, посуд 1. Натрію гідроксид, 0.1 н. 2. Мірна колба на 100 мл. 3. Розчини бромкрезолового зеленого (у 20% етанолі) та метилового червоного (у 60% етанолі). 4. Розчин фенолфталеїну. 5. Конічні колби для титрування ємністю 250 мл. 6.Піпетки ємністю 20 (25) мл. 7. Бюретка. Хід роботи: Учбову задачу отримують в мірній колбі на 100 мл та розбавляють дистильованою водою до мітки.В конічну колбу для титрування відбирають аліквоту розчину задачі, додають 2-3 краплини індикатора бромкрезолового зеленого або метилового червоного і титрують розчином лугу до зміни забарвлення індикатора: від жовтого до синього (у першому випадку) або від червоного до оранжевого (у другому випадку). Записують об’єм гідроксиду натрію (V1, мл), що пішов на титрування суміші по першій стадії. В конічну колбу для титрування відбирають аліквоту розчину задачі, додають 2-3 краплини фенолфталеїну і титрують розчином лугу до зміни забарвлення індикатора (від безбарвного до червоно-фіолетового). Записують об’єм гідроксиду натрію (V2, мл), що пішов на титрування. Вміст кислот у суміші розраховують за формулами:
де Vзаг - загальний об’єм розчину, 100 мл Vал - об’єм аликвотної частини розчину.
Тема 3. Титриметричні методи аналізу. Перманганатометрія Лабораторна робота № 5 ПРИГОТУВАННЯ ВИХІДНОГО РОЗЧИНУ оксалатної КИСЛОТИ ТА ВСТАНОВЛЕННЯ НОРМАЛЬНОСТІ РОБОЧОГО РОЗЧИНУ ПЕРМАНГАНАТУ КАЛІЮ
При титруванні розчину оксалатної кислоти перманганатом калію у кислому середовищі відбувається реакція:
Окиснення
Отже, молярна маса еквіваленту оксалатної кислоти у цій реакції дорівнює ½ М.м.
Прилади, реактиви, посуд 1. 2. Калію перманганат, 0,1 Н розчин 3. Сульфатна кислота (1:4) 4. Мірні колби ємн. 100 і 250 мл. 5. Конічні колби для титрування ємн. 250 мл 6. Піпетки ємн. 20 або 25 мл 7. Бюретка 8. Бюкс ємн.20 мл 9. Воронка 10. Терези аналітичні Хід роботи: Для приготування 250 мл 0,1 Н розчину Н2С2О4 наважку оксалатної кислоти, розраховану за наведеною нижче формулою, зважують у бюксі на аналітичних терезах з точністю до 0,0001 г, кількісно переносять у мірну колбу ємн. 250 мл, промиваючи бюкс і воронку дистильованою водою, доводять водою до мітки і перемішують.
Бюретку наповнюють розчином перманганату калію, контролюючі рівень розчину за верхнім меніском. У конічну колбу піпеткою вводять 10 мл розчину оксалатної кислоти, додають 10-15 мл розчину сульфатної кислоти (для створення необхідної кислотності середовища) і нагрівають до температури 70-80 °С (до кипіння не доводити, оскільки оксалатна кислота розкладається). Нагрівання розчину можна замінити додаванням нагрітої до температури 80-90°С води. До гарячого розчину кислоти з бюретки додають кілька краплин перманганату калію і чекають, поки зникне рожеве забарвлення. Наступні порції перманганату знебарвлюються швидше, оскільки Mn(II), що утворюється, є каталізатором у цій реакції. Кожну нову порцію розчину перманганату додають лише після зникнення забарвлення попередньої порції. Розчин титрують до появи слабкорожевого забарвлення, яке не зникає впродовж 30 с. Нормальність розчину перманганату розраховують за формулою: де N(KMnO4) – нормальність робочого розчину перманганату; V(KMnO4) – об’єм витрачено на титрування робочого розчину, мл;
Лабораторна робота № 6 ПЕРМАНГАНАТОМЕТРИЧНЕ ВИЗНАЧЕННЯ ПЕРОКСИДУ ВОДНЮ
В основі визначення лежить реакція між пероксидом водню та перманганатом калію у кислому середовищі:
Прилади, реактиви, посуд 1. Калію перманганат, 0.1 Н розчин 2. Сульфатна кислота (1:4) 3. Мірна колба ємн. 100 мл 4. Конічні колби для титрування ємн. 250 мл 5. Піпетки ємн. 20 або 25 мл 6. Бюретка
Хід роботи:
Розчин задачі в мірній колбі ємністю 100 мл розбавляють дистильованою водою до мітки і перемішують. Відбирають піпеткою 20(25) мл цього розчину, переносять у колбу для титрування, додають 10-15 мл сульфатної кислоти і титрують робочим розчином перманганату (без нагрівання) до появи рожевого забарвлення,яке не зникає впродовж 30 с. Вміст пероксиду (г) у розчині розраховують за формулою:
де N(KMnO4) – нормальність робочого розчину перманганату; V(KMnO4) – об’єм робочого розчину, що витрачено на титрування, мл; Е(Н2О2) – молярна маса еквіваленту пероксиду водню, г; Vзадачі – об’єм розчину задачі, мл; Vа - об’єм розчину задачі, взятий для титрування (аліквотна частина), мл.
Лабораторна робота № 7 ПЕРМАНГАНАТОМЕТРИЧНЕ ВИЗНАЧЕННЯ ФЕРУМУ (II) У СОЛІ МОРА
Метод ґрунтується на взаємодії солей феруму (ІІ) у кислому середовищі з розчином перманганату калію:
Прилади, реактиви, посуд 1. Перманганат калію, 0.1 Н 2. Сіль Мора ((NH4)2SO4 · FeSO4 · 6 H2O) 3. Сульфатна кислота, (1: 4) 4. Захисна суміш: розчиняють 70 г солі MnSO4 · 4 H2O у 500 мл води, добавляють до розчину 125 мл концентрованої сульфатної кислоти і 125 мл 85%-ної фосфорної кислоти і розчин розводять до об’єму 1,000 л 5. Мірні колби ємн. 100 і 250 мл 6. Конічні колби для титрування ємн. 250 мл 7. Піпетки ємн. 20 або 25 мл 8. Бюретка Хід роботи: Наважку солі Мора, необхідну для приготування 100 мл 0,05 Н розчину, зважують на аналітичних терезах у бюксі і кількісно переносять у мірну колбу ємн.100 мл. В колбу додають 10 мл дистильованої води, 10 мл сульфатної кислоти (для запобігання гідролізу) і розчиняють сіль. Після того як сіль повністю розчинилася розчин доводять дистильованою водою до мітки. В конічну колбу для титрування вводять 20- 25 мл розчину солі Мора, додають 10-15 мл захисної суміші й розбавляють у 2-3 рази холодною водою. Холодний розчин, ретельно перемішуючи, поволі титрують робочим розчином перманганату до появи рожевого забарвлення, яке не зникає впродовж 1 хв. Процентний вміст феруму (II) у солі обчислюють за формулою:
де N(KMnO4) – нормальність робочого розчину перманганату; V(KMnO4) – об’єм робочого розчину, що витрачено на титрування; Е(Fe) – молярна маса еквіваленту феруму, г; g – наважка солі, г. Vзадачі – об’єм розчину задачі, мл; Vа - об’єм розчину задачі, взятий для титрування (аліквотна частина),мл.
Одержаний результат процентного вмісту феруму(II) в солі Мора порівнюють з теоретично розрахованим.
Тема 4. Титриметричні методи аналізу. Йодиметрія та йодометрія Лабораторна робота № 8 ЙОДОМЕТРИЧНЕ ВИЗНАЧЕННЯ КУПРУМУ (II) Йодиметрія – метод визначення відновників (Red) титруванням стандартним розчином йоду. В основі методу лежить реакція відновлення:
Формально вважається, що окисником є молекулярний йод. Однак Йодометрія – метод визначення окисників (Ох) непрямим титруванням замісника - Однак розчини калію йодиду не використовують в якості титранта, оскільки він нестійкий і окиснюється киснем повітря. На практиці до аналізованого розчину окисника додають надлишок КІ. Йод, що виділяється у кількості, еквівалентній кількості Ох, що вступив у реакцію, відтитровують розчином
Робочим розчином є розчин натрію тіосульфату. Сполука
Одна молекула
При цьому два іони тіосульфату взаємодіють з двома атомами йоду. Отже, молярна маса еквіваленту Йодометричне визначення купруму (ІІ) базується на реакцї:
Йод, що виділився в еквівалентній до Купруму кількості, титрують стандартним розчином тіосульфату за схемою (1). Як індикатор у йодометрії застосовують свіже приготований 1%-ний розчин крохмалю. При взаємодії крохмалю з йодом утворюється сполука синього кольору. Прилади, реактиви, посуд 1. Дихромат калію, 2. Сульфатна кислота, (1:4) 3. Калію йодид, 10 %-ний розчин 4. Крохмаль, свіже приготовлений 1%-ний розчин 5. Тіосульфат натрію, ~0,05 Н розчин 6. Ацетатна кислота, 2.Н 7. Бюретка 8. Колби мірні ємн. 100 та 250 мл 9. Піпетки ємн. 20 (25)мл 10. Мірні циліндри ємн. 10, 50 мл 11. Конічні колби ємн. 250 мл Хід роботи: Приготування стандартного розчину калію дихромату. Наважку солі калію дихромату, необхідну для приготування 250 мл ~0,05 Н розчину, зважують у бюксі на аналітичних терезах з точністю до 0,0001 г. Кількісно переносять до мірної колби ємн. 250 мл, промиваючи бюкс і воронку 2-3 рази дистильованою водою, доводять водою до мітки і ретельно перемішують. За наважкою розраховують нормальність (з точністю до 0,0001) розчину дихромату. Стандартизація робочого розчину натрію тіосульфату. Бюретку заповнюють розчином натрію тіосульфату. В конічну колбу для титрування мірним циліндром наливають 15-20 мл калію йодиду та 15-20 мл розчину H2SO4. Якщо отриманий розчин набуває жовтуватого відтінку, то додають краплинами з бюретки розчин натрію тіосульфату до знебарвлення розчину. До одержаної суміші піпеткою доливають 10 мл стандартного розчину калію біхромату і, накривши колбу годинниковим склом (щоб запобігти втратам йоду через леткість), залишають суміш на 5 хв у темному місці для завершення реакції. В колбу додають дистильовану воду до об’єму 100-150 мл і отриманий розчин титрують натрію тіосульфатом, не додаючи індикатора. Коли забарвлення розчину зміниться з темно-коричневого на світло-жовте, додають приблизно 5 мл розчину крохмалю і продовжують титрувати до переходу темно-синього забарвлення у світло-зелене. Нормальність розчину
де
Йодометричне визначення купруму(ІІ). До розчину задачі в мірній колбі ємн. 100 мл додають 5 мл розчину ацетатної кислоти (для попередження гідролізу Cu(ІІ)), доводять водою до мітки і перемішують. В конічну колбу відбирають піпеткою 20 (25) мл цього розчину, циліндром додають 10-15 мл розчину КІ, добре перемішують. Накривають колбу годинниковим склом і залишають суміш на 2-З хв у темному місці для завершення реакції (2). Титрують йод, який виділився, робочим розчином Кількість Купруму (
де
Тема 5. Титриметричні методи аналізу. Метод ОСАДЖЕННЯ
Лабораторна робота № 9
ВСТАНОВЛЕННЯ НОРМАЛЬНОСТІ РОБОЧОГО РОЗЧИНУ НІТРАТУ АРГЕНТУМУ ЗА МЕТОДОМ МОРА
Встановлення нормальності робочого розчину нітрату аргентуму за методом Мора ґрунтується на реакції:
Для цього використовують розчин натрію хлориду, який готують за наважкою відповідної солі. Молярна маса еквіваленту аргентуму нітрату дорівнює його молекулярній масі. Як індикатор застосовують хромат калію K2CrO4, який в точці еквівалентності утворює з надлишком іонів арґентуму цегляно-червоний осад Ag2CrO4. Арґентуму хромат, як сіль слабкої кислоти, розчиняється у кислотах, тому визначення слід проводити у нейтральних розчинах.
Прилади, реактиви, посуд 1. Натрію хлорид, кристалічний; 2. Розчин арґентуму нітрату, приблизно 0,05 Н; 3. Розчин калію хромату, 5%-ний водний; 4. Мірні колби ємністю 100, 250 мл; 5. Конічні колби ємністю 250 мл; 6. Бюретка, піпетки.
Хід роботи Приготування робочого розчину натрію хлориду. Наважку солі, необхідну для приготування 250 мл 0,05 Н розчину NaCl, зважують у бюксі на аналітичних терезах з точністю до 0,0001 г, кількісно переносять у мірну колбу ємн. 250 мл, промиваючи бюкс і воронку дистильованою водою, доводять водою до мітки і перемішують. Встановлення нормальності робочого розчину нітрату аргентуму. В конічну колбу для титрування піпеткою приливають 10 мл розчину NaCl, додають ≈2 мл розчину індикатора, розбавляють дистильованою водою приблизно до 20 мл і титрують розчином арґентуму нітрату. Розчин інтенсивно перемішують після додавання кожної порції титранту. Незадовго до досягнення точки еквівалентності осад AgCl коагулює, а розчин над осадом стає прозорим. Після цього робочий розчин додають краплинами до зміни забарвлення суміші з жовтого на цеглисто-червоне внаслідок утворення осаду арґентуму хромату. Титрування повторюють 2-3 рази. Розходження між паралельними результатами титрування не повинно перевищувати 0,05 мл. Кількість арґентуму нітрату, що витрачається на взаємодію з калію хроматом визначають, титруючи розчин, приготовлений аналогічно, але без додавання розчину NaCl. Розраховують середній об’єм арґентуму нітрату, що було витрачено на титрування NaCl. Нормальність робочого розчину арґентуму нітрату розраховують за формулою:
де
Лабораторна робота № 10 ТИТРИМЕТРИЧНЕ ВИЗНАЧЕННЯ ХЛОРИД-ІОНІВ У МОРСЬКІЙ ВОДІ ЗА МЕТОДОМ ФОЛЬГАРДА
До кислого розчину, що містить хлорид-іони, додають надлишок титрованого розчину аргентуму нітрату. При цьому відбувається реакція:
Іони аргентуму, які не прореагували з хлоридом, відтитровують розчином амонію тіоціанату з індикатором – сіллю феруму(ІІІ). При цьому відбуваються такі реакції: До точки еквівалентності: Після точки еквівалентності:
Прилади, реактиви, посуд 1. Розчин AgNO3, 0,05 М. Нормальність робочого розчину встановлюють методом Мора (титруванням розчину хлориду натрію з індикатором калію хроматом). 2. Розчин NH4SCN, 0,05 М. Нормальність робочого розчину встановлюють за попередньо відтитрованим розчином AgNO3. Як індикатор використовують насичений розчин ферум-амонієвого галуну 3. Натрію хлорид, кристалічний. 4. Розчин калію хромату, 5%-ний. 5. Насичений розчин ферум-амонієвого галуну. 6. CCl4. 7. Мірні колби ємністю 100, 250 мл. 8. Конічні колби ємністю 250 мл. 9. Бюретки, піпетки.
Хід роботи: Наважку морської солі 0,1-0,2 г, зваженої на аналітичних терезах, переносять у мірну колбу ємністю 100 мл, розчиняють і доводять дистильованою водою до мітки. Після цього, аліквотну частину отриманого розчину (10 мл) вносять у конічну колбу, додають 10 мл 6 М нітратної кислоти, 10 мл 0,05 н розчину AgNO3, 2 мл CCl4, 1-2 мл насиченого розчину ферум-амонієвого галуну і титрують розчином NH4SCN. В кінці титрування осад AgSCN коагулює і каламутний розчин над осадом стає прозорим. Титрують до появи не зникаючого при енергійному збовтуванні впродовж 1 хв червоно-рожевого забарвлення розчину (комплексу феруму з тіоціанатом - FeSCN2+). Процентний вміст хлорид-іонів у морській солі розраховують за формулою:
де
g – маса наважки, г.
Тема 6. Титриметричні методи аналізу. Метод КОМПлЕКСОНОМЕТРІЇ Лабораторна робота № 11
ВИЗНАЧЕННЯ ЗАГАЛЬНОЇ ТВЕРДОСТІ ВОДИ МЕТОДОМ КОМПЛЕКСОНОМЕТРИЧНОГО ТИТРУВАННЯ Загальна твердість води обумовлена сумарним вмістом солей кальцію та магнію, який визначають трилонометрично. Метод ґрунтується на титруванні проби води розчином двозаміщеної натрієвої солі етилендиамінтетраоцтової кислоти (трилон Б) у лужному середовищі при рН»10 з металохромним індикатором - еріохромчорним Т (рис.1). Трилон Б утворює з іонами кальцію та магнію у лужному середовищі безбарвні комплексні сполуки (рис.2):
Рис.1 Рис.2 Індикатор ЕХЧ утворює з іонами кальцію та магнію комплексні сполуки червоно-фіолетового кольору, які при додаванні розчину трилону Б руйнуються внаслідок утворення більш стійких безбарвних комплексонатів. Комплексонат кальцію стійкіший порівняно з комплексом магнію, тому при титруванні зв’язується першим, а магній - другим. В точці еквівалентності відбувається перехід забарвлення від червоно-фіолетового (колір комплексів металів з ЕХЧ) до блакитного (колір аніонної форми незв’язаного індикатора).
Прилади, реактиви, посуд 1. Розчин трилону Б, 0,1 н приготовлений за наважкою препарату. 2. Еріохромчорний Т (0,5 г індикатора розтирають у фарфоровій ступці з 50 г натрію хлориду). 3. Аміачний буферний розчин з рН»10 (20 г амонію хлориду розчиняють у воді, додають 100 мл концентрованого амоніаку і доводять об’єм суміші до 1 л) 4. Конічні колби ємністю 250 мл. 5. Бюретки, піпетки.
Хід роботи: В конічну колбу ємністю 250 мл відбирають піпеткою 10-100 мл води залежно від очікуваного значення її твердості, розбавляють при необхідності до 100 мл дистильованою водою, додають 5 мл аміачного буферного розчину, 10-15 мг сухого індикатора, збовтують і титрують розчином трилону Б при інтенсивному перемішуванні до переходу червоно-фіолетового забарвлення до блакитного. Загальну твердість води, ммоль-екв/л (Сх), визначають за формулою:
де C і V1 - відповідно концентрація робочого розчину трилону Б (моль-екв/л) та його об’єм, витрачений на титрування, мл; V- об’єм проби води, мл.
Тема 7. ЕЛЕКТРОХІМІЧНІ МЕТОДИ АНАЛІЗУ. ПОТЕНЦІОМЕТРІЯ.
Лабораторна робота № 12
ВИЗНАЧЕННЯ СЛАБКОЇ КИСЛОТИ МЕТОДОМ рН-МЕТРИЧНОГО ТИТРУВАННЯ
Мета роботи: визначити концентрацію розчину оцтової кислоти із застосуванням скляного електроду, порівняти результати потенціометричного і індикаторного методу встановлення кінцевої точки титрування, визначити рКа оцтової кислоти.
Прилади та реактиви 1. Стандартний розчин NaOH, 0,1 М. 2. Розчин фенолфталеїну. 3. Мірна колба, ємністю 100.0 мл; піпетка ємністю 25.0 мл. 4. Стакан для титрування, ємністю 50 мл; бюретка. 5. рН-метр рН-340 із скляним індикаторним ектродом та хлорид-срібним електродом порівняння. 6. Магнітна мішалка. Хід роботи: Учбову задачу одержують у мірну колбу ємністю 100 мл та розбавляють дистильованою водою до мітки. Аліквотну частину розчину (25 мл) вміщують в рН-метричний стакан, додають 2 краплини фенолфталеїну. На дно стакана опускають магніт і у розчин занурюють електроди так, щоб вони не торкалися магніту, включають магнітну мішалку на перемішування із середньою швидкістю. На рН-метрі вибирають род робіт „рН”, перемикач „Размах” встановлюють у положення „15рН”, вимірюють приблизне значення рН розчину. Залежно від значення рН за допомогою перемикача „Пределы измерения” обирають необхідний діапазон рН, далі перемикач „Размах” переключають у положення „3рН” і знімають точне значення рН розчину. Додають порціями робочий розчин NaOH (V, мл)та записують значення рН після встановлення рівноваги (змінюючи перемикачем „Пределы измерения” діапазон вимірювання). Робочий розчин у діапазоні рН 5,5 – 5,8 додають по 0,5 мл; а поблизу точки еквівалентності - по 0,2 мл. Записують значення рН та об`єм робочого розчину, при якому розчин забарвлюється у рожевий колір. Після досягнення рН 10,5 – 10,8 титрування продовжують порціями по 0,5 мл. Записують ще 5-6 результатів. Виключають мішалку, перемикач рН-метру „Размах” встановлюють у положення „15рН”, виймають електроди з досліджуваного розчину, промивають їх дистильованою водою, та занурюють у стакан з дистильованою водою. За отриманими даними будують криву титрування у координатах: ΔpH/ΔV – V та визначають об`єм, при якому спостерігається максимум на кривій - точку еквівалентності (Vт.е .). Розраховують вміст кислоти в розчині задачі за формулою:
де NNaOH – концентрація стандартного розчину титранта, моль - екв/л; Vт.е. – об`єм титранту в точці еквівалентності, мл; E – молярна маса еквівалента оцтової кислоти, г/моль-екв; Vзаг та Vал загальний об`єм учбової задачі та об`єм її аліквотної частини, мл. Усереднюють результати паралельних дослідів, порівнюють результати, отримані при візуальному та потенціометричному способі індикації точки еквівалентності. Розраховують помилку визначення оцтової кислоти. За даними, отриманими у діапазоні 0.2. Vт.е . – 0.8 .Vт.е., розраховують значення рКа кислоти. За цих умов утворюється буферний розчин (суміш слабкої кислоти та її солі), рН якого визначається за рівнянням:
У випадку, коли збільшенням об`єму розчину внаслідок додавання титранту можна знехтувати, розрахункова формула набуває вигляду:
Ка визначають графічно. Значення рКа дорівнює відрізку, що відсікає на ординаті пряма, побудована у координатах Значення рКа, отримані для розчинів з різною концентрацією кислоти, обробляють методом математичної статистики. Лабораторна робота № 13
ВИЗНАЧЕННЯ НІТРАТ-ІОНІВ У ГРУНТАХ, ОВОЧАХ ТА СОКАХ У роботі необхідно методом добавок визначити вміст нітратів у ґрунтах або продуктах харчування за допомогою мембранного нітрат-селективного електроду. Потенціал мембранного електроду (Е) прямо пропорційний активності визначуваного іону (а). Математично залежність може бути описана рівнянням, подібним до рівняння Нернста: Для переведення результатів потенціометричних вимірювань в одиниці концентрацій застосовують емпіричний градуювальний графік залежності Е – рС. Для успішного його застосування необхідно, щоб іонний склад досліджуваного та стандартних розчинів був однаковим. Цього важко досягти при аналізі складних зразків. Тому, у випадках, коли точний склад досліджуваного об`єкту невідомий, застосовують метод добавок. Прилади та реактиви 1. Стандартний розчин KNO3, 0,1 М 2. Розчин індиферентного електроліту – 1%-ний розчин алюмокалієвих галунів. 3. Стакани, ємн. 50 мл, 100 мл, піпетка ємн. 10.0 мл. 4. рН-метр із плівковим нітрат-селективним та хлорид-срібним електродами. 65. Магнітна мішалка 6. Мірні колби ємн. 25 мл, стакани ємн. 50 мл 7. Піпетки Хід роботи: Підготувати до роботи рН-метр згідно інструкції. В мірних колбах ємністю 25 мл готують розчини KNO3 з концентраціями 10-2, 10-3, 10-4 та 10-5 моль/л, шляхом послідовного розбавлення стандартного 0.1 М розчину дистильованою водою. В 5 стаканів ємністю 50 мл вмішують по 10.0 мл розчинів нітрату з концентрацією 10-5- 10-2 М та 10.0 мл індиферентного електроліту, занурюють електроди та вимірюють ЕРС ланцюга (Е, мВ). Результати вимірювань оформлюють у вигляді таблиці.
Таблиця Результати вимірювання потенціалу нітрат- селективного електроду залежно від рNO3-.
Значення іонної сили (I) для всіх розчинів розраховують, значення коефіцієнтів активності нітрат-іону (γ) для створеної іонної сили знаходять у довіднику, рNO3- розраховують за формулою:
Визначення вмісту нітрату в об`єктах.
Фруктові соки. В стакан ємн. 50 мл піпеткою відбирають 10.0 мл соку без м`якоті, додають 10.0 мл індиферентного електроліту, перемішують та вимірюють Е1. Додають 0.1 мл стандартного 0.1 М розчину нітрату, перемішують і вимірюють Е2. Грунти. На аналітичних терезах зважують наважку (≈10 г) попередньо висушеного та тонко подрібненого зразку, змішують з 50.0 мл дистильованої води у сухому стакані ємн.100 мл. Суміш перемішують впродовж 30 хв і фільтрують крізь паперовий фільтр „червона стрічка”. В стакан ємн.50 мл відбирають 10.0 мл отриманого розчину, додають 10.0 мл розчину індиферентного електроліту та вимірюють Е1. До розчину додають 0.1 мл стандартного розчину нітрату, перемішують і вимірюють Е2. Картопля, яблука. Очищені плоди подрібнюють на пластмасовій терці. В стакан ємн. 50 мл вносять наважку (≈ 5 г) продукту, зважену на аналітичних терезах, піпеткою додають 10.0 мл дистильованої води, перемішують і додають 10.0 мл індиферентного електроліту. Вимірюють Е1. В стакан додають 0.1 мл стандартного розчину нітрату, перемішують і вимірюють Е2.
Концентрацію нітрату (моль/л) в досліджуваному розчині розраховують за формулою:
де ΔE = Е1-Е2, Cст концентрація стандартного розчину KNO3, моль/л; Vст – об`єм добавки розчину KNO3, мл; Vx – об`єм розчину до введення добавки. Вміст нітрат-іону в досліджуваному зразку розраховують за формулами: В рідинах В твердих зразках де М – молекулярна маса NO3-, г/моль; V вит . – об`єм рідинної витяжки зразка, мл; V ал . – об`єм аліквотної частини рідинної витяжки зразка, мл; m – маса твердого зразка, г. Проводять три паралельні вимірювання і знаходять середнє значення і довірчий інтервал.
Лабораторна робота № 14
ВИЗНАЧЕННЯ АСКОРБІНОВОЇ КИСЛОТИ ЙОДиМЕТРИЧНИМ МЕТОДОМ З ПОТЕНЦІОМЕТРИЧНОЮ ІНДИКАЦІЄЮ ТОЧКИ ЕКВІВАЛЕНТНОСТІ
Йодиметричне визначення відновників ґрунтується на тому, що вони легко вступають у взаємодію з еквівалентною кількістю йоду. Наприклад, окиснення аскорбінової кислоти відбувається за рівнянням:
Надлишок йоду, що не прореагував, відтитровують розчином тіосульфату:
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 655; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.63.87 (0.273 с.) |

 ,
, (1)
(1) (2)
(2) (3)
(3) ,
, ,
,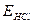 та
та  – молекулярна маса еквівалентів хлороводневої та фосфорної кислот відповідно;
– молекулярна маса еквівалентів хлороводневої та фосфорної кислот відповідно;
 відбувається за двохелектронним механізмом:
відбувається за двохелектронним механізмом:
 .
. , М.м. 126,06
, М.м. 126,06
 ,
, )- нормальність розчину оксалатної кислоти;
)- нормальність розчину оксалатної кислоти; ) - об’єм розчину оксалатної кислоти, взятий для титрування (аліквотна частина), мл.
) - об’єм розчину оксалатної кислоти, взятий для титрування (аліквотна частина), мл.


 ,
,
 малорозчинний у воді (<0,001моль/л), але розчиняється у присутності йодид-іонів:
малорозчинний у воді (<0,001моль/л), але розчиняється у присутності йодид-іонів:  . Тому для титрування застосовують розчин
. Тому для титрування застосовують розчин  є менш ефективним окисником порівняно з KMnO4,
є менш ефективним окисником порівняно з KMnO4,  , його використовують для титрування відновників з Е°<0,2 В, зокрема, аскорбінової кислоти.
, його використовують для титрування відновників з Е°<0,2 В, зокрема, аскорбінової кислоти. . В основі методу лежить реакція взаємодії калію йодиду із окисником:
. В основі методу лежить реакція взаємодії калію йодиду із окисником: 
 .
. не відповідає вимогам, що висуваються до вихідних речовин, оскільки при зберіганні звітрюється. Тому готують ~0,05Н натрію тіосульфату, зважуючи на технічних терезах відповідну наважку. Титр розчину встановлюють через 10 днів після приготування за калію біхроматом. Але титрувати тіосульфат безпосередньо розчином
не відповідає вимогам, що висуваються до вихідних речовин, оскільки при зберіганні звітрюється. Тому готують ~0,05Н натрію тіосульфату, зважуючи на технічних терезах відповідну наважку. Титр розчину встановлюють через 10 днів після приготування за калію біхроматом. Але титрувати тіосульфат безпосередньо розчином 
 (1)
(1)
 (2)
(2) розраховують за формулою:
розраховують за формулою: ,
, - нормальність робочого розчину калію біхромату;
- нормальність робочого розчину калію біхромату; - об'єм робочого розчину, що було взято для титрування, мл;
- об'єм робочого розчину, що було взято для титрування, мл; - нормальність розчину натрію тіосульфату;
- нормальність розчину натрію тіосульфату;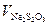 - об'єм розчину тіосульфату натрію, що було витрачено на титрування, мл.
- об'єм розчину тіосульфату натрію, що було витрачено на титрування, мл. ) у грамах розраховують за формулою:
) у грамах розраховують за формулою: ,
, - молярна маса еквіваленту Купруму;
- молярна маса еквіваленту Купруму; - об'єм розчину задачі, взятий на одне титрування (аліквота), мл;
- об'єм розчину задачі, взятий на одне титрування (аліквота), мл; - загальний об'єм розчину задачі, мл.
- загальний об'єм розчину задачі, мл.
 ,
, - нормальність розчину натрію хлориду,
- нормальність розчину натрію хлориду,  - аліквотна частина розчину натрію хлориду, мл;
- аліквотна частина розчину натрію хлориду, мл;  - середній об’єм арґентуму нітрату, що було витрачено на титрування, мл.
- середній об’єм арґентуму нітрату, що було витрачено на титрування, мл.
 ,
,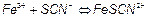 .
. ,
, та
та  - нормальності розчинів нітрату срібла та тіоціанату амонію.
- нормальності розчинів нітрату срібла та тіоціанату амонію. - об’єми зазначених вище розчинів, витрачених на титрування, мл.
- об’єми зазначених вище розчинів, витрачених на титрування, мл. - молекулярна маса еквіваленту хлорид -іону.
- молекулярна маса еквіваленту хлорид -іону. І
І

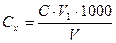
 ,
,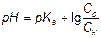 .
. .
. ”, при
”, при  , де V- об’єм доданого титранту.
, де V- об’єм доданого титранту. , де j та S – константи, обумовлені властивостями мембрани.
, де j та S – константи, обумовлені властивостями мембрани. . За одержаними даними будують графік залежності Е - рNO3 і визначають крутизну електродної функції (S) в мВ/одиниця рС.
. За одержаними даними будують графік залежності Е - рNO3 і визначають крутизну електродної функції (S) в мВ/одиниця рС. ,
, –
–  ,
, –
–  ,
,



