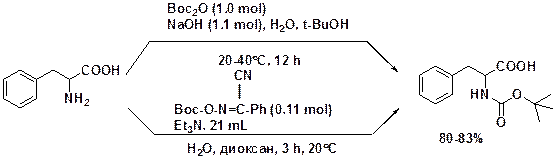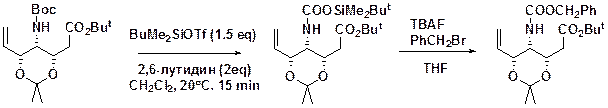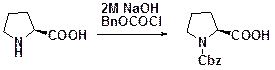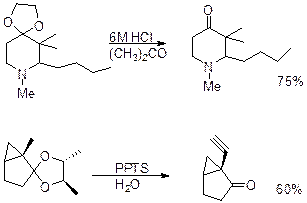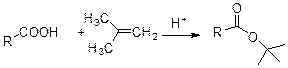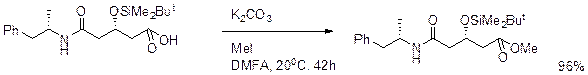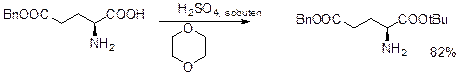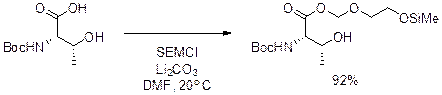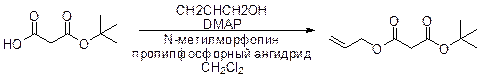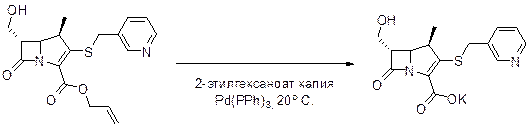Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Трет-бутоксикарбонильная защитаСодержание книги Поиск на нашем сайте
ВОС или t-ВОС наиболее часто используется для защиты групп NH2 и NH.
Она инертна к каталитическому гидрогенолизу и чрезвычайно устойчива к действию основных и нуклеофильных реагентов. Идеальный партнер для бензиловых эфиров и карбаматов, используемых в пептидном синтезе.
Введение защитной группы. Третбутилхлорформиат нестабилен, поэтому для введения ВОС-защиты используют ВОС2О (ВОС-ангидрид) или дитретбутилдикарбамат и 2-(трет-бутоксикарбонилимино)-2-фенилацетонитрил («ВОС-ON»). В присутствии диметиламинопиридина ВОС2О может быть использован для защиты азота в амидах и индолах.
Снятие защиты. Осуществляют чистой CF3COOH или в CH2Cl2. Селективное снятие ВОС в присутствии третбутиловых простых и сложных эфиров невозможно. Реагент относительно инертен к бензилоксикарбонильной группе (трифлат более селективен). Могут быть использованы кислоты Льюиса.
Бензилоксикарбонильная группа Z или Cb2 Очень широко используются в пептидном синтезе. Введение. BnOCOCl в присутствии Et3N, возможно NaHCO3 или NaOH. Другие реагенты BnOCOX, х-сукцинимидил-, бензотриазолил-, имидазолил-, циано-
Используется кристаллическое вещество, Cbz создается опосредованно.
Снятие защиты. Каталитический гидрогенолиз и ацидолиз. Условия мягкие, их выдерживает большинство защитных групп.
Ацидолиз – протонные кислоты, кислоты Льюиса.
Каталитический гидрогенолиз.
N-сульфиниламиды
1) Сульфониламидная группа уменьшает чувствительность пирролов и индолов к электрофильному замещению и окислению. 2) Замещение NH в индолах, пирролах, карбазолах и имидазолах на арилсульфамидную обусловливает литирование гетероцикла.
Введение защитной группы. В индолы, пирролы, имидазолы и т.д. арилсульфонильную группу вводят с помощью сульфонилхлорида в присутствии подходящего основания. Ниже приведены примеры BuLi, гидрид металла в ТГФ и условия межфазного катализа.
В этих условиях сохраняется ВОМ-защита, которая в стандартных условиях PTSA снимается.
Реакция ацетолизации довольно часто в случае циклизации винилкетонов сопровождается миграцией кратной связи.
Иногда эту миграцию используют в синтетических целях.
Снятие защиты: ацетали расщепляются кислотами Льюиса со скоростями, зависящими от природы металла. Большинство цикличесикх ацеталей выдерживают действие MgCl2 и ZnCl2 при низких температурах, но с повышением температуры появляется опасность ращепления.
Сильные кислоты Льюиса Al, Ti, B, R3SiCl вызывают расщепление ацеталей. Например, в присутствии солей Ti и И реактивы Гриньяра, купраты, диалкилцинк, аллилсилаты замещают один из атомов кислорода в ацеталях.
Ацетали ароматических карбонильных соединений подвергаются гидролизу и восстанавлению при растворении металлов.
Ацетали стабильны и устойчивы к действию гидридов металлов и литийорганических соединений, действию водных и спиртовых растворов сильных оснований, каталитическому гидрированию и действию металлов Na или Li в жидком аммиаке.
Основной метод снятия ацетальной защиты это кислый нидролиз. Следует учитывать, что 1,3-диоксановые производные кетонов гидролизуются труднее, чем 1,3-диоксолановые. В тоже время 1,3-диоксолановые производные альдегидов устойчивее 1,3- диоксановых. Очень часто процесс снятия ацетальной защиты происходит в процессе хроматографирования.
Иногда для снятия защиты используют PdCl2(MeCN)2 в ацетоне или FeCl3 на силикагеле.
Защиты карбосильных групп.
Для защиты карбоксильной группы имеется 85 защитных групп (защитные группы в органическом синтезе) и 72 из них эфирные в той или иной форме. Большинство защитных групп вводят с использованием водорода с основными реагентами.
Этерефикация карбоксильной группы кислотой.
Можно выделить следующие традиционные методы этерефикации. 1. Прямое получение из кислот и эфиров. Спирт используется в большом избытке, поэтому он должен быть дешевым и легко кипящим.. Этот метод хорош для метиловых, этиловых,........эфиров, т.к. реакция этерефикации требует применения сильных кислот в качествое катализаторов, то субстрат должен быть стабилен к действию кислот. 2. Реакция хлорангидридов и ангидридов кислот со спиртами. Это вероятно, наиболее широко используемый метод в широком интервале субстратов и условий. Поэтому всегда можно подобрать условия приемлимые для других функциональных групп (не затрагивающие другие группы). Реакцию ведут в присутствии мягких оснований – триэтиламин или пиридин. Стерически трудные спирты реагируют очень слабо. В этом случае модно добавить ДМАР (диметиламинопиридин). И тогда этерефикация значительно ускоряется.
3. Реакция солей кислот с алкилгалогенидами. Этот метод используется для приготовления метиловых, этиловых, аллиловых и бензиловых эфиров, т.к. реакция протекает по SN2 механизму, то она ограничивается первичными галогенидами. Использование солей цезия или тетраалкиламмониевых солей является наиболее эффективным. 4. Реакция карболоновых солей с олефинами. Этот метод применятеся чаще всего для пригтовления третбутиловых эфиров.
Реакцию проводят в присутствии сильной минеральной кислоты. 5. Реакция карбоновых кислот с диазоалканами. Этот метод один из самых мягких и эффективных методов этерефикации. Чаще всего использутеся дя получения метиловых и бензиловых эфиров, т.к. соответствующее диазосоединение получается легко.
Кроме этих традиционных методов рассмотрим новые методы этерефикации. а) использование дициклогексилкарбодиимида (DCC) для активации карбонильной группы. В этом случае реакция идет через О-ацилизомочевину.
По этой реакции (Стеглин) этерефицируются первичные, вторичные и третичные спирты при 20°С. Этот метод можно использовать для этерификации спиртами очень чувствительными к действию оснований.
б) Этерефикация Ямагуши через смещанные ангидриды 2,4,6-трихлорбензойной кислоты. Впервые из кислот и 2,4,6-трихлорбенлилхлорида в присутствии DMAP или триэтиламина образуется смешанный ангидрид, который и этерифициреут спир. Этот метод применим для этерификации вторичных спиртов без рацемизации соседнего хирального центра. Этот метод часто используется для получения макроциклических лактонов, например, 10-членных.
PMB-n-метоксибензил DMB- 3,4-диметоксибензил
в) Этерификация, активированная N-амилгалопириниевыми солями. Можно использовать для синтеза 9-членных циклов.
г) Этерификация Митсунобу. Реакция протекает в нейтральных условиях, используется диэтилазодикарбоксилат. Процесс напрвлен на активацию ОН группы. Этерификация вторичных спиртов протекает с обращением конфигурации. Чаще всего используется в синтезе природных продектов, например, ингибитора глоэспорона.
Метиловые эфиры.
Получение. 1. Реакция с дазометаном. Последний получают реакицей N-метил-N-нитрозо-nтолуолсульфамида с КОН и исползуют в эфирном растворе. Диазометан летуч, токсичен, взрывоопасен. Но несмотря на это, метод используется в случае небольших загрузок. Диазометан в растворе желтый, и при встеплении в реакцию раствор обесцвечивается. В последнее время используют периметилимидазометан. 2. Этерификация кислот в метаноле в присутсвии 2 экв Me3SiCl используется для этрификации аминокислот.
В начале генерируется триметилсилиловый эфир, который in situ превращается в меттиловый эфир.
Na, K, CsCOMe и тетраалкиламмониевык соли карбоновых кислот и метилиодид в ДМФА.
Использование N,N’-диалкил-О-метилизомочевин.
Этот тип реакции позволяет осущетсвить этерификацию кислоты в присутствии незащищенных ОН-групп.
Снятие метильных защитных групп.
Обычный метод – гидролиз, катализируемый гиороксилами металлов или карбонатами в метанле или ТГФ, - ограничивается настабильностью субстратов в основных условиях.
Следующий пример иллюстрирует селективный гидролиз сложноэфирной группы.
Карбоксилат анион является плохой уходящей группой, однако галогенид, тиолят или уианид анионы, чью нуклеофильность модно повысить, исопльзуя диполярные апротонные расворители, атакуют метиловые, этиловые и бензиловые эфиры при обычных температурах. Метиловые эфиры в 70 раз быстрее расщепляются по сравнению с соответствующими этиловыми эфирами, что можно использовать для селективного расщепления.
Понизить температуру расщепления метиловых эфиров можно, используя высокую нуклеофильность тиолят аниона в диполярных растворителях или используя тиоэфиры в присутствии кислот Льюиса.
При этом ОМе, фенольные и спиртовые, s,s-диацетальная и OSiMe2But защита сохраняются.
Трет-бутиловые эфиры.
О-третбутилтрихлорацетимидат получают с выходом в 70% из нитрила и t-BuOK (см. карюосоединения).
Имидат реагирует с кислотой в присутствии каталитичесиких количеств BF3 при 20°С в системе циклогексан-CH2Cl2.
Аналгичная реакция имеет место при использовании N,N’-диизопропил-О-третбутилизомочевиныю Присутствие гидроксильных групп не мешает протеканию реакции.
Классический метод, о котором уже говориось раньше, представляет собой использование изо-бутилена в присутствии сильной кислоты.
Более мягкий метод – это реакция Ямагуши: использование 2,4,6-трихлорбензоилхлорида и триэтиламина. Образуются смешанные ангидриды, которые реагируют с t-BuOH в присутствии DMAP.
Расщепление. Третбутиловые слжные эфиры очень лабильны в кислых условиях и могут селективно расщепляться в присутствии первичных алкиловых эфиров. С другой стороны первичные алкиловые эфиры в водной щёлочи гидролизуются легче, чем трет-бутиловые эфиры. Из-за стерическх препядствий трет бутиловые эфиры более стабильны к действию нуклеофилов, чем первичные.
Третбутиловые эфиры легко расщепляются в триторуксусной кислоте водном или дихлорметановом растворе при 20 с потерей избутелена.
Могут быть использованы и муравьиная и п-толуолсульфокислота в кипящем бензоле.
Может быть использована уксусная в кипящем изпропаноле (мягкие условия. Этот метод используется в синтезе винкамина алкалода индольного ряда.).
Получение Реакции солей карбоовых кислот с ROCH2Cl.
В отсутствии кислот, образующиеся ацетали сложных эфиров показывают реакционную способность типичную для алкиловых эфиров.
МТМ метилтиометиловые эфиры получают реакцией триэтиламмониевых солей карбоновых кислот с хлрдиметилсульфонием хлоридом или калиевой соли кислоты с MeSCH2Cl в присутствии NaI и 18-краун-6. ((CH3)2SCl2) Расщепление ацетали сложных эфиров чувствительны к мягким слабым водным кислотам в ТГФ, Мягким кислотам Льюиса типа MgBr2 в эфире при 20 С расщепляет МТМ эфиры. МЕМ расщепляют хуже. Расщепление 48% HF в MeCN при -10 С не затрагивает третбутоксикарбонил (Boc) и бензилоксикарбоил (Cbz) защитных групп BOM можно снять каталитическим гидрированием.
Трихлорэтилвые эфиры. Получение этерификация карбоновых кислот или кароксильной группы с трихлорэтанолом в присутствии дициклогексилкарбодиимида и диметиламинопиридна. Это самый мягкий метод. Традиционный состоит во взаимодействии хлорандрида кислоты с трихлорэтанолом в присутствии пиридина.
Расщепление Впервые эта защитная группа была использована Вудвордом в синтезе цефлоспорина С. Затем она стала ипользоваться в пептидном синтезе в синтезе антибиотика Lavendomicyn. Она легко удаляется обработкой Zn в AcOH. Возможен метод обработки каталитических количеств Se в присутствии NaBH4 в ДМФА при 40-50 С.
Аллиловые эфиры Получение Этерифкация карбоксильной группы аллиловым спиртом с активацией карбоксильной группы. Цезиевые соли карбоксилатов и аллилбромид реакции в межфазном катализе.
Наконец, традиционный метод: кислый катализ этерификации TsOH используют при этерификации аминокислот.
Расщепление Аллилную защиту можно снять используя переходные металлы. Pd, Pd(AcO)2 сопровождается выделением CO2 когда в αположении акцептор.
Для снятия аллильной защиты в случае чувствительных к дйствию кислот β-лактамов используют Pd(PPh)3, 2-этилгексаноат в среде MeCN-EtOAc.
Силиловые эфиры Получение Получают взаимдействием кислты с R3SiCl или R3SiOTf в присутствие оснований (Py, Et3N, Имидазол) в ДМФА или ТГФ.
Расщепление Следует учитывать, что сложные силлиловые эфиры расщепляются легче чем простые. Стабльность сильно зависит от стерического эффекта. Так в 1% HF-MeCN третбутлдифенилсиллиловый сложный эфир расщепляется за 15 мин, в то время как простой требует намного большего времени.
|
|||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 1152; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.139.119 (0.012 с.) |