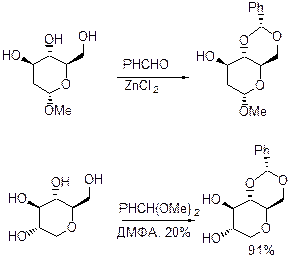Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ацетильная защита (алкоксиэфиры)Содержание книги Поиск на нашем сайте
Этот тип защиты принципиально используется для 1,2- и 1,3-диолов, альдегидов и кетонов. Аналогичную ацетальную защиту можно использовать для гидроксильных групп, проводя алкилирование хлоралкиловыми эфирами в присутствии слабых и пространственно трудных оснований (i -PrNEt). Реакция протекает намного быстрее, чем в присутствии MeI, BnBr или аллилбромида по SN1 механизму, т. к. кислород, стоящий в α-положении к галогену за счет своей пары электронов способствует стабилизации карбкатионов. Следует помнить, что алкилирующие агенты являются потенциальными канцерогенами и требуют работы под тягой с защитой глаз.
Метоксиметиловые эфиры - МОМ Алкилирование проводят с помощью CH3OCH2Cl в присутствии NaH или KH в ТГФ. Альтернативно можно проводить алкилирование МОМCl и MOMBr в присутствии i -Pr2NEt.
Если проводить алкилирование MOMCl с NaI и i -Pr2Net в диметоксиэтане при нагревании, то можно алкилировать и третичную спиртовую группу.
Снятие защиты: Кислый гидролиз МОМ требует жестких условий в присутствии небольшого количества HCl.
CF3COOH используется для снятия защиты с третичных групп.
Снятие защиты можно осуществить кислотами Льюиса в широком интервале температур и растворителей, используя лутидин для снятия МОМ в присутствии других защитных групп.
При низких темпратурах можно использовать Me3SiBr в CH2Cl2.
2-(Метоксиэтоксиметиловые)эфиры – CH3OCH2CH2O-CH2 – МЕМ Эти эфиры разлагаются в присутствии кислот Льюиса легче, чем метоксиметиловые эфиры (МОМ). МЕМ устойчивы и действию 0,05 экв безводной п-толуолсульфокислоты в MeOH при 25°С 3-15 часа, 3:1 AcOH – вода при 35°С 4 часа. Расщепляются HBr в AcOH или 2М HCl.
Получение: CH3OCH2CH2OCH2Cl. 1) Алкоксиды натрия и калия в ТГФ с MEMCl. 2) MEMCl в CH2Cl2 в присутствии i -Pr2NEt, Et3N в MeCN. Реакция MEMCl в MeCN в присутствии Et3N почти нейтральная среда и используется для алкилирования третичных спиртов.
Расщепление: HBr в ТГФ; ZnBr2 в CH2Cl2; TiCl4 в CH2Cl2.
Защитные группы для диолов Используются бензилиденацетали, изопропенилиденацеталь, циклогексилидены или циклопенталиденацетали.
Эти защитные группы используются для 1,2- и 1,3-диолов. Связано это с тем, что при этом образуются пяти или шестичленные циклы с 1,3-расположением атомов кислорода.
С другой стороны ацетальную защиту можно рассматривать как защитные группы для карбонильных соединений. Свойства ацеталей вам хорошо известны (химия углеводов).
Зная свойства ацеталей, можно говорить, что эти защитные группы должны быть устойчивы в щелочных условиях и достаточно легко разлагаются в кислых условиях. Бензилиденацетали Устойчивы в большинстве достаточно сильных основаниях, мягких оксидантов и гидридов металлов (в отсутствии кислот Льюиса). Бензилиденацетали легко атакуются N-бромсукцинимидом и озоном.
Бензилиденацетали нестабильны к действию сильных оснований – соединений алкиллития, они подвергаются гидрогенолизу в присутствии Pd или Pt. Кислоты Льюиса также расщепляют бензилиденацетали.
Получение: Имеется два метода синтеза такого рода производных 1,3-диоксанов и 1,3-диоксоланов: 1) реакция диола с бензальдегидом (и его замещенными по кольцу производными) в присутствии протонных кислот и кислот Льюиса (чаще всего ZnCl2); 2) реакция диола с диметилацетилем бензальдегида (ацетальный обмен) в условиях кислого катализа.
Мы можем ожидать для полигидроксипроизводных образование как пятичленного (1,3-диксоланового цикла), так и шестичленного (1,3-доискинового).
В отсутствии заместителей в полиоле мы в праве ожидать образование диоксана, так это термодинамически более стабильный продукт.
Строение защищенного продукта очень сильно зависит от температуры, заместителей и условий проведения, строения карбонильного соединения.
Альдегиды имеют тенденцию давать шестичленные циклы, кетоны (ацетон, циклогексанон) – пятичленные.
В кетонах аксиальный заместитель ацетального центра дестабилизирует соответствующий 1,3-диоксан. В бензалиденацеталях 1,3-диолов Ph занимает экваториальное положении, предсказать геометрию (ориентацию Ph) в случае диоксоланов сложнее.
Снятие бензилиденовой защиты:
1) Каталитическое гидрирование. Мягкие условия. 2) Na и Li в жидком аммиаке в присутствии доноров протонов
3) Обычный тривиальный метод – кислый гидролиз
Обращаю ваше внимание на то, что ацетальную защиту при наличии нескольких групп можно снимать избирательно.
Для снятия бензилиденовой защиты используют восстанавливающие реагенты, чаще всего комплексные гидриды, которые позволяют снимать защиту только с одной ОН-группы в то время как вторая остается защищенной в виде бензилового эфира
Введение алкокси-групп в фенильное кольцо резко уменьшает стабильность ацеталей. Так р -метоксибензилиденацетали примерно в 10 раз быстрее гидролизуются, чем бензилиденацетали. Для них можно легче подобрать условия региоселективного расщепления под действием комплексных гидридов.
Изопропенилиденацетали. Это чаще всего используемые защитные группыдля 1,2- и 1,3-диолов. Введение ацетальной защиты: Самый распространенный метод: диол+ацетон+кислота. В тех случаях, когда требуется удалить воду используют молекулярные сита (3-4 Å) или CuSO4 (безводный). Диоксоланы предпочитают диоксанам. Цис-связанные системы (диоксоланы) предпочтительнее.
Можно использовать ацеталь ацетона
Для получения транс-сочлененных ацеталей используют 2-метоксипропен в ДМФА в присутствии п-ТСК
|
||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 986; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.237.79 (0.006 с.) |