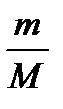Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Уравнения химических реакций
Закон сохранения массы веществ.
Для составления химических уравнений необходимо соблюдать ряд последовательных действий. Каких? ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Завершите уравнения химических реакций и расставьте коэффициенты:
Na + Cl2 = ………………………... S + O2 = …………………………. P + O2 = …………………………. Fe + S = …………………………..H2 + Cl2 = ………………………… N2 + H2 = ………………………….
Составьте уравнения следующих химических реакции и расставьте коэффициенты: Fe + ….. = FeCl3 H2S + …. = H2O + SO2 Al + …. = Al2S3 …. + HCl = ZnCl2 + H2 …. + CuSO4 = FeSO4 + Cu CaO + ….. = CaCO3
Какую массу Fe2O3 и SnO2 необходимо взять для получения 10 граммов чистого металла? ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………... …………………………………………………………………………………………. ____________________________________________________________________ ЗНАТЬ
Количество вещества. Моль. Число Авогадро. Молярная масса.
М – молярная масса вещества, показывает массу одного моля вещества.
Численное значение молярной массы вещества М равна численному значению Ar и Mr данного вещества. (Mr (Н2О)= 18, М (Н2О) = 18 г/моль. Ar (Fe) =56а.е.м. Ar (Fe) =56 г/моль) NA – число Авогадро, показывающее число частиц, составляющих 1 моль вещества. NA = 6,02 х 1023моль-1. Взаимосвязь между количеством вещества и массой, числом частиц, объемом выражается следующими формулами и можно проводить расчеты: v = |
Количество вещества обозначается…………… и определяется по формуле:
где М …………………………………………………………………….., которая показывает, ……………………………………………………………………………………
Задача: Определите количество вещества сульфата натрия (Na2 SO4), если
его масса равна 49,7г.
|
|
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………......
____________________________________________________________________
12
САМОСТОЯТЕЛЬНАЯ РАБОТА
1. Образец вещества массой 6,6г содержит 9,03 х 1023молекул. Определите молярную массу этого вещества. ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………….
2. Количество вещества сульфида натрия Na2S равно 0,6 моль. Определите массу натрия, необходимого для получения данного образца сульфида. …………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
3. На одной чаше весов находится 30г мела СаСО3. Если на другую чашу положить серу в количестве 1 моль, уравновесятся ли весы, если нет, то какого вещества больше.
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
4. Заполните таблицу:
| Формула вещества | m - масса | М-молярная масса | v -количество вещества | N - количество молекул |
| CO2 | 220 г | |||
| 34 г | 2 моль | |||
| 80 г | 3,01х1023 | |||
| H2SO4 | 12,04х1023 | |||
| NO | 5 моль | |||
| 18 г/моль | 3 моль | |||
| CaCO3 | 10 г |
5. Сколько будет весить 1 моль комаров, если один комар весит 0,2г……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………….. _________________________________________________________________
|
|
ЗНАТЬ
Типы химических реакций.
| Различают четыре типа химических реакции: 1. Реакции соединения 2. Реакции разложения 3. Реакции замещения 4. Реакции обмена |
Реакции соединения – это…………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Реакции разложения – это …………………………………………………………….......
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Реакции замещения – это …………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Реакции обмена – это ………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Самостоятельно заполните таблицу:
а) реакции разложения малахита,
б) взаимодействия алюминия с раствором хлорида меди,
в) реакцию между растворами сульфата меди и гидроксида натрия,
г) сжигание фосфора
| Признаки, указывающие на появление новых веществ | Уравнение реакции | Тип реакции | Определение данного типа реакции |
_______________________________________________________________
УМЕТЬ
Задание на закрепление усвоенных знаний:
Расставить коэффициенты и определить тип реакции:
CaCO3 = Ca + CO2 …………………………........................................................
H2 + O2 = H2O……………………………………………………..........................
Zn + H2SO4 = ZnSO4 + H2………………………………………..........................
NaCl + AgNO3 = NaNO3 + AgCl ……………………………………………….
H2 + Cl2 = HCl ……………………………………………………………………..
CaBr2 + Cl2 = CaCl2 + Br2........................................................................................
H2SeO4 = H2O + SeO3 ……………………………………………........................
H2S + K2O = K2S + H2O ……………………………………………………….....
Дописать уравнения реакций и определить их тип:
III II
Al + O2 = Al O ……………………………………………………………………
III II
Fe O + H2 = Fe + H2O ……………………………………………………………
II II II II IV II
Zn S + O2 = Zn O + S O ………………………………………………………...
I I III I
Al + H Cl = Al Cl + H2 ……………………………………………………………...
III II I I III I
Fe O + H Cl = Fe Cl + H2O ……………………………………………………...
III II II II
Fe O + C = Fe + C O …………………………………………………………….
____________________________________________________________________
УМЕТЬ
Решение разноуровневых задач:
А.
1. Найти массу Al2O3 по уравнению: 4Al + 3O2 = 2Al2O3, если объем кислорода равен 11,2 литра………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
|
|
2. Найти количество вещества HCl по уравнению: H2 + Cl2 = 2HCl, если объем водорода равен 44,8 литра. ……………………………………………………….
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
3. Найти количество вещества FeCl3 по уравнению реакции:
2Fe + 3Cl2 = 2FeCl3, если масса железа равна 5,6 грамм…………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
4. Найти объем, количество вещества и количество молекул 440 граммов СО2.
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
5. Состав вещества выражен формулой SO3.
Определите:
a) Название вещества ………………………………………………………………………..
б) Качественный состав………………………………………………………………….....
в) Количественный состав …………………………………………………………………
г) Валентность химических элементов…………………………………………………..
д) Молярную массу……………………………………………………………………………
е) Массовые доли элементов, образующих вещество…………………………………
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………….
ж) Массу вещества количеством 1,5 моль……………………………………………....
...…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
____________________________________________________________________
УМЕТЬ
В.
1. В 160 г образца соединения содержится 128 г меди и 32 г кислорода. Установите формулу соединения……………………………………………………........
…………………………………………………………………………………………………………………………………………………………………………………………………………
|
|
2. Составить формулы соединений элемeнтов: K (I); Al (III); Mg (II); S (IV);
As (V)с каждым из элементов: O (II); F (I); C (VI); N (III).
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
3. Заполните таблицу:
| Формула вещества | масса | Молярная масса | Количество вещества | Количество молекул |
| MgCO3 | 5 моль | |||
| Na2O | 25 г | |||
| HCN | 18,06х1023 | |||
| 88 г | 2 моль |
4.Какая масса HCl потребуется для реакции с 5 молями NaOH по уравнению: NaOH + HCl = NaCl + H2O………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
5. Какой объем водорода получится из 8 граммов кальция в реакции:
H2SO4 + Ca = CaSO4 + H2. ………………………………………………………………......
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
6. Дополнительное задание - определить валентности:
Fe2O3, SO2, SO3, Cl2O7, Cr2O3, NH3, CH4
____________________________________________________________________
УМЕТЬ
| формула | М | m | n | V | N |
| C3H8 | 2 моль | ||||
| SO2 | 40 л | ||||
| O2 | 80 г | ||||
| N2 | 9,03х1023 | ||||
| 96 г | 134,4 л |
1. Заполните таблицу.
2. Какой объем H2S выделяется в реакции: Zn + H2SO4 = H2S + ZnSO4, если в реакции участвует 3 моль H2SO4…………………………………………………………...............................
…………………………………………………………………………………………………………………………………………………………………………………………………………..…………………………………………………………………………………………………..……………………………………………………………………………………………………...........................
Найти массу, количество вещества и объем, занимаемый 9,03х1023 молекул NO.…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………...............................................................................
4. Масса золы составляет 1,2% от массы сожженного дерева, а массовая доля кальция в золе равна 25%. Вычислить массу магния в дереве массой 700 кг.
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………........
Составить формулы оксидов (бинарных соединений с двухвалентным кислородом) и хлоридов (бинарных соединений с одновалентным хлором) серы (IV) и (VI), азота (I), (II), (III), (IV) и (V), марганца (I), (II), (IV), (V) и (VII).
|
|
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Найдите ошибку.
I II IV I V I I V II IV
Ag2O, FeO, Fe2O3, N2O, SO2, CaO, Mn2O7, RuO4
____________________________________________________________________
ЗНАТЬ
КИСЛОРОД. ОКСИДЫ. ГОРЕНИЕ.

Лавуазье Антуан Лоран
Французский химик. Один из основоположников
классической химии. Ввел в химию строгие
количественные методы исследования.
Получил кислород. Доказал сложный состав атмосферного воздуха, содержащего кислород и «удушливый воздух» (азот). Доказал сложный состав воды, установив, что она состоит из кислорода и водорода.
Ø Кислород – «оxygenium» – рождающий кислоты.
Ø O2 – газообразное вещество, молекула которого имеет кратные связи, (O=O).
Ø Горение – это реакции, при которых происходит окисление веществ с выделением тепла и света.
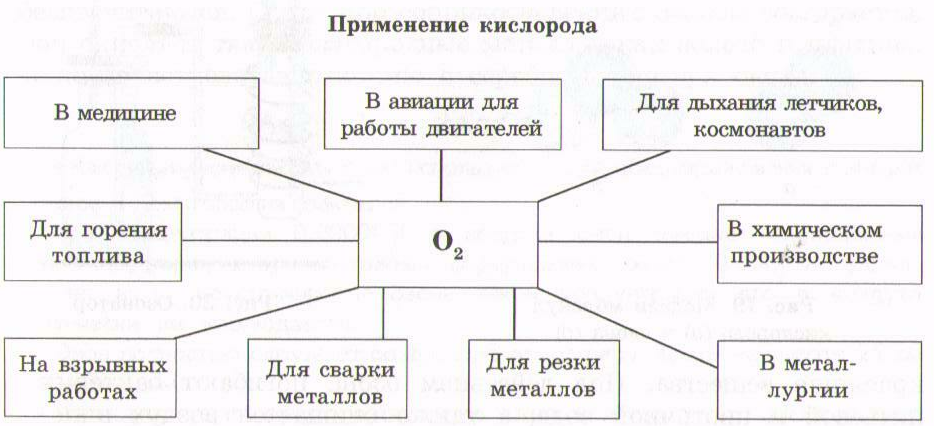
Ø Оксиды – это сложные вещества, состоящие из двух элементов, один из которых кислород.
| Простое вещество + кислород = оксиды. 4 Fe + 3 O2 = 2 Fe2O3 |
____________________________________________________________________
УМЕТЬ
1. Опишите химические и физические свойства кислорода и напишите уравнения соответствующих реакций: …………………………………………………..
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Li + O2 = СН4 + О2 =
Cu + O2 = С2Н5ОН + О2 =
Н2S + O2 = NH3 + O2 =
2. Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:
KClO3 → O2 → CO2 → O2 → H2O → O2 → P2O5
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………….
3. Какую роль играет кислород в жизни живых организмов?
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………................................................
4. Какое явление называется аллотропией?............................................................
........................................................................................................................................................................................................................................................................................................................................................................................................................
5. Какие инертные элементы содержатся в составе воздуха?............................
.......................................................................................................................................................................................................................................................................................................................................................................................................................
6. Какие газы опасные газы могут присутствовать в воздухе и какие меры защиты предлагаете?..................................................................................................
..........................................................................................................................................................................................................................................................................................................................................................................................................................
____________________________________________________________________
ЗНАТЬ

 [моль]
[моль]
 [ г/моль]
[ г/моль]
 ;
;  v =
v =  ;
;  =
=  ;
; 
 ; N=NA
; N=NA