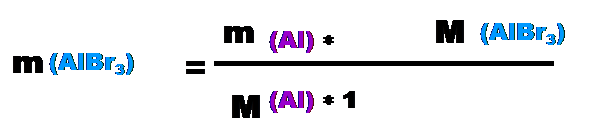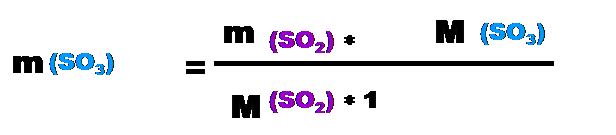Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Простота четвертой формулы объясняется тем, что газы реагируют друг с другом в соотношениях как небольшие целые числа. ⇐ ПредыдущаяСтр 2 из 2
Для начала сравним решения задач №1 и №2 вторым способом, а потом решим пару задач обеими способами. Задача №1. (2 способ решения) Определите, какая получится масса бромида алюминия при взаимодействии 50 грамм алюминия с бромом? Копия задачи №1: Определите, какая получится масса бромида алюминия при взаимодействии 50 грамм алюминия с бромом? Дано: реагенты Al, Br2(см. памятку в тетради "двухатомные молекулы веществ"). m(Al)=50г; m(AlBr3)-? 1) запишем уравнение реакции: 2Al + 3Br2 = 2AlBr3 2моль*M(Al) 2моль*M(AlBr3) По уравнению видно, что ν (Al) =ν(AlBr3) Þ молярное соотношение контрольного в-ва алюминия и искомого в-ва бромида алюминия =1 Þ Х=1. Так как даны массы контр. в-ва и иск. в-ва., то воспользуемся формулой:
m(AlBr3)=50г*267г⁄моль:27г⁄моль≈494,4г Ответ: масса бромида алюминия ≈494,4 г.(как и в первом варианте решения). Задача №2. (2 способ решения) Определите, какая получится масса оксида серы (VI) при взаимодействии 130 грамм cернистого газа с кислородом и какой объём кислорода при этом израсходуется? Копия задачи №2: Определите, какая получится масса оксида серы (VI) при взаимодействии 200 грамм cернистого газа с кислородом и какой объём кислорода при этом израсходуется? (Особенность этой задачи в том, что здесь 1 контрольное вещество (сернистый газ) и 2 искомых вещества: оксид серы(VI) (надо найти массу) и газ кислород (надо рассчитать объём).) Дано: реагенты SO2, O2 m(SO2)=200г; m(SO3)-? V(O2)-? Решение: 1) напишем уравнение реакции: 200г yл хг 2SO2 + O2 = 2SO3 2моль 1моль 2моль 2) Из уравнения реакции видно, что ν(SO2)=ν(SO3) Þ молярное соотношение контрольного в-ва cернистого газа и искомого в-ва оксида серы (VI) =1 Þ Х=1. Так как даны массы контр. в-ва и иск. в-ва., то воспользуемся формулой:
m(SO3)=200г*80г⁄моль:64г⁄моль=250г 4) Найдем объем кислорода: Из уравнения реакции видно, что ν(SO2):ν(O2) =2 4) Þ молярное соотношение контрольного в-ва cернистого газа и искомого в-ва кислорода 2:1 Þ Х=2. Так как даны масса контр. в-ва и объем иск. в-ва., то воспользуемся ƒ формулой
V(O2)=200г*22,4л⁄моль:64г⁄моль:2=35л Ответ: m(SO3)=250г; V(O2)=35л Задача №13. При горении аммиака в кислороде в присутствии Cr2O3 продуктами горения будут оксид азота (II) и водяной пар. Найти массу оксида азота (II), если на горение аммиака потратили 90л кислорода?
Копия задачи №13: При горении аммиака в кислороде в присутствии Cr2O3 продуктами горения будут оксид азота (II) и водяной пар. Найти массу оксида азота (II), если на горение аммиака потратили 90л кислорода? (Оксид хрома (III) играет роль селективного катализатора Þопределенные продукты реакции. Решим эту задачу 2 способами). Дано: реагенты NH3 и О2. V(O2)=90л; m(NO)-? 1 cпособ решения – через пропорцию 1) Запишем уравнение реакции каталитического окисления аммиака и составим элементы пропорции: Л хг 4NH3+5O2=4NO+6H2O(Cr2O3-катализатор) 5моль*Vm 4моль*М(NO) 5моль*22,4л⁄моль 4моль*30г⁄моль Л 120г 2) Найдем из пропорции массу NO: 90л:112л=хг:120г Þ Х=90*120:112Þ Х≈96,42г Ответ: m (NO)≈96,42г 2 cпособ решения – через молярные соотношения 1) Запишем уравнение реакции: 4NH3+5O2=4NO+6H2O(Cr2O3-катализатор) Моль 4моль
|
||||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 94; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.186.164 (0.004 с.) |