
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Коэффициенты теплопроводности различных накипей.Стр 1 из 5Следующая ⇒
Основные положения.
Различные примеси, содержащиеся в нагреваемой и испаряемой воде, могут выделяться в твердую фазу на внутренних поверхностях парогенераторов, испарителей, паропреобразователей, подогревателей и конденсаторов паровых турбин в виде накипи, а внутри водяной массы – в виде взвешенного шлама. Нельзя, однако, провести четкую границу между накипью и шламом, так как вещества, отлагающиеся на поверхности нагрева в форме накипи, могут с течением времени превращаться в шлам и, наоборот, шлам при некоторых условиях может прикипать к поверхностям нагрева, образуя накипь. Из элементов парогенератора загрязнению внутренних поверхностей больше всего подвержены обогреваемые экранные трубы. Образование отложений на внутренних поверхностях парообразующих труб влечет за собой ухудшение теплопередачи и как следствие опасный перегрев металла труб. Некоторые составляющие отложений в котлах.
При повышенном содержании фосфатов и железа в котловой воде и низкой щелочности последней на внутренних поверхностях парообразующих труб откладываются рыхлые железофосфатные накипи Fe3(РО4)2, NaFePО4, которые при обстукивании труб сравнительно легко отваливаются от стенок. Характерным для железофосфатных накипей является равномерное распределение их по всей длине трубы. На внутренней поверхности экранных труб в зонах наибольших температур факела, характеризующихся высокими местными тепловыми нагрузками, откладываются железоокисные накипи главным образом в форме магнетита Fe3O4. Находящиеся в котловой воде взвешенные частицы увеличиваются в размере за счет кристаллизации на их поверхности веществ из котловой воды, а также взаимного сцепления, образуя на внутренних поверхностях парогенератора илистые шламовые отложения. В состав котельного шлама входят углекислый кальций СаСО3, гидрокарбонат магния Mg(OH)2* MgCO3, фосфат магния Mg3(PO4)2, гидроксилапатит Ca10(PO4)6(OH)2, окислы железа Fe2О3, Fe3O4, окислы меди CuO, Cu2O, органические вещества и т. д. При наличии в котловой воде кремниевой кислоты гидроокись магния вступает с нею в соединение, образуя при этом серпентин, который обычно выпадает в форме высокодисперсного шлама:
3Mg(OH)2+2SiO2=3MgO*2SiО2*2H2О+H2О. Следует различать: а) шламы, не прикипающие к поверхностям нагрева и поэтому сравнительно легко выводимые наружу во время работы парогенератора путем периодической продувки последнего; к числу их относятся гидроксилапатит и серпентин, а также карбонат кальция в щелочной среде; б) шламы, способные при известных условиях прикипать к поверхностям нагрева и являющиеся материалом для образования так называемых вторичных накипей; к числу прикипающих шламов могут быть отнесены гидроокись магния и фосфато-магнезиальные соединения. Отсюда следует, что одной из важных задач организации рационального водного режима парогенераторов с многократной циркуляцией является создание в котловой воде таких условий, при которых накипеобразователи, проникающие в парогенератор с питательной водой, выделялись бы только в форме шлама, неспособного прикипать к стенкам труб и удаляемого из парогенератора с продувочной водой.
Основные положения. Металлы и металлические сплавы – основные конструкционные материалы для большинства отраслей народного хозяйства. Однако изделия из металлов и сплавов под действием различных физико-химических и биологических факторов разрушаются или теряют (снижают) свои потребительские качества. Такое разрушение изделий из металлов при воздействии внешней среды получило название коррозии металлов. Под термином «коррозия» подразумевают физико-химическое взаимодействие между металлом и средой, в результате которого изменяются свойства металла и часто происходит ухудшение функциональных характеристик металла, среды или включающей их технической системы.
Среда, вызывающая коррозию, называется коррозионной или агрессивной. В результате взаимодействия металла и коррозионной среды образуются химические соединения, называемые продуктами коррозии. Разрушение металлов и сплавов может происходить в результате химического, электрохимического, биологического и радиационного или механического воздействия внешней среды. Механическое разрушение конструкционных металлических материалов называют эрозией. Процесс коррозии и эрозии при эксплуатации машин и аппаратов могут протекать совместно, например, при работе насосов, мешалок (эрозионная коррозия). Способность металлов противостоять коррозионному воздействию внешней среды называют коррозионной стойкостью.
Примеси природных вод.
Примеси природных вод по степени дисперсности подразделяют на: 1. Истинно растворенные (ионно- и молекулярно-дисперсные) находятся в воде в виде отдельных ионов, молекул или их небольших агломератов размером до 1 нм dв < 10-9 м. 2. Коллоидно-дисперсные, т.е. представляют собой агломераты из большого числа молекул, размером от 1 до 100 нм; 1нм < d < 100 н м; с течением времени не отстаиваются и не отфильтровываются обычными фильтровальными материалами. 3. Грубодисперсные примеси (ГДП) – взвешенные вещества; d > 100 нм; с течением времени либо отстаиваются, либо всплывают. Длительно оставаясь во взвешенном состоянии ГДП создают мутность воды.
Минеральные примеси природных вод: 1. растворенные в воде газы (образуются при контакте с воздухом) N, O, CO2; 2. ионы: катионы и анионы а) основные катионы природных вод: Ca2+, Mg2+, Na+, в подземных водах Fe2+; б) основные анионы природных вод: HCO3-; SO42-, Cl- и немного анионов HSiO3-, NO3-, NO2-, HCO3- во многом определяют поведение различных примесей в воде;
H2CO3 может находиться в трех формах: 1. CO32- - связанная; 2. HCO3- - полусвязанная (бикарбонатион) 3. свободная угольная кислота H2CO3 ® CO2 раствор CO2 в воде.
Вещества, распадающиеся в растворах на ионы, называют электролитами. Электролитами являются соли, кислоты, основания, а также вода. Чистая вода является слабым электролитом. Диссоциация ее молекул описывается уравнением
Константа диссоциации воды в соответствии с законом действующих масс при 25ºС
где Активностью называется эффективная концентрация в растворе, которая в результате взаимодействия ионов (электростатического притяжения и отталкивания) имеет меньшее значение, чем фактическая. Активность ионов данного вида ai связана с их фактической концентрацией Ci следующим соотношением:
где
где При температуре воды 298К ε = 78,5, а коэффициент А =0,508. Ионная сила μ характеризует меру интенсивности электрического поля, возникающего в растворе из-за наличия в нем ионов, и определяется по выражению:
где Ci – концентрация данного вида ионов в растворе, моль/дм3. Из формул видно, что в разбавленных растворах на значения ионной силы и коэффициента активности влияют не индивидуальный химический характер ионов, а лишь их концентрация, заряд и температура. Так, в одном и том же растворе коэффициент активности будет иметь одно значение для одновалентных ионов, другое для двухвалентных и т.д.
Органические примеси природных вод попадают из почвы и с бытовыми стоками, их объединяют под общим названием – гумусовые, образующиеся при этом кислоты называются гуминовые, их соли – гуматы. Na+, NН4+ хорошо растворимы Ca2+, Mg2+, Fe2+- плохо растворимы. Органические вещества являются главной причиной ухудшения органолептических свойств воды, т.е. появление запахов и привкусов. Гумусовые вещества природных вод условно разделяют на три группы: 1) гуминовые кислоты С60Н52О24(СООН)4, находящиеся обычно в водоемах в коллоидной форме; 2) коллоидные соединения фульвокислот; 3) истинно растворенные соединения фульвокислот. Водород карбоксильных групп СООН гуминовых кислот может заменяться катионами с образованием гуматов. Гуматы щелочных металлов хорошо растворимы в воде, гуматы кальция и магния труднорастворимы. Гуминовые кислоты могут образовывать с гидроксидами железа комплексные соединения, частично представленные коллоидной формой. Из-за сложности индивидуальной классификации органических примесей каждого типа в практике анализа используют общую способность органических примесей окисляться под действием специфических окислителей. Этот критерий не дает точного представления о реальной концентрации органических веществ в воде, однако позволяет приближенно характеризовать и сравнивать воды различного типа.
1.8. Показатели качества воды, определяющие ее пригодность в теплоэнергетике.
Температура воды. Воды подземных источников отличаются постоянством температуры, причем с увеличением глубины залегания вод сезонные колебания температуры снижаются. Температура вод открытых водоемов претерпевает значительные изменения, связанные с нагревом и остыванием водоемов.
Цветность воды. Чистая вода, взятая в малом объеме, бесцветна. В толстом слое она имеет голубовато-зеленый оттенок. Другие оттенки свидетельствуют о наличии в ней различных растворенных и взвешенных примесей.
Изменение цветности воды в основном обусловливают органические соединения, которые в природных водах весьма разнообразны. Иногда источником окрашенных органических соединений служат промышленные и бытовые сточные воды.
Вкус и запах воды. Различают четыре вкуса природной воды: соленый, горький, сладкий и кислый. Все другие виды вкусовых ощущений называются привкусами. Запахи воды бывают естественного и искусственного происхождения. Основные положения.
Различные примеси, содержащиеся в нагреваемой и испаряемой воде, могут выделяться в твердую фазу на внутренних поверхностях парогенераторов, испарителей, паропреобразователей, подогревателей и конденсаторов паровых турбин в виде накипи, а внутри водяной массы – в виде взвешенного шлама. Нельзя, однако, провести четкую границу между накипью и шламом, так как вещества, отлагающиеся на поверхности нагрева в форме накипи, могут с течением времени превращаться в шлам и, наоборот, шлам при некоторых условиях может прикипать к поверхностям нагрева, образуя накипь. Из элементов парогенератора загрязнению внутренних поверхностей больше всего подвержены обогреваемые экранные трубы. Образование отложений на внутренних поверхностях парообразующих труб влечет за собой ухудшение теплопередачи и как следствие опасный перегрев металла труб. Коэффициенты теплопроводности различных накипей.
Даже кратковременное ухудшение коэффициента теплоотдачи от стенки к кипящей воде приводит к столь значительному росту температуры стенки трубы (500—600°С и выше), что прочность металла может оказаться недостаточной, чтобы выдержать возникшие в нем напряжения. Следствием этого являются повреждения металла, характеризующиеся появлением свищей, а нередко и разрывом труб. При резких температурных колебаниях в стенках парообразующих труб, которые могут иметь место в процессе эксплуатации парогенератора, накипь отслаивается от стенок в виде хрупких и плотных чешуек, которые заносятся потоком циркулирующей воды в места с замедленной циркуляцией. Там происходит осаждение их в виде беспорядочного скопления кусочков различных величин и формы, сцементированных шламом в более или менее плотные образования. Если в парогенераторе барабанного типа имеются горизонтальные или слабонаклонные участки парообразующих труб с вялой циркуляцией, то в них обычно происходит скопление отложений рыхлого шлама. Сужение сечения для прохода воды или полная закупорка парообразующих труб приводит к нарушению циркуляции. Для того чтобы обеспечить минимальные отложения как в зонах максимальных тепловых нагрузок парообразующих труб, так и в проточной части турбин, необходимо строго поддерживать эксплуатационные нормы допустимого содержания в питательной воде тех или иных примесей. С этой целью добавочная питательная вода подвергается глубокой химической очистке либо дистилляции на водоподготовительных установках Однако этого недостаточно, так как опасным источником загрязнения конденсата турбин накипеобразователями и натриевыми соединениями являются присосы охлаждающей воды в паровое пространство конденсатора через неплотности (места вальцовки или приварки труб) или через сквозные коррозионные свищи и трещины на стенках трубных пучков. Поэтому в процессе эксплуатации ТЭС требуется уделять большое внимание постоянному поддержанию высокой герметичности конденсатора.
Для борьбы с последствиями загрязнения конденсата турбин солями жесткости вследствие присосов в конденсаторе на ТЭС с парогенераторами барабанного типа питательная и котловая вода подвергаются систематической коррекционной обработке разнообразными реагентами (фосфаты, комплексоны и др.), обеспечивающими выпадение накипеобразователей в форме легкоподвижного неприкипающего шлама, выводимого из парогенератора с помощью его периодической продувки. В целях предотвращения образования накипных отложений в теплофикационных системах подпиточная вода подвергается умягчению либо омагничиванию с последующей термической ее дегазацией. На многих электростанциях для конденсации отработавшего в турбине пара используются оборотные системы технического водоснабжения с градирнями и брызгальными бассейнами. Основным отличием оборотной системы от прямоточной является упаривание в ней циркулирующей воды, вызывающее возрастание концентрации растворенных в ней накипеобразующих веществ, что приводит к образованию плотной накипи на охлаждаемых поверхностях. Присутствие в циркуляционной воде микроорганизмов способствует образованию на охлаждаемых поверхностях специфических отложений биологического характера.
1.2.2. Состав, структура и физические свойства отложений.
Отложения на поверхностях нагрева бывают весьма разнообразными по химическому составу, структуре, плотности и коэффициенту теплопроводности. Наряду с рыхлыми пористыми отложениями, встречаются отложения, которые по твердости и прочности связи с металлом напоминают эмали. Разнообразны также состав и физические свойства котельного шлама. Некоторые накипи состоят из нескольких слоев, которые могут отличаться друг от друга как химическим составом, так и своей структурой. Часто они образуются в результате последовательного отложения различных веществ или их смесей. Образующиеся в парогенераторах отложения могут быть по своему химическому составу подразделены на три основные группы: 1) щелочноземельные; 2) железные; 3) медные. В первую группу входят кальциевые и магниевые накипи (карбонатные, сульфатные, силикатные, фосфатные), в составе которых преобладают (до 90%) СаСО3, CaSO4, CaSiO3, 5CaO*5Si02*Н2О, Ca3(PO4)2, Mg(OH)2. Во вторую группу входят железоокисные Fe2O3, Fe3O4, железофосфатные Fe3(РО4)2, NaFePО4 и железо-силикатные Na2О* Fe2О3*SiO2 накипи. В третью группу входят отложения металлической меди и окислы меди CuO, Cu2O. Карбонатная накипь откладывается обычно в форме плотных кристаллических отложении на тех поверхностях нагрева или охлаждения, где отсутствует кипение воды, а среда нещелочная. Этими поверхностями являются водяные экономайзеры, конденсаторы турбин, водоподогреватели, питательные трубопроводы, тепловые сети и др. В условиях же кипения щелочной воды (в парогенераторах, испарителях) СаСО3 обычно выпадает в форме неприкипающего шлама. Сульфатная накипь обладает большими твердостью и плотностью. Силикат кальция образует твердую накипь, крепко пристающую к стенкам поверхности нагрева. Сложные силикатные накипи имеют разнообразный минеральный состав, так как кремниевая кислота образует накипи не только с катионами кальция и магния, но и с катионами натрия, железа и алюминия (натроферросиликаты и натроалюмосиликаты). В составе сложных силикатных накипей содержится до 40 – 50% кремниевой кислоты, 25—30% окислов железа, меди и алюминия и 5 – 10% окиси натрия. Количество же соединений щелочноземельных металлов в этих отложениях обычно не превышает нескольких процентов. Эти сложные бескальциевые силикатные накипи характеризуются разнообразием структур – от пористых и комковых отложений до твердых и плотных образований, ровным слоем покрывающих металлическую поверхность.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 1251; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.249.158 (0.057 с.) |



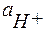 ,
,  ,
,  - соответственно активность ионов Н+, ОН- и молекул воды.
- соответственно активность ионов Н+, ОН- и молекул воды.
 - коэффициент активности ионов данного вида, который зависит от концентраций и валентностей всех ионов, находящихся в растворе, и для разбавленных растворов (до 0,1 моль/дм3) определяется по формуле Дебая – Гюккеля:
- коэффициент активности ионов данного вида, который зависит от концентраций и валентностей всех ионов, находящихся в растворе, и для разбавленных растворов (до 0,1 моль/дм3) определяется по формуле Дебая – Гюккеля: ,
, ; μ – ионная сила; zi – валентность ионов данного вида; ε – относительная диэлектрическая проницаемость; Т – температура, К.
; μ – ионная сила; zi – валентность ионов данного вида; ε – относительная диэлектрическая проницаемость; Т – температура, К.



