
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация вод по объектам их использования.
В зависимости от целевого назначения воды различают: 1. Хозяйственно-питьевую воду, а также воду, идущую для пищевой и бродильной промышленности. 2. Воду, используемую для животноводства и в сельском хозяйстве. 3. Воду для охлаждения (охлаждение элементов технологических агрегатов, охлаждение пара, жидких и газообразных продуктов в холодильниках и конденсаторах). 4. Воду для паросилового хозяйства (питания паровых котлов). 5. Воду для технологических целей промышленности. 6. Воду для заводнения нефтяных пластов. 1.5. Роль и задачи водоподготовки на ТЭС.
Надёжность, безотказность и экономичность работы теплоэнергетического оборудования во многом определяется водно-химическим режимом. Под водно-химическим режимом в собственном смысле этого слова понимают химический состав воды, используемой в качестве теплоносителя, изменение во времени химического состава воды в процессе функционирования теплоэнергетической системы, способы и режимы продувки системы и подачи в систему подпиточной воды и корректирующих добавок. Для поддержания (или, как говорят, ведения) водно-химического режима применяется совокупность различных технических решений, как то: очистка «сырой» (природной или отработанной производством) воды, состав корректирующих добавок, аппаратурное оформление и периодичность процесса их дозирования, периодичность и методики аналитического контроля состава воды, способы и аппаратурное оформление очистки и использования продувочной воды и проч. Все эти факторы вместе с собственно водно-химическим режимом образуют неразрывное целое. К водно-химическому режиму теплоэнергетических установок предъявляют много требований, основные из которых следующие: · обеспечение нормального гидродинамического режима теплоэнергетической системы; · обеспечение интенсивной и надёжной теплопередачи во время эксплуатации; · минимальную интенсивность образования отложений, нарушающих гидродинамический режим или теплообмен; · минимальная коррозия теплоэнергетического оборудования; · поддержание физико-химических характеристик теплоносителя в пределах, обеспечивающих нормальное функционирование системы, включая испарение и сепарацию пара в паровом котле;
· отсутствие отрицательного воздействия на окружающую среду вследствие возможной утечки воды или сброса воды при продувке; · безопасность и безвредность для потребителей тепловой энергии, пара и горячей воды. Очевидно, что далеко не всякий химический состав воды и не любая совокупность устройств и способов её обработки может удовлетворить всем вышеперечисленным требованиям. В частности, идеально чистая вода не удовлетворяет этим требованиям, так как она вступает в реакцию с железом: 2H2O + Fe = H2 + Fe(OH)2, что приводит к коррозионному повреждению стального теплоэнергетического оборудования. Поэтому для безаварийной и экономичной работы теплоэнергетических систем необходимо поддерживать содержание примесей и корректирующих добавок в воде в заданных пределах. Нарушение водно-химического режима может приводить к частичным (необеспечение заданной теплопроизводительности или экономичности) или полным отказам теплоэнергетического оборудования, а также к авариям и катастрофам. Например, превышение допустимого содержания соединений щёлочноземельных металлов (кальция и магния) при недостатке необходимых противонакипных корректирующих добавок приводит к образованию слоя накипи на поверхностях теплопередачи, особенно в зонах высокого теплового напряжения, и к скоплению шламов в застойных зонах.
Во-вторых, повышается температура металла труб, что может привести к их пережогу. В-третьих, отложения в проточной части паровых турбин приводят к уменьшению КПД и мощности турбины. Соответственно, наличие отложений в котлах и турбинах вызывает необходимость их очистки. А это трудоемкая и дорогостоящая операция, увеличивающая простои основных агрегатов станции.
Повышение содержания растворённых в воде агрессивных газов (углекислого газа и кислорода) приводит к коррозии теплоэнергетического оборудования. Так как продукты коррозии занимают больший объём и имеют более низкую теплопроводность, чем исходный металл, коррозия, также как и накипеобразование, приводит к постепенному снижению коэффициента теплопередачи и повышению гидравлического сопротивления водяного тракта. Однако коррозия приводит к утоньшению и изъязвлению металлических деталей теплоэнергетического оборудования и теплотрасс и к разрыву поверхностей нагрева котла. являются: 1. Предотвращение образования отложений на внутренних поверхностях теплопередающих труб и в проточной части паровых турбин. 2. Защита от коррозии конструкционных материалов оборудования ТЭС и теплофикационных систем.
1.6. Источники поступления примесей в пароводяной тракт ТЭС. 1. Убыль пара и конденсата в цикле компенсируется добавочной водой, следовательно, нормальная организация водного режима невозможна без специальной очистки этой воды. 2. Примеси попадают в пароводяной тракт с присосами охлаждающей воды в конденсаторах турбин. Поскольку эта вода имеет значительное солесодержание, то даже незначительное количество воды может внести значительное количество примесей. 3. Кроме образования отложений примеси вызывают коррозию оборудования, а процессы коррозии в свою очередь являются дополнительным источником поступления примесей в пароводяной тракт. При низких и средних давлениях в барабанных котлах примеси попадают в пар только вследствие уноса капелек котловой воды. При высоких давлениях примеси начинают растворяться в паре и тем интенсивнее, чем выше давление, и в первую очередь кремниевая кислота (H2SiO3). Поэтому с ростом давления значительно повышаются требования к качеству питательной, а следовательно, и добавочной воды. Требования к надежности водного режима сформулированы в виде «Норм водного режима», и в правилах технической эксплуатации электрических станций и сетей (ПТЭ). Огромное разнообразие исходных природных вод и различие в требованиях к конечному продукту вызвали к жизни большое число методов и схем ВПУ.
Примеси природных вод.
Примеси природных вод по степени дисперсности подразделяют на: 1. Истинно растворенные (ионно- и молекулярно-дисперсные) находятся в воде в виде отдельных ионов, молекул или их небольших агломератов размером до 1 нм dв < 10-9 м. 2. Коллоидно-дисперсные, т.е. представляют собой агломераты из большого числа молекул, размером от 1 до 100 нм; 1нм < d < 100 н м; с течением времени не отстаиваются и не отфильтровываются обычными фильтровальными материалами. 3. Грубодисперсные примеси (ГДП) – взвешенные вещества; d > 100 нм; с течением времени либо отстаиваются, либо всплывают. Длительно оставаясь во взвешенном состоянии ГДП создают мутность воды.
Минеральные примеси природных вод: 1. растворенные в воде газы (образуются при контакте с воздухом) N, O, CO2; 2. ионы: катионы и анионы а) основные катионы природных вод: Ca2+, Mg2+, Na+, в подземных водах Fe2+;
б) основные анионы природных вод: HCO3-; SO42-, Cl- и немного анионов HSiO3-, NO3-, NO2-, HCO3- во многом определяют поведение различных примесей в воде;
H2CO3 может находиться в трех формах: 1. CO32- - связанная; 2. HCO3- - полусвязанная (бикарбонатион) 3. свободная угольная кислота H2CO3 ® CO2 раствор CO2 в воде.
Вещества, распадающиеся в растворах на ионы, называют электролитами. Электролитами являются соли, кислоты, основания, а также вода. Чистая вода является слабым электролитом. Диссоциация ее молекул описывается уравнением
Константа диссоциации воды в соответствии с законом действующих масс при 25ºС
где Активностью называется эффективная концентрация в растворе, которая в результате взаимодействия ионов (электростатического притяжения и отталкивания) имеет меньшее значение, чем фактическая. Активность ионов данного вида ai связана с их фактической концентрацией Ci следующим соотношением:
где
где При температуре воды 298К ε = 78,5, а коэффициент А =0,508. Ионная сила μ характеризует меру интенсивности электрического поля, возникающего в растворе из-за наличия в нем ионов, и определяется по выражению:
где Ci – концентрация данного вида ионов в растворе, моль/дм3. Из формул видно, что в разбавленных растворах на значения ионной силы и коэффициента активности влияют не индивидуальный химический характер ионов, а лишь их концентрация, заряд и температура. Так, в одном и том же растворе коэффициент активности будет иметь одно значение для одновалентных ионов, другое для двухвалентных и т.д.
Органические примеси природных вод попадают из почвы и с бытовыми стоками, их объединяют под общим названием – гумусовые, образующиеся при этом кислоты называются гуминовые, их соли – гуматы. Na+, NН4+ хорошо растворимы Ca2+, Mg2+, Fe2+- плохо растворимы. Органические вещества являются главной причиной ухудшения органолептических свойств воды, т.е. появление запахов и привкусов. Гумусовые вещества природных вод условно разделяют на три группы:
1) гуминовые кислоты С60Н52О24(СООН)4, находящиеся обычно в водоемах в коллоидной форме; 2) коллоидные соединения фульвокислот; 3) истинно растворенные соединения фульвокислот. Водород карбоксильных групп СООН гуминовых кислот может заменяться катионами с образованием гуматов. Гуматы щелочных металлов хорошо растворимы в воде, гуматы кальция и магния труднорастворимы. Гуминовые кислоты могут образовывать с гидроксидами железа комплексные соединения, частично представленные коллоидной формой. Из-за сложности индивидуальной классификации органических примесей каждого типа в практике анализа используют общую способность органических примесей окисляться под действием специфических окислителей. Этот критерий не дает точного представления о реальной концентрации органических веществ в воде, однако позволяет приближенно характеризовать и сравнивать воды различного типа.
1.8. Показатели качества воды, определяющие ее пригодность в теплоэнергетике.
|
||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 667; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.108.241 (0.031 с.) |
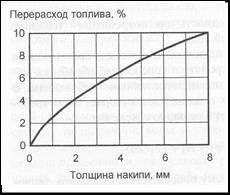 Во-первых, отложения на поверхностях нагрева вызывают ухудшение теплопередачи, что приводит к росту температуры уходящих из котельного агрегата продуктов сгорания органического топлива, следовательно к понижению КПД котла. Эти явления могут приводить к постепенному снижению коэффициента теплопередачи, перерасходу топлива и повышению гидравлического сопротивления водяного тракта (частичный отказ).
Во-первых, отложения на поверхностях нагрева вызывают ухудшение теплопередачи, что приводит к росту температуры уходящих из котельного агрегата продуктов сгорания органического топлива, следовательно к понижению КПД котла. Эти явления могут приводить к постепенному снижению коэффициента теплопередачи, перерасходу топлива и повышению гидравлического сопротивления водяного тракта (частичный отказ).


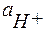 ,
,  ,
,  - соответственно активность ионов Н+, ОН- и молекул воды.
- соответственно активность ионов Н+, ОН- и молекул воды.
 - коэффициент активности ионов данного вида, который зависит от концентраций и валентностей всех ионов, находящихся в растворе, и для разбавленных растворов (до 0,1 моль/дм3) определяется по формуле Дебая – Гюккеля:
- коэффициент активности ионов данного вида, который зависит от концентраций и валентностей всех ионов, находящихся в растворе, и для разбавленных растворов (до 0,1 моль/дм3) определяется по формуле Дебая – Гюккеля: ,
, ; μ – ионная сила; zi – валентность ионов данного вида; ε – относительная диэлектрическая проницаемость; Т – температура, К.
; μ – ионная сила; zi – валентность ионов данного вида; ε – относительная диэлектрическая проницаемость; Т – температура, К.



