Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Системы транспорта митохондрийСодержание книги Поиск на нашем сайте
Внутренняя бйслойная митохондриальная мембрана свободно проницаема для незаряженных небольших молекул, таких, как кислород, вода, СО2 и NH3, а также для монокарбоновых кислот, таких, как 3-гидроксимасляная, ацетоуксусная и уксусная. Длинноцепочечные жирные кислоты транспортируются в митохондрии с помощью карнитиновой системы. Имеется также специальный переносчик пирувата, функционирующий по принципу симпорта, использующего градиент протонов с наружной на внутреннюю поверхность митохондриальной мембраны. Транспорт дикарбоксилатных и трикарбоксилатных анионов, а также аминокислот осуществляется с помощью специальных систем переноса, облегчающих их прохождение через мембрану. Монокарбоновые кислоты легче проникают через мембрану вследствие меньшей степени их диссоциации; недиссоциированная форма кислоты имеет большую растворимость в липидах, и, как полагают, именно в этой форме монокарбоновые кислоты проходят через липидную мембрану. Транспорт ди- и трикарбоксилатных анионов тесно связан с транспортом неорганического фосфата, который легко проникает через мембрану в форме ионов Н2РО4- в обмен на ОН-. Малат переносится системой транспорта дикарбоксилатов в обмен на перенос неорганического фосфата в обратном направлении. Перенос цитрата, изоцитрата и цис-аконитата системой транспорта трикарбоновых кислот происходит в обмен на перенос малата в обратном направлении. α-Кетоглутарат также поступает в обмен на малат. Таким образом, в результате работы обменных механизмов поддерживается осмотическое равновесие. Следует отметить, что перенос цитрата через митохондриальную мембрану зависит не только от транспорта малата, но также и от транспорта неорганического фосфата. Переносчик адениновых нуклеотидов обменивает АТР на ADP, но не на AMP. Жизненно важной задачей является обеспечение выхода АТР из митохондрий для последующего использования вне митохондрий и одновременного притока ADP для образования АТР внутри митохондрий. Ионы Na+ могут обмениваться на ионы Н+ за счет градиента протонов. Полагают, что при активном транспорте ионов Са2+ внутрь митохондрий происходит перенос единичного положительного заряда на каждый ион, что, возможно, связано с обменом Са2+/Н+. Выход кальция из митохондрии облегчается при обмене его на Na+. | Пути поступления электронов и протонов в ЦПЭ от первичных доноров:
 Сопряжение дыхания и синтеза АТФ в митохондриях:
Сопряжение дыхания и синтеза АТФ в митохондриях:
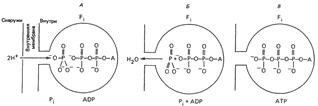
 Сопряжение переноса электронов с синтезом АТР в свете хемиосмотической гипотезы.
Согласно хемиосмотической гипотезе энергия переноса электронов передается на синтез АТР через протонный градиент.
Сопряжение переноса электронов с синтезом АТР в свете хемиосмотической гипотезы.
Согласно хемиосмотической гипотезе энергия переноса электронов передается на синтез АТР через протонный градиент.


| ||||||||
| 5. Окислительное фосфорилирование, коэффициент Р/О. Дыхательный контроль. Ингибиторы дыхательной цепи и разобщители с окислительным фосфорилированием. Энергетический обмен и теплопродукция | ||||||||||
| Окислительное фосфорилирование, коэффициент Р/О Фосфорилирование ADP – это синтез АТР (суть процесса рассматривалась ранее). Окисление молекулы NADH в ЦПЭ сопровождается образованием 3 молекул АТР. Электроны от FAD-зависимых дегидрогеназ поступают в ЦПЭ на KoQ, минуя первый пункт сопряжения. Поэтому образуется только 2 молекулы АТР. Отношение количества фосфорной кислоты (Р), использованной на фосфорилирование ADP, к атому кислорода (О), поглощённого в процессе дыхания, называют коэффициентом окислительного фосфорилирования и обозначают как Р/О. Для NADH Р/О = 3, для сукцината Р/О = 2. Эти величины отражают теоретический максимум синтеза АТР, фактически эта величина меньше. Дыхательный контроль Общее содержание АТР в организме 30-50 г, но каждая молекула АТР в клетке «живёт» меньше минуты. В сутки у человека синтезируется 40-60 кг АТР и столько же распадается. Скорость дыхания митохондрий может контролироваться концентрацией ADP. Это обусловлено тем, что окисление и фосфорилирование жестко сопряжены, т.е. функционирование дыхательной цепи не может осуществляться, если оно не сопровождается фосфорилированием ADP. Чане и Уильяме предложили рассматривать 5 состояний, при которых скорость дыхания митохондрий лимитируется определенными факторами (таблица → → → →). Обычно большая часть клеток, находящихся в покоящемся состоянии, пребывает в состоянии 4, при котором скорость дыхания определяется доступностью ADP. Энергия, необходимая для совершения работы, поставляется за счет превращения АТР в ADP; в результате создаются условия для увеличения скорости дыхания, что в свою очередь приводит к восполнению запасов АТР (рисунок → → → →). Очевидно, что при определенных условиях на скорость работы дыхательной цепи может влиять и концентрация неорганического фосфата. При повышении скорости дыхания (вызванном, например, физической работой) клетка приближается к состоянию 3 или состоянию 5: либо исчерпываются возможности дыхательной цепи, либо величина Ро опускается ниже значения Км для цитохрома а3 Скорость-лимитирующим фактором может оказаться ATP/ADP-транслокатор, обеспечивающий поступление ADP из цитозоля в митохондрии. Таким образом, механизм, с помощью которого улавливается свободная энергия окисления пищевых продуктов, является ступенчатым, эффективным (40-45%) и регулируемым, а не взрывоподобным, неэффективным и неконтролируемым. Часть свободной энергии, которая не улавливается в форме высокоэнергетических фосфатов, освобождается в форме теплоты. Это совсем не означает, что она пропадает напрасно – у теплокровных животных она используется для поддержания температуры тела. Ингибиторы дыхательной цепи и разобщители с окислительным фосфорилированием Значительная информация о дыхательной цепи была получена при использовании различных ингибиторов; предполагаемые места их действия показаны на рисунке. Ингибиторы можно разделить на 3 группы: 1) ингибиторы собственно дыхательной цепи, 2) ингибиторы окислительного фосфорилирования, 3) разобщители окислительного фосфорилирования. Ингибиторы, блокирующие дыхательную цепь, по-видимому, действуют в трех местах. Одно из них ингибируется барбитуратами (например, амобарбиталом), а также антибиотиком пиерицидином А и ротеноном. Эти ингибиторы препятствуют окислению субстратов, которые поставляют восстановительные эквиваленты в дыхательную цепь при участии NAD-зависимых дегидрогеназ, примером таких субстратов является гидроксибутират. Димеркапрол и антимицин А ингибируют дыхательную цепь на участке между цитохромом b и цитохромом с. Классические яды – H2S, окись углерода и цианид – ингибируют цитохромоксидазу. Карбоксин и TTFA (теноилтрифторацегон) специфически ингибируют переход восстановительных эквивалентов от сукцинатдегидрогеназы на кофермент Q, а малонат является конкурентным ингибитором сукцинатдегидрогеназы. Антибиотик олигомицин полностью блокирует окисление и фосфорилирование в интактных митохондриях. Однако если вместе с олигомицином добавить к системе разобщитель динитрофенол, то окисление протекает, но без фосфорилирования. Это означает, что олигомицин не действует непосредственно на дыхательную цепь, а подавляет стадию фосфорилирования. Атрактилозид ингибирует окислительное фосфорилирование, блокируя транспорт адениновых нуклеотидов через внутреннюю митохондриальную мембрану. Он ингибирует транспорт ADP в митохондрии и выход АТР из митохондрий. Разобщители нарушают систему сопряжения процессов окисления в дыхательной цепи и фосфорилирования. В этих условиях процесс дыхания происходит неконтролируемым образом, поскольку концентрации ADP или Р, не являются лимитирующими. Чаще всего в качестве разобщителя используют 2,4-динитрофенол. Аналогичное действие оказывает ряд других соединений: динитрокрезол, пентахлорфенол, СССР (карбонилцианид- м -хлорфенилгидразон). Последний по эффективности в 100 раз превосходит динитрофенол. | Состояния дыхательного контроля
 Роль ADP в дыхательном контроле
Роль ADP в дыхательном контроле

 Предполагаемые участки ингибирования (Θ) дыхательной цепи специфическими лекарственными веществами, химическими реагентами и антибиотиками. Указаны участки, где предположительно происходит сопряжение с фосфорилированием. BAL – димеркапрол; TTFA – хелатобразующий реагент на железо. Комплекс I – NADH: убихинон-оксидоредуктаза; комплекс II – сукцинат: убихинон-оксидоредуктаза; комплекс III – убихинол: феррицитохром с -оксидоредуктаза; комплекс IV – ферроцитохром с: кислород-оксидоредуктаза. FeS – железо-серный белок; Q—убихинон.
АТФ-цикл и теплопродукция
Предполагаемые участки ингибирования (Θ) дыхательной цепи специфическими лекарственными веществами, химическими реагентами и антибиотиками. Указаны участки, где предположительно происходит сопряжение с фосфорилированием. BAL – димеркапрол; TTFA – хелатобразующий реагент на железо. Комплекс I – NADH: убихинон-оксидоредуктаза; комплекс II – сукцинат: убихинон-оксидоредуктаза; комплекс III – убихинол: феррицитохром с -оксидоредуктаза; комплекс IV – ферроцитохром с: кислород-оксидоредуктаза. FeS – железо-серный белок; Q—убихинон.
АТФ-цикл и теплопродукция

| |||||||||
| 6. Активные формы кислорода: образование, токсическое действие. Перекисное окисление мембранных липидов. Механизмы защиты от токсического действия кислорода. Прооксиданты и антиоксиданты | ||||||||||
Образование токсичных форм кислорода в ЦПЭ
В ЦПЭ поглощается около 90 % поступающего в клетки О2. Остальная часть О2 используется в других окислительно-восстановительных реакциях. Ферменты, участвующие в окислительно-восстановительных реакциях с использованием кислорода, делятся на 2 группы: оксидазы и оксигеназы.
Оксидазы используют молекулярный кислород только в качестве акцептора электронов, восстанавливая его до Н2О или Н2О2.
Оксигеназы включают один (монооксигеназы) или два (диоксигеназы) атома кислорода в образующийся продукт реакции.
Хотя эти реакции не сопровождаются синтезом АТФ, они необходимы для многих специфических реакций в обмене аминокислот, синтезе жёлчных кислот и стероидов, в реакциях обезвреживания чужеродных веществ в печени.
В большинстве реакций с участием молекулярного кислорода его восстановление происходит поэтапно с переносом одного электрона на каждом этапе. При одноэлектронном переносе происходит образование промежуточных высокореактивных форм кислорода.
В невозбуждённом состоянии кислород не токсичен. Образование токсических форм кислорода связано с особенностями его молекулярной структуры. О2 содержит 2 неспаренных электрона с параллельными спинами, которые не могут образовывать термодинамически стабильную пару и располагаются на разных орбиталях. Каждая из этих орбиталей может принять ещё один электрон.
Полное восстановление О2 происходит в результате 4 одноэлектронных переходов:
 Супероксид, пероксид и гидроксильный радикал – активные окислители, что представляет серьёзную опасность для многих структур клетки.
Активные формы кислорода могут отщеплять электроны от многих соединений, превращая их в новые свободные радикалы, инициируя цепные окислительные реакции.
Большая часть активных форм кислорода образуется при переносе электронов в ЦПЭ, прежде всего при функционировании QН2-дегидрогеназного комплекса. Это происходит в результате неферментативного переноса («утечки») электронов с QН2 на кислород (рисунок → → → →)
Супероксид, пероксид и гидроксильный радикал – активные окислители, что представляет серьёзную опасность для многих структур клетки.
Активные формы кислорода могут отщеплять электроны от многих соединений, превращая их в новые свободные радикалы, инициируя цепные окислительные реакции.
Большая часть активных форм кислорода образуется при переносе электронов в ЦПЭ, прежде всего при функционировании QН2-дегидрогеназного комплекса. Это происходит в результате неферментативного переноса («утечки») электронов с QН2 на кислород (рисунок → → → →)
| Повреждающее действие свободных радикалов на компоненты клетки
 1 – разрушение белков; 2 – повреждение ЭПР; 3 – разрушение ядерной мембраны и повреждение ДНК; 4 – разрушение мембраны митохондрий; 5 – перекисное окисление липидов (ПОЛ) клеточной мембраны; 6,7,8 – проникновение в клетку воды и ионов.
Образование супероксида в ЦПЭ
«Утечка» электронов в ЦПЭ может происходить при переносе электронов с участием коэнзима Q. При восстановлении убихинон превращается в анион-радикал семихинона. Этот радикал неферментативно взаимодействует с О2 с образованием супероксидного радикала.
1 – разрушение белков; 2 – повреждение ЭПР; 3 – разрушение ядерной мембраны и повреждение ДНК; 4 – разрушение мембраны митохондрий; 5 – перекисное окисление липидов (ПОЛ) клеточной мембраны; 6,7,8 – проникновение в клетку воды и ионов.
Образование супероксида в ЦПЭ
«Утечка» электронов в ЦПЭ может происходить при переносе электронов с участием коэнзима Q. При восстановлении убихинон превращается в анион-радикал семихинона. Этот радикал неферментативно взаимодействует с О2 с образованием супероксидного радикала.

|
|
| Поделиться: |