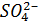Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Изучение свойств кислот, оснований и солейСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте В СВЕТЕ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ Цель: закрепить знания о свойствах электролитов, развивать умение исследовать свойства веществ, анализировать результаты химического эксперимента, делать выводы, следующие из проведенных экспериментальных исследований. Оборудование: пробирки, рН-шкала, индикаторная бумага. Реактивы: железный гвоздь, медь, цинк; соляная кислота, карбонат кальция, растворы карбоната натрия, сульфата калия, гидроксида натрия, хлорида железа (III), хлорида бария, сульфата меди (II), хлорида натрия, нитрата серебра, серной кислоты, индикаторов. G Соблюдайте правила техники безопасности! Ход работы I. Изучение свойств кислот Задание 1. Взаимодействие кислот с металлами и солями 1. Исследуйте, с какими из предложенных веществ (медь, цинк, карбонат натрия, сульфат калия, нитрат серебра, хлорид бария – взаимодействует соляная кислота. Результаты исследований занесите в таблицу 1. II. Изучение свойств щелочей Задание 1. Взаимодействие щелочей с солями. 1. В пробирку налейте раствор гидроксида кальция объемом 1 – 2 см3. И прилейте к нему примерно такой же объем карбоната натрия. Наблюдения занесите в таблицу 2. Задание 2. Взаимодействие щелочей с солями с образованием нерастворимых оснований. 1. В пробирку с раствором хлорида железа (III) по каплям прибавляйте раствор гидроксида натрия до появления признаков реакции. Наблюдения занесите в таблицу 2. III. Изучение свойств солей Задание. Взаимодействие солей со сложными веществами 1. Проведите химические реакции, позволяющие осадить катионы металла и анионы кислотного остатка, которые содержатся в растворе сульфата меди (II). Наблюдения занесите в таблицу 3.
Таблица 1
Таблица 2
Таблица 3
Вывод: 1. Сделайте вывод о свойствах кислот как электролитов. ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 2. Сделайте вывод о свойствах щелочей как электролитов. ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 3. Сделайте вывод о том, с помощью каких реакций можно осадить катионы меди (II) и сульфат - анионы из раствора сульфата меди (II). _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Практическая работа №7 «___» ____________________20___г.
РЕШЕНИЕ ЭКСПЕРИМЕНТАЛЬНЫХ ЗАДАЧ ПО ТЕМЕ «НЕМЕТАЛЛЫ» Цель: закрепить знания о свойствах неметаллов, развивать умение исследовать свойства веществ, анализировать результаты химического эксперимента, делать выводы, следующие из проведенных экспериментальных исследований. Оборудование: пробирки, спиртовка, держатель для пробирок. Реактивы: рН-шкала, универсальная индикаторная бумага; соляная кислота, сульфат натрия, карбонат натрия; растворы карбоната натрия, сульфата натрия, гидроксида натрия, хлорида бария, серной кислоты, нитрата серебра, фенолфталеин. G Соблюдайте правила техники безопасности! Ход работы Задача 1 В пронумерованных пробирках находятся карбонат натрия и сульфат натрия. При помощи качественных реакций определите выданные вам вещества. Перед началом работы проверьте выданные вам соли на растворимость в воде. Затем проведите качественные реакции на ионы, находящиеся в растворе. Результаты исследований занесите в таблицу 1, указав признаки химических реакций. Составьте уравнения соответствующих реакций в молекулярном и ионном виде. Если реакция не возможна, в соответствующей графе поставьте прочерк. Задача 2 Проведите реакции, позволяющие доказать качественный состав серной кислоты. Исследуйте рН раствора. Составьте уравнения реакции определения сульфат-иона в растворе. Результаты исследований занесите в таблицу 2. Задача 3 1) Нейтрализуйте выданный вам раствор гидроксида натрия раствором соляной кислоты (в присутствии индикатора фенолфталеина). Составьте уравнение химической реакции в молекулярном и ионном виде. Результаты занесите в таблицу 3. 2) Рассчитайте, хватит ли раствора соляной кислоты массой 60 г с массовой долей HCl 10% для нейтрализации гидроксида натрия в растворе 70 г с массойвой долей NaOH 5%.
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Задача 4. К раствору массой 200 г с массовой долей HCl 7,3% добавили 150 г раствора, содержащего 8% гидроксида натрия. Рассчитайте химические количества исходных веществ и массу образовавшейся соли. __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ ______________________________________________________________________ Таблица 1
Таблица 2
Таблица 3
Практическая работа № 8 «____» ________________ 20___ г.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-14; просмотров: 1569; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.008 с.) |