Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Управление обазования гомельского облисплкомаСодержание книги
Поиск на нашем сайте УПРАВЛЕНИЕ ОБАЗОВАНИЯ ГОМЕЛЬСКОГО ОБЛИСПЛКОМА УЧРЕЖДЕНИЕ ОБРАЗОВАНИЯ «МОЗЫРСКИЙ ГОСУДАРСТВЕННЫЙ ПОЛИТЕХНИЧЕСКИЙ КОЛЛЕДЖ» ТЕТРАДЬ ДЛЯ ПРАКТИЧЕСКИХ РАБОТ ПО ХИМИИ УЧАЩЕГОСЯ ГРУППЫ __________________ __________________________________________ ПРЕПОДАВАТЕЛЬ ______________ Саяпина Н.В.
Мозырь Общие правила безопасного поведения в кабинете химии
1. Прежде чем приступить к выполнению практических работ, необходимо подробно изучить порядок их проведения и далее при выполнении строго следовать указаниям, приведенным при описании опытов. 2. Следует строго соблюдать все указания преподавателя по безопасному обращению с приборами и реактивами. 3. В кабинете химии ЗАПРЕЩАЕТСЯ: Fпринимать пищу и напитки; Fпробовать реактивы на вкус; Fиспользовать химическую посуду не по назначению; Fбрать руками твердые сыпучие реактивы (для этого используются специальные ложечки, совочки и шпатели); Fоставлять открытыми склянки с реактивами; Fвыливать и высыпать избыток реактивов обратно в сосуд с основным количеством реактива; Fвыливать содержимое пробирок в раковину после проведения эксперимента; Fсамостоятельно проводить опыты, не предусмотренные практической работой; Fпри нагревании жидкостей направлять отверстие сосуда на себя или на соседа; Fзажигать спиртовку от зажигалки или другой спиртовки (для этого используют зажженную лучину или спички); Fзадувать пламя спиртовки (гашение пламени спиртовки производится с помощью специального колпачка); Fрезко вдыхать пары вещества при обнаружении его по запаху (для этого необходимо осторожно направит поток газа от отверстия пробирки к себе); Fвыбрасывать в урну использованные фильтры, реактивы, битое стекло, обрывки бумаги и т.п. (перечисленные материалы собираются в специально отведенные емкости). 4. Если вы случайно разлили (рассыпали) реактивы, или реактив попал на кожу или одежду, необходимо об этом сразу сообщить преподавателю или лаборанту и далее следовать их указаниям. 5. По окончании опытов рабочее место необходимо привести в порядок и вымыть руки с мылом. Практическая работа № 1 «____»_____________________20____ г.
ПОЛУЧЕНИЕ ЭТИЛЕНА И ИЗУЧЕНИЕ ЕГО СВОЙСТВ Цель: получить лабораторным способом этилен и исследовать его свойства. Оборудование: лабораторный штатив, штатив с пробирками, пробка с газоотводной трубкой, спиртовка. Реактивы: смесь этанола и концентрированной серной кислоты, иодная вода (с массовой долей 1 – 3%), раствор перманганата калия (с массовой долей 1 – 3%), центры кипения (кисочки фарфора или пемзы).
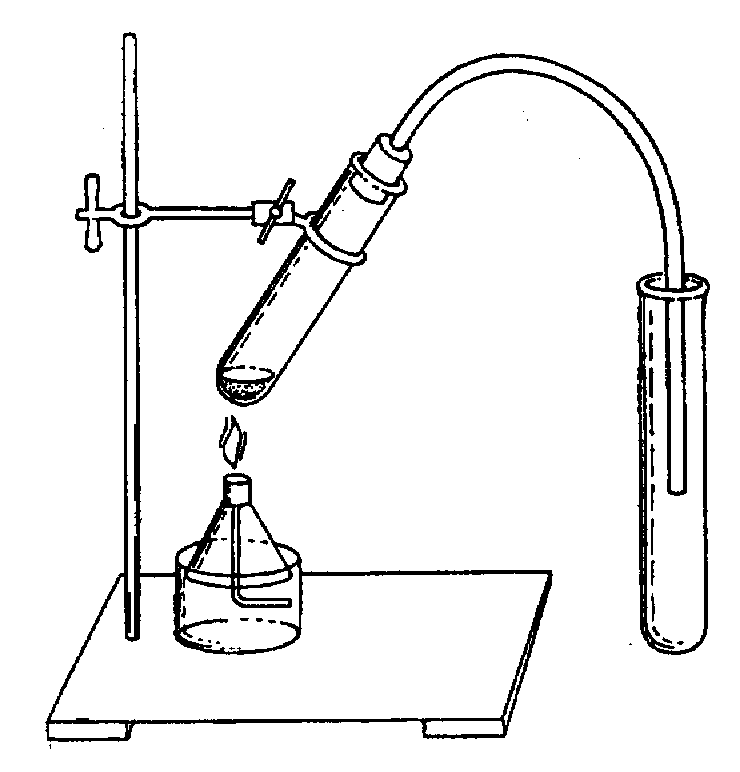
G Соблюдайте правила техники безопасности! Ход работы Задание 1. Получение этилена 1. Поместите в пробирку с заранее приготовленной преподавателем смесью этилового спирта и концентрированной серной кислоты несколько крупинок фарфора для равномерного кипения смеси при нагреванию 2. Соберите прибор для получения этилена как показано на рисунке.
3. Нагревайте пробирку со смесью в пламени спиртовки до появления пузырьков газа в пробирке с иодной водой. Задание 2. Изучение химических свойств этилена. 1. Пропустите выделяющийся газ сначала в пробирку с иодной водой, опустив свободный конец газоотводной трубки до дна пробирки (но, не касаясь дна), до изменения окраски раствора, и затем сразу же – через раствор перманганата калия в другой пробирке – до изменения окраски раствора. 2. Достаньте из прибора пробирка с обесцвеченным раствором перманганата калия, поверните газоотводную трубку отверстием вверх и подожгите выделяющийся этилен. 3. Отметьте цвет пламени.
Сделайте вывод о лабораторном способе поучения этилена, используемом в данной работе и причинах обесцвечивания йодной воды и раствора перманганата калия. _________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Решите задачу: Определите объем этилена, который можно получить путем дегидратации этанола массой 110 г в присутствии концентрированной серной кислоты. Выход продукта реакции составляет 65%.
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Практическая работа № 2 «____»_____________________20____ г.
ПОЛУЧЕНИЕ УКСУСНОЙ КИСЛОТЫ И ИССЛЕДОВАНИЕ ЕЕ СВОЙСТВ Цель: получить лабораторным способом уксусную кислоту и исследовать ее свойства. Оборудование: лабораторный штатив, штатив с пробирками, пробка с газоотводной трубкой, ложечка, спиртовка, рН-шкала, универсальная индикаторная бумага). Реактивы: растворы уксусной кислоты (с массовой долей 6 – 9%), серной кислоты (с массовой долей 10%), гидроксида натрия (с массовой долей 5%); ацетат натрия (кристаллический), гидрокарбонат натрия (кристаллический), магний, оксид магния. G Соблюдайте правила техники безопасности! Ход работы Задание 1. Получение уксусной кислоты. 1. Поместите в пробирку ложечку кристаллического ацетата натрия. 2. Прибавьте по каплям раствор серной кислоты, чтобы он слегка смочил соль. 3. Соберите прибор для получения уксусной кислоты, как показано на рисунке.
4. Нагревайте смесь веществ в пламени спиртовки до появления капелек конденсата в пробирке-приемнике. 5. Отметьте появление запаха образующейся кислоты. 6. Составьте уравнение реакции получения уксусной кислоты. 7. Заполните таблицу.
Задание 2. Исследование химических свойств уксусной кислоты. 1. В две чистые пробирки налейте по 0,5 – 1 мл раствора уксусной кислоты, выданного для проведения опыта. 2. В одну пробирку поместите полоску универсальной индикаторной бумаги, затем нейтрализуйте кислоту раствором щелочи. 3. В другую пробирку внесите щепотку порошка магния. 4. Отметьте явления, происходящие в пробирках. 5. В две чистые пробирки налейте по 0,5 – 1 мл выданного раствора уксусной кислоты. 6. В одну пробирку добавьте щепотку порошка оксида магния. 7. В другую пробирку добавьте щепотку кристаллического гидрокарбоната натрия. 8. Отметьте явления, происходящие в пробирках. 9. Составьте соответствующие уравнения реакций в молекулярном и ионном виде. Дайте названия основным продуктам реакции. 10. Заполните таблицу.
Сделайте вывод о способе получения уксусной кислоты в лаборатории и кислотно-основных свойствах уксусной кислоты. ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Практическая работа № 3 «___»________________20____ г. Ход работы Задание 1. Докажите опытным путем, что в пробирке в растворе содержится крахмал. Задание 2. В двух пронумерованных пробирках (1, 2) находятся бесцветные растворы глюкозы и глицерина. Определите, в какой пробирке находится каждое из веществ. Задание 3. Получите ацетат магния двумя способами. Задание 4. В трех пронумерованных пробирках (3, 4, 5) находятся бесцветные растворы уксусной кислоты, синтетического моющего средства и мыла. Определите, в какой пробирке находится каждое из веществ.
Практическая работа № 4 «___»__________________ 20___ г.
Ход работы Задание 1. Докажите опытным путем, что прозрачный раствор содержит белок. Задание 2. Докажите опытным путем, что в составе молекул глюкозы имеются функциональные группы двух различных видов. Задание 3. В пронумерованных пробирках (1, 2, 3) находятся бесцветные растворы мыла, глицерина и крахмальный клейстер. Определите опытным путем каждое из предложенных веществ. Задание 4 Опишите, с помощью каких реакций можно доказать, что аминоуксусная кислота обладает амфотерными свойствами.
Практическая работа № 5 «____» ____________________ 20_____ г. ХИМИЧЕСКИЕ РЕАКЦИИ Цель: закрепить знания о классификации, условиях протекания химических реакций, развивать умения практически осуществлять химические реакции. Оборудование: пробирки, спиртовка, держатель для пробирок, газоотводная трубка, ложка для сжигания веществ. Реактивы: цинк, медь (проволока), углерод (уголь), растворы соляной кислоты, гидроксида натрия, серной кислоты, хлорида бария, сульфата меди (II), железный гвоздь, фенолфталеин. G Соблюдайте правила техники безопасности! Ход работы 1. Проведите возможные химические реакции между веществами. 2. Составьте уравнения проведенных химических реакций, дайте им характеристику по следующему плану: 1) Соотношение числа и состава исходных веществ и продуктов реакции (соединения, разложения, замещения, обмена); 2) Изменение степени окисления атомов (окислительно-восстановительная (ОВР), без изменения степени окисления); 3) По выделению или поглощению энергии (экзотермическая, эндотермическая); 4) Направлению протекания реакции (обратимая, необратимая); 5) Участию катализатора (каталитическая, некаталитическая); 6) Наличию раздела фаз в реакционной среде (гомогенная, гетерогенная). 3. Для уравнений окислительно-восстановительных реакций составьте электронный баланс. 4. Результаты опытов занесите в таблицу.
5. Сделайте вывод. ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Задания для самостоятельного решения 1. Укажите агрегатное состояние при комнатной температуре следующих веществ: H2O (______), CO2 (______), CaCO3 (____), Zn (____), Cu (_____), C (_____), Na2CO3(___), H2SO4(_____). 2. Определите степени окисления атомов в следующих веществах:
HCl, H2SO4, Zn, ZnSO4, ZnCl2, CO2, H2O, CuO, Na2CO3, Na2SO4, CuSO4.
3. В уравнении реакции H2SO4 (…) + Zn(…) → ZnSO4(…) + H2(…)↑+Q укажите агрегатное состояние веществ, степени окисления атомов и дайте полную характеристику реакции по всем признакам классификации. ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Практическая работа № 6 «____» ___________________ 20____ г. Ход работы I. Изучение свойств кислот Задание 1. Взаимодействие кислот с металлами и солями 1. Исследуйте, с какими из предложенных веществ (медь, цинк, карбонат натрия, сульфат калия, нитрат серебра, хлорид бария – взаимодействует соляная кислота. Результаты исследований занесите в таблицу 1. Задание 1. Взаимодействие щелочей с солями. 1. В пробирку налейте раствор гидроксида кальция объемом 1 – 2 см3. И прилейте к нему примерно такой же объем карбоната натрия. Наблюдения занесите в таблицу 2. Задание 2. Взаимодействие щелочей с солями с образованием нерастворимых оснований. 1. В пробирку с раствором хлорида железа (III) по каплям прибавляйте раствор гидроксида натрия до появления признаков реакции. Наблюдения занесите в таблицу 2. III. Изучение свойств солей Задание. Взаимодействие солей со сложными веществами 1. Проведите химические реакции, позволяющие осадить катионы металла и анионы кислотного остатка, которые содержатся в растворе сульфата меди (II). Наблюдения занесите в таблицу 3.
Таблица 1
Таблица 2
Таблица 3
Вывод: 1. Сделайте вывод о свойствах кислот как электролитов. ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 2. Сделайте вывод о свойствах щелочей как электролитов. ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ 3. Сделайте вывод о том, с помощью каких реакций можно осадить катионы меди (II) и сульфат - анионы из раствора сульфата меди (II). _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Практическая работа №7 «___» ____________________20___г.
ПО ТЕМЕ «НЕМЕТАЛЛЫ» Цель: закрепить знания о свойствах неметаллов, развивать умение исследовать свойства веществ, анализировать результаты химического эксперимента, делать выводы, следующие из проведенных экспериментальных исследований. Оборудование: пробирки, спиртовка, держатель для пробирок. Реактивы: рН-шкала, универсальная индикаторная бумага; соляная кислота, сульфат натрия, карбонат натрия; растворы карбоната натрия, сульфата натрия, гидроксида натрия, хлорида бария, серной кислоты, нитрата серебра, фенолфталеин. G Соблюдайте правила техники безопасности! Ход работы Задача 1 В пронумерованных пробирках находятся карбонат натрия и сульфат натрия. При помощи качественных реакций определите выданные вам вещества. Перед началом работы проверьте выданные вам соли на растворимость в воде. Затем проведите качественные реакции на ионы, находящиеся в растворе. Результаты исследований занесите в таблицу 1, указав признаки химических реакций. Составьте уравнения соответствующих реакций в молекулярном и ионном виде. Если реакция не возможна, в соответствующей графе поставьте прочерк. Задача 2 Проведите реакции, позволяющие доказать качественный состав серной кислоты. Исследуйте рН раствора. Составьте уравнения реакции определения сульфат-иона в растворе. Результаты исследований занесите в таблицу 2. Задача 3 1) Нейтрализуйте выданный вам раствор гидроксида натрия раствором соляной кислоты (в присутствии индикатора фенолфталеина). Составьте уравнение химической реакции в молекулярном и ионном виде. Результаты занесите в таблицу 3. 2) Рассчитайте, хватит ли раствора соляной кислоты массой 60 г с массовой долей HCl 10% для нейтрализации гидроксида натрия в растворе 70 г с массойвой долей NaOH 5%.
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Задача 4. К раствору массой 200 г с массовой долей HCl 7,3% добавили 150 г раствора, содержащего 8% гидроксида натрия. Рассчитайте химические количества исходных веществ и массу образовавшейся соли. __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ ______________________________________________________________________ Таблица 1
Таблица 2
Таблица 3
Практическая работа № 8 «____» ________________ 20___ г. ПО ТЕМЕ «МЕТАЛЛЫ» Цель: закрепить знания о свойствах металлов, развивать умения применять полученные знания на практике, работать с химическим оборудованием и реактивами. Оборудование: пробирки, стеклянная палочка, спиртовка. Реактивы: медная проволока, цинк, алюминий; растворы карбоната натрия, хлорида натрия, гидроксида кальция, серной кислоты, гидроксида натрия, сульфата натрия, хлорида бария, хлорида цинка, алюминия, сульфат кальция. G Соблюдайте правила техники безопасности! Ход работы Задача 1: В выданных вам пробирках находятся растворы гидроксида натрия, хлорида кальция, сульфат натрия. Определите опытным путем, какое вещество находится в каждой пробирке. Для распознавания выданных веществ проведите качественные реакции на содержащиеся в растворах катионы и анионы. Результаты исследований занесите в таблицу 1. Задача 2: Из кусочка медной проволоки сделайте маленькую спираль и закрепите ее в держателе. Прокалите спираль в пламени спиртовки и отметьте произошедшие изменения. Составьте уравнение химической реакции, уравняйте его с помощью метода электронного баланса, укажите окислитель и восстановитель. Внесите прокаленную, еще теплую спираль в раствор серной кислоты. Отметьте признаки химической реакции. По результатам проведенных исследований заполните таблицу 2. Задача 3: Из хлорида алюминия получите гидроксид алюминия и докажите его амфотерность. 3. Получение гидроксида алюминия. К раствору хлорида алюминия по каплям добавьте раствор гидроксида натрия до появления белого осадка. Доказательство амфотерного характера гидроксида алюминия. Разделите осадок на две части. а) К осадку гидроксида алюминия в пробирке 1 приливаем раствор гидроксида натрия до растворения осадка. б) К осадку гидроксида алюминия в пробирке 2 приливаем раствор соляной кислоты до растворения осадка. Заполните таблицу 3. Таблица 1
Таблица 2
Таблица 3
УПРАВЛЕНИЕ ОБАЗОВАНИЯ ГОМЕЛЬСКОГО ОБЛИСПЛКОМА УЧРЕЖДЕНИЕ ОБРАЗОВАНИЯ «МОЗЫРСКИЙ ГОСУДАРСТВЕННЫЙ ПОЛИТЕХНИЧЕСКИЙ КОЛЛЕДЖ» ТЕТРАДЬ
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-14; просмотров: 647; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.01 с.) |









 (г.)
(г.)  2Cu+2O‒2(тв.)
Сu0 – 2ē → Cu+2 2 2 восстановитель
2Cu+2O‒2(тв.)
Сu0 – 2ē → Cu+2 2 2 восстановитель
 + 2∙2ē → 2O‒2 4 1 окислитель
+ 2∙2ē → 2O‒2 4 1 окислитель