
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
T – значение критерия Стьюдента (находят по таблице при известном числе степеней свободы и заданном уровне значимости Р).Содержание книги
Поиск на нашем сайте
5. µ - генеральная средняя: µ = 6. tф – критерий для оценки достоверности различия между средними двух выборок с помощью критерия Стьюдента t: tф = где ( выборок; Sd – ошибка разности средних.
При одинаковом числе наблюдений (n1 = n2)
Sd =
где Если вычисленное по экспериментальным данным значение tф будет больше, чем t табличное, то разность Статистическая обработка результатов исследования может быть проведена с использованием компьютерных программ, например «SPSS for Windows»
Коэффициент Стьюдента t для уровней значимости Р
ЗАНЯТИЕ III. БИОЭНЕРГЕТИКА КЛЕТКИ Контрольные вопросы:
Дыхание – аэробное окисление органических субстратов (углеводов, липидов, белков) до оксида углерода (IV) и воды. Общее уравнение дыхания (при использовании в качестве субстрата глюкозы):
С6Н12О6 + 6О2 ∆Gо′ = - 2824 кДж/моль
Биологическое значение дыхания многообразно. 1. В процессе дыхания происходит окисление субстрата с преобразованием энергии в конвертируемую форму АТР или протонного потенциала (энергетическая роль).
Дыхание
АТР используется для обеспечения различных энергозависимых процессов – биосинтез веществ, ионный мембранный транспорт, внутриклеточное движение. 2. Рассеяние энергии в виде тепла. 3. Дыхание как механизм образования необходимых для клеток химически активных метаболитов и удаления токсических веществ (метаболическая роль). Окисление дыхательных субстратов осуществляется ферментными системами, обладающими высокой активностью, лабильностью и субстратной специфичностью. Конформация и, следовательно, активность белков-ферментов зависит от внешних и внутренних факторов (температуры, парциального давления кислорода, кислотности среды и др.), что обеспечивает возможность ферментной регуляции обмена веществ. В живых системах распространены следующие 4 способа окисления: 1) отщепление двух атомов водорода: ׀ ׀ Н - С - Н ׀ ׀׀ Н – С – Н С - Н ׀ ׀ Алкан Алкен
׀ ׀ Н - С - ОН ׀ ׀ Спирт Кетон (или альдегид)
2) отдача электронов: Fe+2 3) присоединение кислорода: 2Н2 + О2 = 2Н2О 4) отнятие двух атомов водорода от предварительно гидратированного соединения: ׀ ׀ Н О - С - ОН ׀ / \\ Н НО О (Альдегид в водном растворе) Кислота Ферменты, катализирующие окислительно-восстановительные реакции, относятся к классу оксидоредуктазы:
Донор (Д) отдает электроны и протоны, акцептор (А) принимает их, а фермент (Ф) осуществляет реакцию переноса. Выделяют несколько групп оксидоредуктаз: анаэробные дегидрогеназы, аэробные дегидрогеназы, оксидазы, оксигеназы. 1. Анаэробные дегидрогеназы не могут отдавать водород кислороду воздуха, а передают его другим акцепторам. Это двухкомпонентные ферменты, состоящие из белка и кофермента. Коферментами дегидронегаз являются никотинамидадениндинуклеотид (NAD+) и никотинамидадениндинуклеотидфосфат (NADP+). NAD+ и NADP+ - зависимые дегидрогеназы обладают способностью отнимать водород непосредственно от органических соединений (органические кислоты, спирты, альдегиды, глюкоза), при этом происходит окисление субстрата и переход кофермента в восстановленную форму NADН и NADPН. NADН и NADPН могут передавать водород другому акцептору.
1. Аэробные (флавиновые) дегидрогеназы способны передавать водород, отнятый от окисляемого субстрата или от восстановленной формы анаэробной дегидрогеназы кислороду воздуха или другим соединениям. В состав простетической группы аэробных дегидрогеназ входит рибофлавин. Соединяясь со специфическим белком простетическая группа образует фермент. Примером является флавиновые ферменты, простетическая группа которых представляет собой флавинадениндинуклеотид, сокращенно FAD. Boсcтановленная форма FADН2 может передавать водород не только кислороду воздуха, но также полифенолоксидазной или цитохромной системам. Ступенчатая ферментативная окислительно-воостановительная реакция с участием нескольких ферментов можетбыть изображена следующей схемой:
3. Оксидазы способны передавать водород (электроны) окисляемого субстрата только на кислород с образованием воды (пероксида водорода, супероксидного анион-радикала кислорода). Примерами оксидаз являются: цитохромоксидаза, аскорбатоксидаза, полифенолоксидаза, оксидазы аминокислот, ксантиноксидазы. Пероксид водорода (Н2О2) и особенно супероксидный анион-радикал О2¯ очень токсичны и в клетках быстро обезвреживаются специальными ферментами:
Важную роль в окислительных процессах в клетке играет цитохромная система, к которой относятся железосодержащие ферменты и переносчики – цитохромы и цитохромоксидаза. Одноэлектронные переносчики с железопорфириновой простетической группой передают электроны в цепях электронного транспорта (ЦЭТ) от флавопротеидов на молекулярный кислород. Направление транспорта электронов определяется величиной редокс-потенциала цитохромов: цит. b → цит. c 1 → цит. c → цит. a, a3 → О2 К пероксидазам относят группу ферментов, использующих в качестве окислителя пероксид водорода:
4. Оксигеназы – это ферменты, активирующие кислород и способствующие присоединению его к органическим молекулам. Оксигеназы участвуют в гидроксилировании аминокислот, фенолов, стеринов, а также в детоксикации вредных соединени. Монооксигеназы катализируют реакцию гидроксилирования по схеме: АН + О2 + ДН2 → АОН + Д + Н2О. Диоксигеназы включают два атома кислорода в различные группировки, например: НАН + О2 → ОН –А – ОН; АН + О2 → АООН Ткани растений с интенсивным метаболизмом характеризуются и высокой активностью оксидоредуктаз.
Работа 1. Выявление дегидрогеназной активности тканей
Обнаружение дегидрогеназ основано на введении в живую растительную ткань акцептора водорода – динитробезола, восстановление которого сопровождается изменением окраски. При недостатке кислорода бесцветный о-,п-динитробензол, присоединяя водород от восстановленных дегидрогеназ, восстанавливается в тканях в желтый о-, п-нитрофенилгидроксиламин и далее в o-, п- нитроанилин также желтого цвета. О- и п-нитрофенилгидроксиламин дает в щелочной среде пурпурное окрашивание.
Цель работы: обнаружить дегидрогеназы в тканях клубня картофеля. Объекты: клубни картофеля. Реактивы и оборудование: насыщенный раствор динитробензола, 10%-ный раствор NH4ОН в капельнице, дистиллированная вода; пробочное сверло диаметром 1 см, скальпель, штатив с пробирками, мерный цилиндр на 10 мл, термостойкие стаканы или колбы, электроплитка, термостат. Ход работы: 1. Из клубня картофеля пробочным сверлом вырезать два одинаковых цилиндрика ткани длиной 3 см. 2. Один цилиндрик погрузить в стакан с кипящей водой на 2-3 минуты, а затем перенести для охлаждения в холодную воду. 3. Цилиндрики по одному положить в пробирки, в которые налить по 5 мл (использовать мерный цилиндр!) насыщенного раствора динитробензола. Динитробензол ядовит и поэтому после работы с ним тщательно вымыть руки! 4. Выдержать пробирки в термостате при 30-35°С в течение I часа. 5. Сравнить окраску тканей и растворов в обеих пробирках. 6. Подщелочить содержимое пробирок, добавив в каждую пробирку по 10-15 капель водного раствора аммиака. 7. Через 5-10 минут вновь сравнить окраску тканей и растворов в пробирках. Оформление работы: запишите наблюдения в таблицу, приведите схему ступенчатой окислительно-восстановительной реакции опыта с участием дегидрогеназ. Объясните результаты проведенного опыта. Результаты и обсуждение. Таблица 1 Дегидрогеназная активность тканей
Работа 2. Обнаружение активности пероксидазы и полифенолоксидазы в растительной ткани Оксидазами называются ферменты, активирующие молекулярный кислород, который соединяется с отщепляемым от субстрата водородом, образуя воду или пероксид водорода по схеме:
К этой группе ферментов относится полифенолоксидаза, окисляющая полифенолы кислородом воздуха с образованием соответствующих хинонов:
Этот фермент представляет собой белок, содержащий медь (0,2-0,3%). Пероксидаза – фермент, катализирующий окисление полифенолов и ароматических аминов кислородом пероксида водорода или органических перекисей. Пероксидаза образует с Н2О2 комплексное соединение, в результате чего пероксид активируется и приобретает способность действовать как акцептор водорода.
Пероксидаза – двухкомпонентный фермент, простетическая группа его содержит железо, соединенное с остатком четырех пиррольных колец в виде гематина. Поскольку пероксидаза особенно легко окисляет полифенолы, она играет важную роль в дыхании растении. Обнаружение пероксидазы и полифенолоксидазы основано на изменении окраски при окислении полифенолов в хиноны.
Цель работы: выявить активность полифенолоксидазы и пероксидазы в соке клубня картофеля по изменению окраски окисляемого субстрата на бурую. Объекты: клубни картофеля. Реактивы и оборудование: 1%-ный раствор гидрохинона, 3%-ный раствор Н2О2; терка, кристаллизатор, скальпель, штатив с пробирками, воронка, градуированная пипетка на 5 мл и на I мл, спиртовка, спички, держалка для пробирок, марля, фильтры бумажные. Ход работы: 1. Натереть на терке очищенный клубень картофеля. 2.Из мезги отжать через марлю в пробирку сок, который профильтровать через бумажный фильтр в чистую пробирку. 3. В 4 пробирки внести реактивы и картофельный сок согласно схеме опыта. I. 5 мл раствора гидрохинона + 1 мл Н2О2 + 1мл сока; II. 5 мл раствора гидрохинона + 1 мл Н2О2; III. 5 мл раствора гидрохинона + 1 мл сока; IV. 5 мл раствора гидрохинона + 1 мл Н2О2 + 1мл сока(предварительно прокипяченного на спиртовке). 4. Отметьте окраску содержимого пробирок. Оформление работы: заполните таблицу, объясните результаты проведенного опыта.
Результаты и обсуждение. Таблица 1 Обнаружение активности оксидаз – полифенолоксидазы и пероксидазы
Работа 3. Обнаружение каталазы в листьях элодеи Каталаза относится к классу оксидоредуктаз, под действием этого фермента происходит разложение пероксида водорода на воду и молекулярный кислород: 2Н2О2 → 2Н2О + О2 Каталаза – двухкомпонентный фермент, состоящий из белка и простетической группы, содержащей гематин. Роль каталазы заключается в разрушении токсичного для клеток пероксида водорода. Обнаружение каталазы в предлагаемом опыте основано на том, что пероксид водорода, в раствор которого погружается препарат, проникает в клетки листа и расщепляется в них каталазой на воду и молекулярный кислород. Выделение пузырьков молекулярного кислорода можно наблюдать под микроскопом.
Цель работы: сравнить активность каталазы в разновозрастных листьях элодеи; показать влияние высокой температуры на активность фермента.
Объект: побег элодеи с верхушечной почкой. Реактивы и оборудование: дистиллированная вода и 3%-ный раствор Н2О2 в капельницах; предметные и покровные стекла, препаровальные иглы, спиртовка, спички; микроскоп. Ход работы: 1. На предметное стекло в каплю раствора Н2О2 положить молодой лист элодеи, закрыть покровным стеклом и сразу же начать наблюдения под микроскопом за выделением пузырьков кислорода. 2. Повторить опыт, взяв старый лист элодеи у основания побега. Сравнить скорость выделения пузырьков кислорода из старых и молодых листьев (равно активность каталазы).
Оформление работы: запишите результаты наблюдений в таблицу и объясните их. Результаты и обсуждение. Таблица 1 Выявление активности каталазы в растительных тканях
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 388; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.45.223 (0.014 с.) |


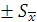 t.
t. ,
, -
-  ) – разность между средними двух
) – разность между средними двух =
=  , или
, или , тогда
, тогда
 и
и  – ошибка сравниваемых средних
– ошибка сравниваемых средних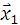 -
-  является существенной; в том случае если tф< t – разность между средними не достоверна.
является существенной; в том случае если tф< t – разность между средними не достоверна. = 6 СО2 + 6Н2О
= 6 СО2 + 6Н2О
 АТР
АТР Н – С + 2Н+ + 2ē
Н – С + 2Н+ + 2ē Fe+3
Fe+3




 супероксидисмутаза
супероксидисмутаза







