
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Висмута нитрат основной, цинка оксид, цинка сульфат, меди сульфат, серебра нитрат.Содержание книги
Поиск на нашем сайте
Необходимо рассмотреть особенности состава и свойств соединений висмута, включая отношение к нагреванию и прокаливанию, а так же действию йодидов и сернистых соединений. В случае соединений цинка обратить внимание так же на результаты нагревания и прокаливания и на способность взаимодействовать с кислотами и щелочами. При изучении соединений серебра и меди следует рассмотреть следующие лекарственные вещества: меди сульфат, серебра нитрат, а также коллоидные препараты серебра (колларгол, протаргол). При изучении этих лекарственных веществ следует проследить сходство в их химических свойствах и основанные на этом методы анализа. Рассмотреть на примере анализа меди сульфата использование косвенной йодометрии, обратить внимание на хранение указанных лекарственных средств. Вопросы для самоконтроля 1. Каков состав висмута нитрата основного, его отношение к азотной кислоте и едким щелочам, а так же к йодиду калия? 2. Как доказать наличие нитрат-иона в висмута нитрате основном? 3. Отношение цинка оксида к нагреванию и прокаливанию. 4. Каким образом определить количественное содержание цинка оксида? 5. Методы количественного определения серебра нитрата. Какой при этом используется индикатор? 6. Метод количественного определения меди сульфата. 7. Применение серебра нитрата, колларгола и протаргол в медицине. 8. Обоснуйте условия хранения серебра нитрата и меди сульфата. 9. Реакции подлинности и количественного определения препаратов цинка и висмута нитрата основного. Применение их в медицине.
ПОРЯДОК ВЫПОЛНЕНИЯ И ОФОРМЛЕНИЯ КОНТРОЛЬНЫХ РАБОТ
Контрольные работы представляют собой вопросы и ситуационные задачи, для решения которых необходимо внимательно ознакомиться с материалом, изложенным в рекомендованной литературе, требованиями общих и частных фармакопейных статей ГФXI, ГФXII и другой нормативной документации, а также с методическими разработками кафедры. К выполнению контрольной работы следует приступать только после изучения определенной части программы и краткого конспектирования темы в рабочей тетради. При выполнении контрольной работы студент должен придерживаться следующих требований: 1. Каждая контрольная работа должна выполняться самостоятельно с учетом методических указаний настоящего комплекса. Не следует механически переписывать учебник! 2. Номер варианта контрольной работы определяется преподавателем. Работа, выполненная по другому варианту, не зачитывается. Так как студент-заочник выполняет только один вариант контрольной работы, остальные вопросы должны быть использованы в качестве вопросов для самоподготовки. 3. Каждая контрольная работа должна быть оформлена следующим образом: шрифт Times New Roman, размер 14 пт, на листах стандартного размера А4. Поля страницы должны быть: левое – 4; правое – 1,5; верхнее – 2; нижнее – 2. Абзацы выравниваются по ширине, отступ первой строки абзаца – 1, см, межстрочный интервал 1,5. Все страницы контрольной работы нумеруются. Номер страницы на титульном листе не указывается. 4. Контрольная работа оформляется в печатном виде с одной стороны листа в папке-скоросшивателе. 5. Образец оформления титульного листа приведен в приложении 1. 6. Построение химических формул осуществляется с помощью таких программ, как WinChem, ChemDraw и др. 7. Работа должна быть структурирована и разделена на отдельные задания. 8. Номера и условия заданий должны быть в том порядке, в котором они указаны в таблице вариантов. 9. Ответы на вопросы контрольных работ должны быть краткими, логичными, исчерпывающими. Необходимо ответы на контрольные вопросы начинать с написания латинских, русских и химических названий лекарственных веществ. Ответы должны иллюстрироваться правильно написанными уравнениями химических реакций, положенными в основу методов синтеза и анализа лекарственных веществ. При составлении схем синтеза необходимо характеризовать или называть каждую его стадию (этерификация, ацилированние, нитрование, диазотирование, восстановление, окисление, галоидирование, конденсация и др.) и промежуточные продукты. Приводя реакции на подлинность или методы количественного определения необходимо избегать подробного описания методик. Достаточно обосновать реакцию подлинности или метод количественного определения, а затем подтвердить уравнениями реакций, положенными в основу реакции или метода. При характеристике качественных реакций следует указывать, каким внешним эффектом они сопровождаются: выпадение в осадок, цвет осадка, в чем он растворяется, появление окраски, выделение газообразных продуктов и как они обнаруживаются. Если при выполнении качественных реакций требуются особые условия, кратко оговорить их при характеристике реакции. Например, при описании реакции обнаружения хлорид-иона примерная форма ответа может быть следующей: реакция обнаружения хлорид-ионов согласно ГФ основана на образовании белого творожестого осадка при взаимодействии с ионами серебра. Привести уравнения реакции, лучше в ионной форме. Реакцию, в целях повышения селективности, выполняют в азотнокислой среде. Осадок хлорида серебра растворим в избытке карбоната аммония, а также в водном растворе аммиака вследствие образования комплексного соединения аммиаката серебра (уравнения реакций). Дополнительным подтверждением подлинности хлорид-ионов является разрушение аммиаката серебра под действием избытка азотной кислоты (уравнение реакции). При характеристике объемных (титриметрических) методов количественного определения лекарственных веществ необходимо выделить: а) сущность метода, б) условия (рН, индикатор), в) эквивалент, титр по определяемому веществу. Например, при описании комплексонометрического (три-лонометрического) метода определения магния сульфата примерная форма ответа может быть следующей: количественное определение магния сульфата проводится трилонометрическим методом, основанным на образовании прочного комплекса ионов магния с комплексоном — трилоном Б. Титрование проводят в присутствии аммиачного буферного раствора. Металлоиндикатор — кислотный хром черный специальный. Далее приводится все 3 стадии комплексонометрического титрования (уравнения реакций). 1 стадия — взаимодействие металлоиндикатора с анализируемым соединением, 2 стадия — взаимодействие трилона Б с анализируемым соединением, 3 стадия — взаимодействие комплекса металлоиндикатора — магний с трилоном Б. Так как прочность комплекса иона магния с индикатором меньше, чем с трилоном Б в точке эквивалентности, избыточная капля титранта разрушает комплекс иона магния с индикатором. Исследуемый раствор титруют до перехода красной окраски (цвет комплекса иона магния с индикатором) раствора в синею (индикатор). При составлении ответов на вопросы, касающиеся хранения лекарственных веществ, необходимо иметь представление о влиянии внешних факторов — влаги, температуры, атмосферной углекислоты, кислорода воздуха и т. д. При этом надо так же знать, за счет каких функциональных групп в молекуле лекарственного вещества происходят изменения под влиянием внешних факторов. При решении задач и выборе метода качественного анализа ингредиентов сложной лекарственной формы следует пользоваться следующими рекомендациями: а) Предварительный (ориентировочный) расчет расхода титранта V в мл, если указана навеска (а, г) и нижний предел содержания (G,%) исследуемого вещества. В этом случае, исходя из основного уравнения реакции, на которой базируется метод, определяют молярную массу эквивалента определяемого вещества (Э), с учетом молярности титранта затем его титр (Т). В этом и последующих вариантах расчетов следует учитывать пропорциональный коэффициент (К), если его величина отличается от единицы. При его использовании следует произвести умножение объема титранта (V) на (К): G = T = Расчет ориентировочного объема титранта (V) производится по уравнению (3), полученному из уравнения (1). V =
б) Определение точной навески исследуемого вещества, чтобы на ее титрование израсходовалось данное количество мл титрованного раствора. В этом случае, как и в п. «а» определяют Э и Т исследуемого вещества, а расчет навески исследуемого вещества (а в г) производят по формуле (4):
a =
в) Определение содержания вещества в процентах, если известны навеска определяемого соединения и объем титранта. В этом случае следует проводить расчет по формуле (1). Если используется методика обратного титрования с контрольным опытом, то содержание вещества в процентах рассчитывают по формуле (5): G = При наличии в условиях задачи указаний на приготовление разведения из взятой навески вещества, необходимо в расчетную формулу ввести величины W — вместимость мерной колбы (в мл), в которой растворили навеску вещества и a1 — вместимость мерной пипетки (в мл), взятой на титрование. Учитывая это, формула (6) для расчета процентного содержания вещества будет иметь вид: G = Если в условиях задачи указана потеря в массе при высушивании (B, %), то в формулу (2) или (4) необходимо внести поправку, учитывающую содержание сухого вещества (а1) в навеске (а): а1 = При этом в общем виде формула расчета процентного содержания вещества будет иметь вид: G =
10. Решение задач следует сопровождать подробными пояснениями, расчеты по формулам должны быть приведены полностью, без сокращений. 11. В конце каждой контрольной работы необходимо привести список литературы, используемый при ее написании, указать дату выполнения и поставить свою подпись. 12. Если контрольная работа не зачтена, студент представляет ее на повторное рецензирование, выполнив заново не зачтенные задания, с приложением ранее не зачтенной работы. 13. В случае возникших неясностей и затруднений при изучении курса фармацевтической химии студенту следует обратиться к преподавателю на кафедре, у которого он консультируется, устно или письменно и получить разъяснения. Такая консультация должна иметь место лишь после того, как студент детально изучил обязательный материал учебника по возникшему вопросу, а в случае необходимости и материал дополнительной литературы. Вопросы для консультации должны быть сформулированы коротко, но четко. 14. К сдаче экзамена допускаются студенты, получившие зачет по всем контрольным работам. Контрольные работы необходимо выполнять и присылать в соответствии с графиком их выполнения, установленным деканатом. 15.Выбор номеров заданий контрольных работ определяется по таблице, составляемой преподавателями кафедры каждый год и представленной в деканате согласно варианту!!!
|
||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 154; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.177.116 (0.007 с.) |

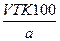 (1)
(1)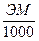 (2)
(2) (3)
(3) (4)
(4)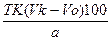 (5)
(5)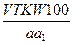 (6)
(6)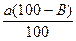 (7)
(7)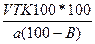 (8)
(8)


