
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дублирующий двигатель; 5 – блок автоматического управленияСодержание книги
Поиск на нашем сайте
Ветроагрегат 1 в комплексе с одной или несколькими рабочими машинами 2 передает энергию либо сразу потребителю, либо в аккумулирующее устройство 3. В случае недостаточной энергии ветра включается в работу неветровой дублирующий двигатель 4. Система 5 выполняет функции автоматического управления и регулировки режимов работы. На рис. 2.5 представлена одна из современных ветроэлектрических установок. К достоинствам ветровой энергии, прежде всего, следует отнести доступность, повсеместное распространение и возобновляемость. Источник энергии не нужно добывать и транспортировать к месту потребления: ветер сам движется к установленному на его пути ветродвигателю. Эти особенности ветровой энергии дают предпочтение в ее использовании для относительно мелких (мощностью до 1000кВт) ее потребителей, удаленных от централизованных систем энергоснабжения и рассосредоточенных по территориям районов. Основные проблемы в использовании ветра, как энергетического источника – это непостоянство его скорости и направления, что усложняет системы автоматического регулирования режимов работы.
Ветроэлектрическая установка 2.2.3 Энергия движения вод в реках и морях Энергия, которой располагает водный поток, определяется двумя величинами: количеством протекающей воды и высотой ее створа от поверхности условного отсчета. Перепад высот при использовании энергии воды может быть природным (горные реки, приливы), либо создается искусственно в виде гидротехнических сооружений. На 2011 г. гидроэнергетика обеспечивает 19% всей мировой электроэнергии, а установленная гидротехническая мощность составляет 715 ГВт. Суммарная мощность гидроэлектростанций России составляет 38,7 ГВт (пятое место после Китая, Канады, Бразилии, США). В выработке электроэнергии доля ГЭС составляет 15%. Степень освоения экономических гидроресурсов в России составляет всего 21% (в Германии – 95%).
Доступный потенциал энергии приливов составляет около 200 ГВт. Так высота приливов на востоке России в районе Охотского моря достигает 13 м, у берегов Кольского полуострова в Баренцевом море она составляет 7 м. Достигнуты существенные сдвиги в использовании энергии морских приливов, в России построены и проходят испытания приливные электроагрегаты. Глава 3 Основы воспламенения и горения химических топлив Кинетика процессов горения Кинетика горения – это учение о скорости и механизме химических реакций при сгорании топлив. Под горением понимают быстропротекающее химическое превращение, сопровождающееся выделением значительного количества тепла и обычно ярким свечением (пламенем). В общем случае при горении происходит образование новых молекул или перераспределение химических связей между молекулами, участвующими в реакции. Такой процесс возможен, если топливо имеет состав, несущественно отличающийся от стехиометрического и реагирующие элементы находятся в непосредственном соприкосновении. Следовательно, необходимым условием осуществления окислительно-восстановительной реакции является столкновение реагирующих молекул. Согласно молекулярно-кинетической теории газов, каждая молекула за счет хаотического теплового движения испытывает 109 столкновений в секунду. Если бы при каждом соударении молекулы реагировали между собой, то любая реакция протекала бы мгновенно. Этого мы не наблюдаем на практике.
В исходном состоянии средняя энергия всех частиц, находящаяся в реагирующей системе, – E исх. При подведении энергии в каком-либо объеме системы и доведение ее до уровня Е1 начнется химическая реакция, которая затем пойдет самопроизвольно с выделением теплоты, при этом энергетический уровень продуктов реакции понизится до Е2. Здесь количество выделенной теплоты Q = Eисх – Е2. Превышение энергии Е1 над Еисх обозначают Е0, измеряют в Дж/кг и называют э н е р г и е й а к т и – в а ц и и.
Для моля энергия активации обозначается Энергия активации, это избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к началу химической реакции. Величина энергии активации зависит от структуры молекул, температуры реагирующих компонентов. Определяют ее экспериментально. Молекулы, обладающие энергией Е1 = Еисх + Е0, называют активными молекулами или активными комплексами. Активный комплекс – это неустойчивое промежуточное состояние химических элементов (связи разорваны) с большим запасом энергии. Чем больше активных молекул в реагирующей смеси, тем более интенсивно, с большей скоростью будут протекать химические реакции. Под скоростью химической реакции понимают количество молей вещества, прореагировавшее в единице объема в единицу времени. Весьма сильное влияние на скорость реакции оказывает температура смеси. С ростом температуры увеличивается интенсивность взаимных соударений реагирующих молекул, что способствует росту скорости реакции. Например, для некоторых реакций увеличение температуры всего на 10° приводит к возрастанию скорости в 2…4 раза. В связи с этим скорость химической реакции будет определяться концентрацией молекул, их температурой и энергией активации. Согласно теории Вант - Гоффа и Аррениуса, формула скорости химической реакции имеет вид: W = к0 где W – скорость химической реакции; к0 – характерная для исследуемой реакции константа; cB, cD – концентрации исходных продуктов реакции;
Т – температура. Выражение (3.1) показывает, что зависимость скорости химической реакции от температуры носит экспоненциональный характер. Химическая реакция горения в большинстве случаев является сложной, т.е. состоит из большего числа элементарных химических процессов. Кроме того, химические превращения при горении связаны с рядом физических процессов (переносом тепла и масс) и характеризуются соответствующими гидро и газодинамическими закономерностями. В силу комплексной природы горения суммарная скорость горения практически никогда не тождественная скорости чисто химического взаимодействия. Характерная черта горения – способность к пространственному распространению. Это объясняется либо диффузией активных частиц в топливной смеси, либо образованием новых активных центров вследствие подвода энергии в форме теплоты из зон химических реакций. В первом случае говорят о диффузионном, а во втором – о тепловом механизме распространения пламени. Для любого вида горения характерны две типичные стадии – воспламенение и последующее сгорание (догорание) топлива. Время, затраченное на обе стадии, составляет общее время горения. Обеспечение минимального суммарного времени горения при максимальном тепловыделении является основной задачей техники сжигания. Различают гомогенное и гетерогенное горение. При гомогенном горении горючее и окислитель подаются в одинаковых агрегатных состояниях, при гетерогенном – в разных.
Воспламенение топлив Горению предшествует процесс воспламенения топливной смеси. Процесс воспламенения может быть либо в ы н у ж д е н н ы м, либо а в т о - н о м н ы м (самовоспламенение). При вынужденном воспламенении для начала реакций горения используется внешний источник энергии (искра электрической свечи, раскаленные продукты сгорания какого-либо топлива и т.д.). В топливной смеси, находящейся в непосредственной близости от источника зажигания, создается местное повышение температуры и накопление активных частиц. Если этого активизирующего воздействия будет достаточно для увеличения скорости реакции в смеси, то смесь в этом месте воспламеняется, и далее пламя будет распространяться от источника воспламенения по всему объему. При автономном воспламенении необходимость в постороннем источнике энергии отпадает. Здесь реакции горения начинаются за счет химической активности при соединении компонентов даже при низких температурах. Это приводит к повышению температуры и накоплению активных частиц, и если смесь горючего и окислителя будет однородна, то воспламенение произойдет во всем объеме. В реальных случаях вследствие неидеальности перемешивания компонентов топлива смесь по объему является неоднородной: в одних областях отсутствует окислитель, в других – горючее. Есть и области, в которых состав смеси оказывается наиболее благоприятным для самовоспламенения. Здесь и появляются первые очаги горения. По мере увеличения температуры и накопления активных частиц вокруг этих очагов пламя распространяется на весь объем. Сам процесс воспламенения в зависимости от причины увеличения скорости реакции может носить характер т е п л о в о г о или цепного воспламенения. Если основной причиной резкого возрастания скорости реакции является разогрев смеси, то воспламенение называется тепловым. Если же заметного роста температуры не наблюдается, а основной причиной резкого увеличения скорости реакции является накопление активных радикалов и атомов, то воспламенение называется ц е п н ы м. В случае воспламенения должно пройти некоторое время с момента впуска смеси в сосуд до резкого повышения температуры и давления. За это время происходит подготовка смеси к сгоранию: повышается температура, накапливаются активные промежуточные продукты сгорания. Промежуток времени, в течение которого смесь становится способной к воспламенению, называется периодом индукции, или задержкой воспламенения. Период индукции обозначают τi. Он зависит от химического состава, температуры, давления смеси, размеров сосуда. Величина τi может составлять от 10-3 с до нескольких секунд. Наиболее благоприятным для воспламенения является стехиометрическое соотношение горючего и окислителя. Еслисостав смеси далек от стехиометрического, то воспламенение затруднено. Максимальная и минимальная величины соотношений компонентов, при которых еще возможно воспламенение, называются верхним и нижним концентрационными пределами воспламенения. Температурой воспламенения называется минимальная температура смеси при стехиометрическом соотношении, когда возможно тепловое или цепное воспламенение. Таким образом, для реакции воспламенения в рассматриваемом пространстве, смесь должна представлять собой гомогенную газообразную фазу, состоящую из элементов горючего и окислителя с достаточной энергией активации и в соотношении между нижним и верхним концентрационными пределами. 3.2.1. Тепловое воспламенение Сущность воспламенения состоит в том, что за счет источника тепла или за счет экзотермических реакций, протекающих в самой горючей смеси, смесь разогревается до некоторой температуры, и далее происходит ее воспламенение во всем объеме одновременно. Рассмотрим воспламенение горючей смеси, находящейся в некотором сосуде, за счет экзотермической реакции. Количество тепла, выделяющегося в сосуде в единицу времени
где W – скорость химической реакции;
Эта зависимость представлена на рис. 3.2 Выделяемая в результате реакции теплота разогревает горючую смесь, следовательно, увеличивается теплоотдача к стенкам сосуда, Тепловой поток к стенкам
где α – коэффициент теплоотдачи от горючей смеси к стенкам сосуда; Т, Тст – температуры смеси и стенок сосуда; F – площадь поверхности сосуда. Из уравнений (3.2) и (3.3) следует, что с изменением температуры скорость тепловыделения изменяется по экспоненте, а скорость теплоотвода по линейному закону. В зависимости от температуры стенки и давления сме-
Состояние системы в точке 2 характерно ливной смеси тем, что небольшое повышение темпера- туры системы относительно ее значения в точке 2 вызывает ускоренный саморазогрев смеси до воспламенения с последующим быстрым сгоранием. Понижение температуры системы (менее значения в точке 2) переместит систему в состояние 1. Увеличивая температуру стенки сосуда до некоторого значения Т ׳׳, можно создать условия, при которых скорости теплоотвода и тепловыделения будут равными (точка 3). Режим, соответствующий этой точке, будет устойчивым как при понижении температуры, так и при ее повышении. Такое состояние системы называют критическим. В случае высокой температуры стенки (например Явление самовоспламенения горючей смеси при критическом состоянии носит название теплового воспламенения. Теория теплового воспламенения разработана академиком Н.Н. Семеновым. В этой теории доказано, что температура самовоспламенения не является физической константой горючей смеси, а зависит от свойств смеси, характера теплообмена между горючей смесью и внешней средой, от теплопроводности материала стенок сосуда, температуры внешней среды и ряда других факторов.
3.2.2. Цепное воспламенение Сущность цепного воспламенения заключается в том, что при определенных условиях в топливной смеси образуются активные центры, вызывающие цепной механизм протекания химической реакции. Теория цепного воспламенения разработана отечественными учеными. Согласно этой теории, химический процесс протекает с несколькими промежуточными стадиями. Активная частица при каждом элементарном химическом взаимодействии порождает одну или даже две другие активные частицы, которые при следующих столкновениях порождают, в свою очередь, новые активные частицы. Активной частицей служит не молекула, обладающая большой кинетической энергией, а частица с ненасыщенной валентностью. Такими частицами являются свободные радикалы (например, гидроксильная группа) или атомы. Продукты промежуточных стадий (активные частицы) неустойчивы, и их реакция с исходными веществами и между собой происходит легче и быстрее. Реакции, имеющие такой механизм, называются цепными. Если в результате соударения активной частицы образуется только одна новая активная частица, то цепная реакция называется неразветвленной; при образовании двух новых активных частиц цепная реакция будет разветвленной, лавинообразной. Примером неразветвленной цепной реакции может служить процесс образования хлористого водорода. Процесс осуществляется путем последовательных чередований реакций атомарных хлора и водорода, регенерирующих друг друга: Cl2 + H → HCl + Cl или H2 + Cl → HCl + H. В результате этих взаимодействий образуется не только конечный продукт реакции – хлористый водород, но и новая активная частица – атом водорода или хлора. При следующем столкновении атома одного вещества с молекулой другого вещества процесс повторяется. Реакция продолжается до гибели самого активного центра или до так называемого обрыва цепи. Обрыв цепи может произойти в результате рекомбинации атомов, соединения их с инертными примесями и по другим причинам. Скорость неразветвленной реакции сначала резко возрастает до некоторой максимально возможной величины при данной температуре, а затем уменьшается, приближаясь к нулю. Первоначальный рост скорости связан с увеличением концентрации активных центров, последующее ее уменьшение обусловлено обрывом цепи. Ярким примером разветвленной цепной реакции служит горение водородо – кислородного топлива. Схема развития разветвленной цепи реакций для таких компонентов имеет вид:
Из приведенной схемы видно, что атом водорода, положив начало цепной реакции, в ходе реакции вновь регенерируется и вызывает затем рождение нескольких атомов. Таким образом, цепь разветвляется, и создаются условия для образования лавины активных центров, что ведет к саморазгону реакции, вплоть до воспламенения. В некоторых случаях цепные разветвления происходят не в результате взаимодействия активной частицы с молекулой исходного вещества, а в результате распада молекул промежуточных продуктов на радикалы. Горение углеводородов также представляет собой цепную реакцию, причем, чем сложнее строение углеводородов, тем большее количество элементарных реакций составляет цепь. Цепные реакции горения углеводородов оказываются слабо разветвленными и поэтому протекают относительно медленно. Реакция горения чистого водорода сильно разветвлена и может протекать взрывообразно.
Горение гомогенных топлив К гомогенным относят топлива, в которых горючее и окислитель до горения находятся в одинаковом фазовом состоянии: газ – газ; жидкость – жидкость; твердое горючее – твердый окислитель. Характер горения существенно зависит от того, когда происходит смешение горючего и окислителя - до или в процессе горения. Раcсмотрим процесс сгорания однородной газообразной топливной смеси в закрытом объеме.
Пламенем принято называть ту зону газового объема, в котором протекают реакции горения. Пламя может быть прозрачным или светящимся. Его форма зависит от распределения концентраций горючего и окислителю в топливной смеси.
смеси, называется ф р о н т о м пламени. Позади фронта пламени будут находиться продукты сгорания, а впереди – свежая топливная смесь. Пламя при благоприятных условиях распространяется с некоторой скоростью во все стороны. Распространение пламени происходит вследствие того, что из зоны реакции теплота передается в сторону холодной смеси, температура ее повышается, и она воспламеняется, затем происходит подогрев и воспламенение следующих слоев свежей смеси и т.д. Скорость, с которой распространяется пламя, зависит не только от характера химических реакций (т.е. от скорости химических реакций), но и от физических процессов – процессов теплопередачи и диффузии. Д и ф ф у з и я при горении представляет собой процесс выравнивания концентраций компонентов в смеси. Если время образования топливной смеси меньше времени протекания собственно химических реакций, то процесс горения в целом будет лимитироваться скоростью (кинетикой) реакций. Горение в этом случае называется к и н е т и ч е с к и м. Если же скорость горения определяется скоростью процессов тепло – и массопереноса (временем образования смеси способной гореть), то такое горение называют д и ф ф у з и о н н ы м. В реальном процессе время сгорания топлива τ складывается из времени, необходимого на диффузионное горение τ д и времени кинетического горения τк: τ = τ д + τ к. Может происходить наложение одной стадии на другую. При τ д реализуется диффузионное горение; при τ к Рассмотренный механизм распространения пламени называют нормальным. В нем осуществляется последовательное поджигание слоев смеси в результате процессов теплообмена и диффузии. При нормальном распространении пламени горение будет носить зонный характер, так как оно будет протекать в узкой области, распространяющейся по топливу. Если же топливо самовоспламеняющееся, то его горение будет наблюдаться во всем рассматриваемом объеме. Такое горение называют о б ъ е м н ы м.
Величина uн зависит от химической природы, состава и состояния топливной смеси. Существует несколько методов экспериментального определения нормальной скорости горения. Достаточно простым и точным является метод стационарного пламени, разработанный русским ученым В.А. Михельсоном,
(метод бунзеновской горелки). Сущность метода состоит в следующем.
Теорию нормального распространения пламени в газовой среде, разработали отечественные ученые Л.Б.Зельдович и Рис. 3.4. Изменение параметров в зоне пламени Д.А.Франк–Каменецкий. Представим (рис. 3.4), что топливная смесь движется со скоростью W0, равной нормальной скорости горения uн. (фронт пламени неподвижный). Распространение пламени относительно топливной смеси будет наблюдаться вследствие передачи тепла из зоны пламени к свежей смеси. При этом температура смеси повышается перед фронтом пламе- ни от ее начального значения T0 до температуры Tb (зона прогрева δ1) и далее, в зоне пламени (δ2) - до температуры горения Tг. В зоне δ2 сгорает до 90 % смеси, концентрация реагирующих компонентов падает от Сг до Сх. Протяженность зоны пламени выразим через нормальную скорость горения и время протекания реакции: δ2 = uн Предположим, что температура в зоне δ2 изменяется линейно по х, тогда
Для изменения температуры в зоне δ1, от T0 по Tв необходимо в единицу времени подвести количество теплоты равное
где Fк площадь поперечного сечения канала. Это тепло подводится теплопроводностью из зоны δ2. Для принятых условий
Откуда
Поскольку δ2 = uн
то uн Из выражения (3.4) следует, что величина нормальной скорости распространения пламени зависит от начальной температуры топливной смеси, от температуры ее воспламенения и физических свойств смеси. На величину uн влияет соотношение компонентов топлива, а также содержание в нем веществ, не участвующих в тепловыделении, но играющих роль ускорителей или замедлителей горения. К гомогенным топливам относят твердые топлива ракетных двигателей, пороха и др. Особенности их горения рассмотрены, например, в Горение гетерогенных топлив 3.4.1. Горение жидкого горючего в среде газообразного окислителя Очень часто в тепловых двигателях и других преобразователях энергии в качестве окислителя используется кислород воздуха, а в качестве горючего углеводородные соединения в жидкой фазе. Механизм сгорания жидкого горючего связан с рядом теплофизических процессов, это: - подача в камеру сгорания горючего при помощи форсунок, с целью распыления компонента на отдельные капельки; - подогрев и испарение капелек горючего; - перемещение паров горючего и окислителя до такого состава, когда смесь в месте смешения становится горючей; - воспламенение горючей смеси одним из рассмотренных выше способов; - непосредственное химическое взаимодействие горючего и окислителя с последующим установлением энергетического и химического равновесия вновь образовавшихся молекул. Процесс распыла можно разделить на такие этапы: ускорение и придание определенной направленности потоку жидкости на рабочих элементах форсунки; образование струи жидкости, вытекающей из форсунки, и придание ей той или иной формы под действием центробежных сил инерции и трения; дробление струи жидкости на отдельные капли, возможно, меньшего размера. Распыление или дробление жидкости на отдельные капли происходит в основном за счет турбулентных пульсаций частиц жидкости в потоке, действия сил трения между струей жидкости и средой в камере, отрывающих с поверхности струи частицы жидкости, наличия возмущений в струе, вызванных шероховатостью входного канала форсунки. Силам, разрушающим струю, противостоят силы сцепления между молекулами и силы поверхностного натяжения. Задачей впрыска и распыла является раздробление топлива на мельчайшие капельки с целью получения возможно большей поверхности испарения. Качество распыла определяется, прежде всего, тонкостью и однородностью распыла, равномерностью распределения капелек жидкости в конусе распыла. Тонкость характеризуется величиной среднего диаметра отдельных капель. Подогрев и испарение раздробленного горючего необходимы для получения паровой фазы. На месте испарившихся капель горючего образуется множество облачков пара, в которых затем (после их перемешивания) происходит химическая реакция. Подогрев и испарение капель происходит практически одновременно: с поверхности капли уже испаряются, а внутри они еще продолжают подогреваться до температуры испарения. Процесс подогрева и испарения капли жидкости осуществляется примерно по такой схеме. Распыленная жидкость, поступая в камеру горения, непрерывно перемешивается с раскаленными газами, воспринимает от них тепло. Первоначально поток капелек имеет значительную скорость и очень низкую температуру относительно газовой среды в камере. Конвективный и лучистый тепловой обмен между газовой средой и каплями жидкости будет весьма интенсивным. За счет этого капли начнут быстро подогреваться и испаряться. Возникает поток молекул пара в направлении “поверхность капли – горючая газовая среда”, одновременно капля затормаживается газовой средой и теряет свою скорость. В результате этого конвективный теплообмен уменьшится, подвод тепла от газов к капле будет происходить в основном путем теплового излучения. По мере уменьшения диаметра капли испарение становится более интенсивным, и роль конвективного теплообмена вновь возрастает. Связано это с тем, что молекула жидкости, находящаяся на выпуклой поверхности, испытывает притяжение тем меньшего числа других молекул, чем меньше радиус кривизны поверхности. Диаметр капель вообще очень мал; когда он соизмерим с длиной свободного пробега молекул, на поверхности капель отсутствует пограничный слой, являющийся наибольшим препятствием для конвективного теплообмена. Образование смеси компонентов топлива вполне определенного концентрационного состава, обеспечивающего наиболее полное и быстрое сгорание топлива, происходит в результате механического перемешивания и процессов диффузии. Физические изменения, происходящие с горючим в предпламенный период, превращают его в огромное количество испаряющихся капелек. Вследствие этого горение гетерогенного топлива можно считать процессом одновременного сгорания большой массы капелек горючего в среде окислителя. Выявление закономерностей горения отдельной капли позволяет ус Рассмотрим горение отдельной капли жидкого горючего. Попав в среду с высокой температурой, капля горючего 1 (рис. 3.5) нагревается и начинает испаряться. В слое 2 находятся только пары горючего. Слой 3 представляет собой смесь паров горючего и окислителя, но в этом слое окислителя еще очень мало, и только на его внешней границе состав смеси соответствует верхнему концентрационному пределу воспламенения.
и окислителя таков, что в нем возможно распространение пламени. На границе слоев 4 и 5 состав смеси соответствует нижнему концентрационному пределу воспламенения. В слое 5 находятся практически лишь пары окислителя, и горения здесь не может быть. При определенных условиях воспламенения смеси происходит на внешней границе слоя 4, и фронт пламени перемещается к слою 3. По мере испарения горючего с поверхности капли и перемешивания его с парами окислителя размеры капли уменьшаются. Установившийся режим горения капли характеризуется двумя взаимосвязанными процессами: испарением горючего за счет тепла, подводимого из зоны горения, и горением смеси горючего и окислителя. Очевидно, что скорость горения будет определяться интенсивностью испарения жидкости, поскольку собственно химические реакции в рассматриваемых условиях будут протекать очень быстро. Тогда время сгорания капли можно считать в первом приближении равным времени ее испарения. Скорость испарения жидкости определяется интенсивностью теплоподвода от продуктов горения к капле и теплофизическими свойствами самой жидкости. Баланс энергии в форме тепла для капли с переменной массой запишется в вид
где D –диаметр капли;
m – масса капли;
Величина коэффициента теплоотдачи определяется по эмпирическим уравнениям: для Re = 0 … 100 – по уравнению Nu = 2 + 0,16 Re 2/3, для Re = 100 …1000 – по уравнению Nu = 0,56 Re 0,5. Изменение энтальпии включает теплоту на нагрев жидкости от Тж до Тисп, испарение ее и нагрев пара до Тг:
где r - теплота испарения. Выразим массу капли через ее объем и плотность:
Продифференцировав это выражение, получим
Перепишем выражение (3.5) в виде
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 210; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.23.138 (0.017 с.) |



 и измеряется в Дж/моль
и измеряется в Дж/моль (3.1)
(3.1) – энергия активации;
– энергия активации; – универсальная газовая постоянная;
– универсальная газовая постоянная; зависит от скорости химической реакции и может быть определено по формуле
зависит от скорости химической реакции и может быть определено по формуле =
= 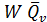 , (3.2)
, (3.2) мольный тепловой эффект реакции.
мольный тепловой эффект реакции. определяется по выражению
определяется по выражению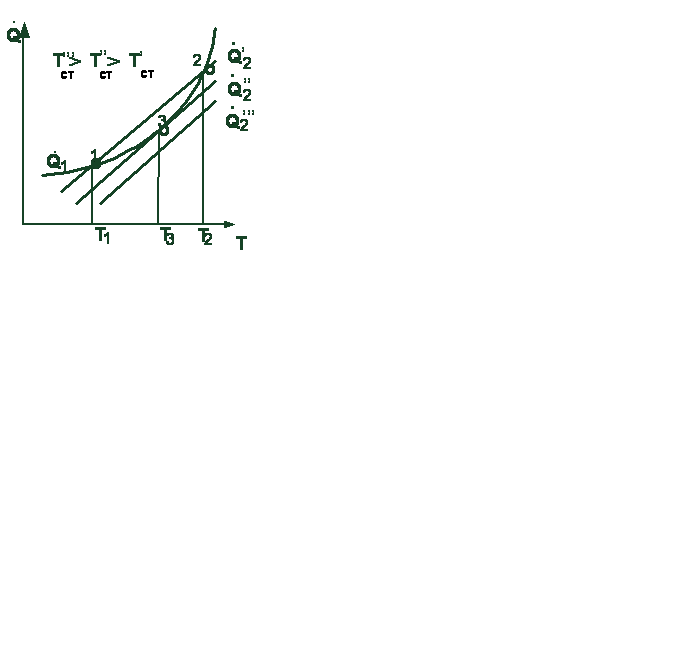 сиси взаимное расположение линий, определяемых уравнениями (3.2) и (2.3),
(2.3 может быть различным (рис. 3.2). Так, при температуре стенки Т ׳ ст ли-ии пернии пересекаются в двух точках, при темтемпературе стенки Т ׳׳ст линии касаются др друг друга в одной точке.
Рас Рассмотрим первый случай взаимногного расположения линий. При температуртуре смеси Т < Т1 тепловыделение болбольше теплоотвода, и за счет этого пропроисходит разогрев смеси до некоторой температуры Т1. Нагрев смеси до большей температуры произойти не может, так как тептеплоотвод превышает тепловыделение. СоСостояние системы в области температур тур до Т1 характеризуется незначитель-ныным нагревом горючей смеси и малой 3.2. Зависимость теплоподвода и
скскоростью реакции. Воспламенения нет. теплоотвода от температуры топ-
сиси взаимное расположение линий, определяемых уравнениями (3.2) и (2.3),
(2.3 может быть различным (рис. 3.2). Так, при температуре стенки Т ׳ ст ли-ии пернии пересекаются в двух точках, при темтемпературе стенки Т ׳׳ст линии касаются др друг друга в одной точке.
Рас Рассмотрим первый случай взаимногного расположения линий. При температуртуре смеси Т < Т1 тепловыделение болбольше теплоотвода, и за счет этого пропроисходит разогрев смеси до некоторой температуры Т1. Нагрев смеси до большей температуры произойти не может, так как тептеплоотвод превышает тепловыделение. СоСостояние системы в области температур тур до Т1 характеризуется незначитель-ныным нагревом горючей смеси и малой 3.2. Зависимость теплоподвода и
скскоростью реакции. Воспламенения нет. теплоотвода от температуры топ-
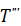 ) воспламенение устойчиво.
) воспламенение устойчиво. При поджигании у источника воспламенения образуется п л а м я.
При поджигании у источника воспламенения образуется п л а м я. τ к
τ к Скорость распространения фронта пламени относительно неподвижной топливной смеси или относительно потока смеси по нормали к поверхности фронта пламени называется н о р м а л ь н о й скоростью распространения пламени, которая обозначается uн.
Скорость распространения фронта пламени относительно неподвижной топливной смеси или относительно потока смеси по нормали к поверхности фронта пламени называется н о р м а л ь н о й скоростью распространения пламени, которая обозначается uн. , определяют нормальную скорость горения:
, определяют нормальную скорость горения:


 Рис. 3.3. Горелка
Снижение нормальной скорости (уменьшение температуры, изменение состава смеси и т.д.) будет сопровождаться увеличение высоты конуса, что
может привести к отрыву пламени. При увеличении
Рис. 3.3. Горелка
Снижение нормальной скорости (уменьшение температуры, изменение состава смеси и т.д.) будет сопровождаться увеличение высоты конуса, что
может привести к отрыву пламени. При увеличении  Рис. 3.3
Рис. 3.3
 τк.
τк. .
. =
=  ,
,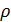 см и ср см плотность и теплоемкость топливной смеси;
см и ср см плотность и теплоемкость топливной смеси; =
= 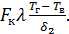
 На основании баланса теплоты
На основании баланса теплоты  получим
получим =
=  .
.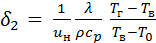 =
= 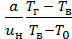 .
.

 тановить некоторые зависимости, характеризующие скорость горения жидкого горючего в целом.
тановить некоторые зависимости, характеризующие скорость горения жидкого горючего в целом. Слой 4 по составу смеси паров горючего
Слой 4 по составу смеси паров горючего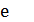
 , (3.5)
, (3.5) – температура в зоне горения;
– температура в зоне горения; – температура испарения жидкости;
– температура испарения жидкости;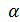 – коэффициент теплоотдачи.
– коэффициент теплоотдачи.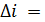 сж (Тисп
сж (Тисп 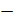 Тж) + r + cp
Тж) + r + cp 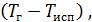


 .
.


