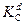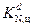Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчет Ван-дер-ваальсовых объемовСодержание книги
Поиск на нашем сайте
СОДЕРЖАНИЕ
СОДЕРЖАНИЕ. 3 ВВЕДЕНИЕ. 4 1. МЕТОД АСКАДСКОГО.. 4 1.1 Сущность метода инкрементов. 4 1.2 Расчет Ван-дер-ваальсовых объемов. 6 2. РАСЧЕТ ОСНОВНЫХ ФИЗИКО-ХИМИЧЕСКИХ СВОЙСТВ ПОЛИМЕРОВ.. 9 2.1 Характерные температуры полимеров. 9 Температура стеклования. 9 Температура плавления. 11 Температура деструкции. 12 2.2 Оптические свойства полимера. 13 Показатель преломления. 13 Коэффициент оптической чувствительности по напряжению.. 14 2.3 Диэлектрическая проницаемость полимеров. 16 2.4 Растворимость полимеров. 17 Плотность энергии когезии полимеров и параметр растворимости Гильдебранда. 17 Критерий растворимости. 18 2.5 Теплоемкость. 19 3. ЗАКЛЮЧЕНИЕ. 20 4. ЗАДАНИЕ ДЛЯ КУРСОВОЙ РАБОТЫ.. 20 СПИСОК ЛИТЕРАТУРЫ.. 22 ПРИЛОЖЕНИЯ.. 23
ВВЕДЕНИЕ
В настоящее время существует три основных подхода для количественной оценки физических свойств полимеров, которая осуществляется на основе строения их повторяющегося звена. Один из таких подходов, развитый Ван Кревеленом основан на идее «групповых вкладов». Согласно этому методу записываются простейшие эмпирические выражения аддитивного типа. При этом данная группа, находясь в составе различных полимерных звеньев, вносит один и тот же вклад в рассчитываемую характеристику (температуру стеклования, плавления и т.д.). Это чисто эмпирический подход, имеющий ряд недостатков, однако с помощью метода Ван Кревелена можно достаточно точно рассчитать физические свойства ряда линейных полимеров. Следующий подход, основанный А.А. Аскадским и Ю.И. Матвеевым, является полуэмпирическим. Согласно этому подходу, уравнения для расчета физических свойств получены на основе представления физики тела, а калибровка метода осуществляется с помощью физических характеристик полимеров, свойства которых уже давно и хорошо изучены. Использование данного подхода позволяет с достаточной точностью оценить многие физические свойства полимеров и сополимеров. Третий подход, предложенный Дж. Бицерано, основан на индексах связанности, что на практике сводится к поиску различных корреляций физических свойств с множеством правил, для определенич коэффициентов корреляционных зависимостей. В данных методических указаниях разъясняется суть метода, предложенного А.А. Аскадским и Ю.И. Матвеевым.
МЕТОД АСКАДСКОГО Сущность метода инкрементов
Пусть нам надо определить какую-то величину Q (в качестве Q может быть величина, обратная температуре плавления (Тm) или стеклования (Tg), плотности упаковки, коэффициента объемного расширения и т.д.) для полимера с заданным химическим строением повторяющегося звена. Тогда согласно методу инкрементов:
Если рассматривается процесс плавления полимера или вклад в коэффициент объемного расширения, тогда в качестве Qi будет выступать энергия Ван-дер-ваальсового взаимодействия. Если нас интересует температура деструкции, то в этом случае используется энергия химической связи. Однако эти не ограничивается вклад значения Qi в Q. Наряду с указанными выше взаимодействиями групп атомов могут образовываться новые типы взаимодействия, которые существенно влияют на термодинамические свойства полимеров. Так группы -OH, -NHCO и прочие образуют водородные связи, а группы -С=N, -Cl, -COO и аналогичные приводят к возникновению сильного диполь - дипольного взаимодействия. Все эти факторы необходимо учитывать. Таким образом, уравнения для расчета физико-химических характеристик полимера основаны на физическом подходе. Общим для всех этих уравнений является суммирование ряда атомных констант, характеризующих вклады в энергию межмолекулярного взаимодействия, энергию химических связей, Ван-дер-ваальсовый объем и т.д. Поход, используемый для расчета свойств полимерных материалов, является полуэмпирическим, причем калибровка метода основывается на так называемых полимерных стандартах, свойства которых детально изучены. Например, калибровку метода инкрементов можно рассмотреть на примере температуры стеклования, при этом уравнение (1) преобразуется к виду:
где ai – атомные константы, bj – константы связанные с энергией сильного межмолекулярного взаимодействия, возникающего между полимерными цепями за счет имеющихся в них полярных групп,
На основании уравнения (3) составляется избыточная система линейных уравнений, которая выглядит как:
Далее составляется матрица коэффициентов при неизвестных этой избыточной системы уравнений и столбовая матрица свободных членов этих уравнений. В результате получается каноническая система уравнений, которая решается одним из известных методов, например, методом Гаусса. Вся процедура калибровки осуществляется с помощью стандартных ЭВМ программ. Полимеры, которые выбираются для калибровки, должны обладать экспериментальными значениями анализируемых физико-химических характеристик как можно в более широких пределах. Химическое строение полимеров также должно быть разным. Обычно решается система из 30-40 уравнений, что соответствует 30-40 различным полимерам. Далее, по полученным коэффициентам можно рассчитать свойства других полимеров. При этом определяются так же такие характеристики, как энергия слабого дисперсионного взаимодействия, энергия сильных диполь - дипольных взаимодействий, водородных связей и другие [2]. ПОЛИМЕРОВ Температура стеклования Температура стеклования (Тg) является важной характеристикой полимеров, в значительной степени определяющей области их технологического применения. Процесс стеклования представляет собой переход вещества из жидкого состояния в твердое, но неупорядоченное состояние [3-5]. Выражение, устанавливающее связь между температурой стеклования и строением повторяющегося звена, выглядит следующим образом [1, 2]:
где Тg – температура стеклования, DVi – Ван-дер-ваальсовый объем повторяющегося звена, ai и bi – числовые значения, характерные для каждого атома и каждого типа межмолекулярного взаимодействия, определены с помощью статистической обработки экспериментальных данных по методу «наименьших квадратов», описанному выше. Вывод формулы (6) и последующих формул, которые будут использоваться в дальнейших расчетах, подробно описан в работах А.А. Аскадского [1-4]. Числовые константы ai и bi напрямую зависят от коэффициента объемного расширения и от коэффициента молекулярной упаковки полимеров:
Согласно допущениям, сделанным в работах [1,2], коэффициент молекулярной упаковки полимеров различного химического строения примерно одинаков при температуре стеклования каждого из полимеров и равен 0,667 (для линейных полимеров). Вблизи абсолютного нуля коэффициент молекулярной упаковки также практически одинаков для всех полимеров и равен 0,731. Тогда формулу (7) можно записать как:
Рассчитанные значения инкрементов ai, bi, ai и bi представлены в приложении 2. При этом необходимо указать некоторые уточнения к приложению 2. Во-первых, параметры bd и bd вводятся для каждого разветвления в основной и боковой цепи, они также вводятся при наличии полярной группы любого типа; если в алифатических полимерах при одном атоме углерода находятся две ―CH3 группы или два атома Cl, F, то инкремент bd не вводится. Для фрагментов: Учитывая вышесказанное, температуры стеклования полистирола и полидиметилсилоксана можно рассчитать по формуле (6) с использованием значений Ван-дер-ваальсовых объемов и инкрементов (приложение 2) [1, 2]:
Тогда:
Расчеты дают хорошее соответствие с экспериментальными данными. Относительная погрешность вычисления температуры стеклования составляет 8 и 0 % для полистирола и полидиметилсилоксана соответственно. В работах [1, 2] приведены таблицы рассчитанных температур стеклования полимеров различного химического строения. Температура плавления Температура плавления (Tm) определяется как температура, при которой полимер переходит из кристаллического состояния в вязкотекучее состояние. Микрокристаллические полимеры вследствие их структурных особенностей не обладают четкой температурой плавления [5]. Как следствие, температура плавления является физической характеристикой полимера, которая трудно поддается расчету на основании строения полимерного звена [2]. Существует два возможных подхода для расчета данной физической характеристики, один из которых основан на соотношении температуры стеклования (Tg) и температуры плавления (Tm). При этом следует отметить, что по правилу Бимена Tg/ Tm» 2/3. Уравнение, связывающее температуру стеклования с температурой плавления, получено на основании экспериментальных данных [1, 2]:
где Другой поход основан на рассмотрении повторяющегося звена полимера как набора ангармонических осцилляторов. Согласно выводам, приставленным в работах [1, 2], температуру плавления (Tm) полимера можно определить как:
Значение Ki определяется числом атомов образующих повторяющееся звено. Но так как сочетание некоторых групп атомов приводит к диполь-дипольному взаимодействию, водородным связям и т.д., то последние можно учесть путем добавления к энергиям дисперсионных взаимодействий Di той доли энергии сильного межмолекулярного взаимодействия, которая обусловлена вкладом i -го атома. Тогда:
где
В работах [1, 2, 4] приведены таблицы расчетных значений температур плавления, вычисленных по формулам (8) и (9), ряда полимеров в сравнении с экспериментальными данными. Температура деструкции Согласно [5] деструкция высокомолекулярных соединений это расщепление макромолекул на низкомолекулярные вещества. При нагревании полимера происходит изменение его объема, причем это изменение складывается из двух частей: увеличение свободного объема и изменение длин связей. Анализ этих изменений привел к следующей зависимости температуры начала интенсивной термической деструкции (Td) от параметров химического строения:
где
где d 0 – равновесное расстояние между химическими атомами; E – энергия диссоциации химических связей. С учетом уравнений (10) и (11) температура термодеструкции (Td) определяется из соотношения:
где параметр
В случае распада по C―Н связям d0 = 1,08 Ǻ, E = 395 кДж/моль, a = 0,266 Ǻ-1. Значения Поскольку атомы входят в состав полярных групп, обладающих специфическим межмолекулярным взаимодействием, то вклад их в термостойкость отличен от вклада, вносимого теми же атомами, обладающими лишь обычным Ван-дер-ваальсовым взаимодействием. Обычно в полимерах имеются следующие полярные группы:
При расчете Td по уравнению (12) учет межмолекулярных взаимодействий проводится следующим образом. Если атом не входит в состав полярной группы, то его вклад обозначается Примеры расчета величин Td для представителей различных классов полимеров приведены в работах [1, 2, 4]. Показатель преломления Среди оптических свойств полимера важнейшим является показатель преломления. Эта характеристика самым непосредственным образом связана с диэлектрической проницаемостью вещества. В общем случае в диэлектрическую проницаемость вносят вклад три молекулярных процесса: ориентация постоянных моментов в поле, относительное смещение положительных и отрицательных ионов внутри молекулы и смещение электронов относительно ядер. Эти три процесса описывают соответственно ориентационную, атомную и электронную поляризации.
Изменение показателя преломления (n) в зависимости от плотности при данной частоте с поправкой Лорентца подчиняется закону:
где M – молекулярная масса (повторяющегося звена в случае полимеров); r - плотность; R – мольная рефракция. Мольная рефракция (R) является аддитивной величиной и складывается из рефракций (Ri) отдельных атомов и типов химических связей. Значения Ri, необходимые для расчета, приведены в таблице приложения 5.1, составленной Эйзенлором для волны 0,5893 мкм (D) В случае стеклообразных полимеров плотность (r) рассчитывается по формуле:
Подстановка уравнения (14) в уравнение (13) дает:
где N A – число Авогадро; k ср – средний коэффициент молекулярной упаковки (для блочных монолитных тел k ср = 0,681, для пленок k ср = 0,695); mi – число атомов i -го типа в повторяющемся звена; ri – удельная рефракция атомов i -го типа; Ai – атомная масса. Уравнение (15) позволяет с достаточной точностью оценить показатель преломления полимеров на основе их химического строения. Расчеты свидетельствуют о хорошем совпадении экспериментальных и расчетных значений показателя преломления [1, 2, 4]. Расхождения между измеренными и вычисленными значениями для ряда полимеров вызваны тем, что температура их стеклования является сравнительно низкой и коэффициент молекулярной упаковки имеет меньшее значение, чем средняя величина 0,681, принятая в расчете. Для более точного расчета показателя преломления в формулу (15) нужно поставить не среднее, а реальное значение коэффициента молекулярной упаковки [1-4]. Растворимость полимеров Критерий растворимости Проблема предсказания растворимости полимеров является актуальной в течение многих лет. Один из способов предварительной оценки растворимости полимера является сопоставление величин параметров растворимости Гильдебранда для полимера d п и растворителя d р. При этом считается, что если соблюдается условие d п » d р, то можно ожидать растворения полимера в данном растворителе. Опыт показывает, однако, что с помощью такого сопоставления можно лишь уверено «отбросить» те растворители, в которых растворение данного полимера происходить не будет. Это системы, для которых d п >> d р или d п >> d р. С помощью такой оценки удается значительно сузить круг подлежащих проверке растворителей, в которых полимер может растворяться. Оценки и опыт показывает, что, например, из 160 растворителей можно таким способом сразу же для каждого полимера исключить из рассмотрения 120-130 органических жидкостей, как явно не пригодных для растворения. В оставшихся растворителях, подчиняющихся условию d п » d р, примерно в половине из них полимер будет растворим. Следовательно, соблюдение условия d п » d р не может дать гарантию растворимости полимера. Желательно иметь более точный способ предварительной оценки растворимости полимера по отношению к тем растворителям, для которых соблюдается условие d п » d р. Например, в работе [2] описывается еще один критерий, который обладает достаточно высокой предсказательной силой. Условие предсказания растворимости полимера учитывает не только химическое строение, но и конкретную надмолекулярную структуру полимера:
где
Здесь V р и V п – соответственно мольные объемы растворителя и полимера (в расчете на 1 звено). Заметим, что значение F порядка единицы. Выражение (25) применяется в случае, когда полимер не набухает. В противном случае выражение (25) принимает вид:
Из выражения (27) следует, что существует величина Теплоемкость
Под теплоемкостью подразумевается количество тепла, которое нужно затратить на нагревание тела на 1°С. Различают молярную теплоемкость, если речь идет о моле вещества, и удельную, если говорят об 1 г вещества. Теплоемкость при постоянном давлении Ср равняется скорости изменения энтальпии с ростом температуры, а теплоемкость при постоянном объеме СV – скорости изменения внутренней энергии с ростом температуры. В довольно широком интервале температур теплоемкость увеличивается линейно с ростом температуры, причем температурный коэффициент роста теплоемкости для твердых полимеров имеет среднюю величину 3×10-3. При фазовом или физическом переходе полимера теплоемкость меняется скачком. Зависимость теплоемкости от строения повторяющегося звена полимера выглядит как:
и
где Величины ЗАКЛЮЧЕНИЕ
Таким образом, используя метод инкрементов Аскадского можно рассчитать следующие физико-химические характеристики полимеров: температуры стеклования, плавления и деструкции, показатель преломления, коэффициент оптической чувствительности по напряжению, диэлектрическая проницаемость, плотность полимера при комнатной температуре, плотность энергии когезии и параметр растворимости Гильдебранда, теплоемкость. В действительности же описанный выше метод уже успешно применен для написания ряда компьютерных программ (CHEOPS Ô, Polymer Design Tool Ô), с помощью которых, основываясь на данные о строении повторяющегося звена полимера (сополимеров) можно рассчитать до 54 различных физико-химических характеристик, включая вышеперечисленные. Более того, с помощью программы CHEOPS Ô можно решать обратные задачи, т.е. по предполагаемым физико-химическим свойствам осуществлять компьютерный синтез полимеров. Подобнее об этом можно узнать в работах [2, 4]. ЗАДАНИЕ ДЛЯ КУРСОВОЙ РАБОТЫ
Студент получает номер задания и из приложения 8 «выбирает» полимер и атом или группу атомов для молекулярного дизайна. Курсовая работа должна состоять минимум из пяти частей. Впервой части следует описать выбранный полимер: вид повторяющегося звена, промышленное получение, применение и свойства. Во второй части необходимо рассчитать геометрические характеристики молекулярной цепи исходного полимера, основываясь на знаниях, полученных в ходе посещения лекционных занятий по дисциплине «Физико-химические основы полимерных материалов». Т.е. в данной части приводится расчет контурной длины полимера (L), среднеквадратичного радиуса клубка макромолекулы (R 2), объема гауссова клубка (V), критической концентрации (C*), радиуса полимерного клубка (r), плотности полимера (d) и момента инерции (I). В третьей части работы необходимо привести расчет по методу Аскадского вышеописанных физико-химических свойств выбранного полимера, включая выбор растворителя по критериям растворимости. Четвертая часть курсового проекта должна быть посвящена молекулярному дизайну. Посредством замещения атома водорода в повторяющемся звене полимера, «синтезируется» новый полимер, после чего рассчитываются его физико-химические свойства. Рекомендуется для наглядности произвести замещение не менее пяти атомов водорода и проследить, как меняются основные физико-химические свойства «синтезированных» полимеров при последовательном замещении. Необходимо проиллюстрировать свои наблюдения с помощью таблиц и соответствующих графиков. И, наконец, пятая часть работы отведена под выводы: здесь основываясь на знаниях о строении вещества и полученных результатов расчетов, предположить вероятность существования смоделированных полимеров. В конце работы необходимо привести список литературы. Рекомендуется все необходимые расчеты проводить с использованием приложения Microsoft Office Excel. Защита курсовой работы должна сопровождаться демонстрационным материалом. При этом рекомендуется использовать приложение Microsoft Office Power Point. СПИСОК ЛИТЕРАТУРЫ Основная 1. Аскадский А.А. Химическое строение и физические свойства полимеров / А.А. Аскадский, Ю.И. Матвеев – М: Химия, 1983, – 248 с. 2. Аскадский А.А. Компьютерное материаловедение полимеров. Т.1. Атомно-молекулярный уровень / А.А. Аскадский, В.И. Кондращенко – М: Научный мир, 1999, – 543 с. Дополнительная 3. Аскадский А.А. Лекции по физикохимии полимеров / А.А. Аскадский, – М.: Физический факультет МГУ, 2001, – 223 с. 4. Askadskii A.A. Computational Materials Science of Polymers / A.A. Askadskii, – Cambridge, Cambridge International Science Publishing, 2003. 5. Шур А.М. Высокомолекулярные соединения / А.М. Шур. – М.: Высш.шк., 1981, – 657 с.
ПРИЛОЖЕНИЯ Приложение 1 Значения Ван-дер-ваальсовых объемов некоторых атомов [1, 2], Ǻ3
* – индекс i -го Ван-дер-ваальсового объема данного атома соответствует номеру индекса в работе [2].
Приложение 2
Значения инкрементов ai, bi, ai и bi для различных атомов и типов межмолекулярного взаимодействия для расчета температуры стеклования
1 – Когда число (n) ─CH2─ групп, приходящих на одну ─NHCO─ группу, n > 5, вводятся дополнительные инкременты b CH2 = -23,00 в количестве m ×(n - 5), где m – количество ─NHCO─ групп входящих в повторяющееся звено. 2 – Если n > 6, то b CH2 = -23,00, в количестве (n - 6). Более подробно в работе [2]. Приложение 3.1
Значение параметров δi и γi различных атомов и типов межмолекулярного взаимодействия для расчета температуры плавления по формуле (8)
1 – более подробно изложено в работе [2]. Приложение 3.2
Значения Ki, D 0, i и Δ D 0, I для атомов водорода и кислорода для расчета температуры плавления по формуле (9)
Приложение 4 Условные обозначения и численные значения констант для расчета температуры деструкции
Приложение 5.1
Атомные рефракции ряда атомов в органических соединениях по Эйзенлору для расчета коэффициента преломления
|

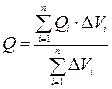 .
.
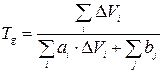 ,
,
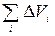 – Ван-дер-ваальсовый объем повторяющегося звена полимера. Уравнение (2) может быть преобразовано к виду:
– Ван-дер-ваальсовый объем повторяющегося звена полимера. Уравнение (2) может быть преобразовано к виду: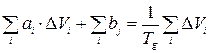 .
.
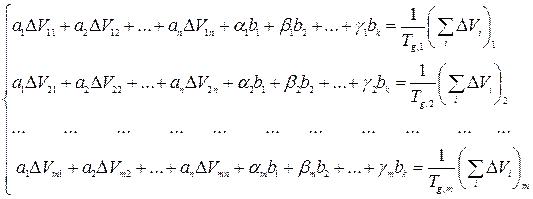
 ,
,
 .
.
 .
.
 ,
,  ,
,  и
и 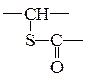 вводится дополнительный инкремент bd = 51. Во-вторых, инкремент bh вводится при наличии водородной связи любого типа кроме полиамидов, инкременты для которых приведены в работе [2]. В-третьих, инкременты b п, b м, b ои b п, b м, b овводятся при замещение ароматических ядер в пара-, мета- и орто- положениях соответственно; количество этих инкрементов равно количеству замещенных ядер. В случае структуры
вводится дополнительный инкремент bd = 51. Во-вторых, инкремент bh вводится при наличии водородной связи любого типа кроме полиамидов, инкременты для которых приведены в работе [2]. В-третьих, инкременты b п, b м, b ои b п, b м, b овводятся при замещение ароматических ядер в пара-, мета- и орто- положениях соответственно; количество этих инкрементов равно количеству замещенных ядер. В случае структуры  вводятся 2 bп и 2 bп.
вводятся 2 bп и 2 bп.

 ,
,

 (ki – парциальный коэффициент упаковки i -атома); γi – инкременты, учитывающие вклад сильных межмолекулярных взаимодействий;
(ki – парциальный коэффициент упаковки i -атома); γi – инкременты, учитывающие вклад сильных межмолекулярных взаимодействий;  . Значения δi и γi представлены в приложении 3.1. Расчеты, проведенные по формуле (8), дают хорошее совпадение с экспериментом. Однако температура плавления сополимеров не может быть описана простым соотношением, полученным на основе уравнения (8).
. Значения δi и γi представлены в приложении 3.1. Расчеты, проведенные по формуле (8), дают хорошее совпадение с экспериментом. Однако температура плавления сополимеров не может быть описана простым соотношением, полученным на основе уравнения (8). .
.
 и т.д.,
и т.д.,
 – вклад атома i -го типа в диполь-дипольное взаимодействие;
– вклад атома i -го типа в диполь-дипольное взаимодействие;  – вклад атома i -го типа в водородную связь и т.д. Расчеты, проведенные по уравнению (9) показали, что ряда полимеров достаточно знать параметры D H,
– вклад атома i -го типа в водородную связь и т.д. Расчеты, проведенные по уравнению (9) показали, что ряда полимеров достаточно знать параметры D H,  , D O и
, D O и  (приложение 3.2) для удовлетворительного расчета температур плавления, исходя из химического строения повторяющегося звена. Следует отметить, что, во-первых, формула (9) применяется только для полимеров содержащих атомы водорода, кислорода и углерода; а во-вторых, несмотря на хорошую сходимость экспериментальных и расчетных данных, данный метод расчета Tm имеет ограниченное применение.
(приложение 3.2) для удовлетворительного расчета температур плавления, исходя из химического строения повторяющегося звена. Следует отметить, что, во-первых, формула (9) применяется только для полимеров содержащих атомы водорода, кислорода и углерода; а во-вторых, несмотря на хорошую сходимость экспериментальных и расчетных данных, данный метод расчета Tm имеет ограниченное применение. ,
,
 – парциальный объем расширения i -го атома, возникающего за счет изменения длин химических связей. При этом:
– парциальный объем расширения i -го атома, возникающего за счет изменения длин химических связей. При этом: ,
,
 ,
,
 – параметр, характерный для каждого атома и типа межмолекулярного взаимодействия и зависящий от энергии химических связей распадающихся в процессе деструкции. При этом:
– параметр, характерный для каждого атома и типа межмолекулярного взаимодействия и зависящий от энергии химических связей распадающихся в процессе деструкции. При этом: .
.

 или
или  (h – водородная связь, d – диполь-дипольное взаимодействие), и только
(h – водородная связь, d – диполь-дипольное взаимодействие), и только 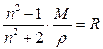 ,
,
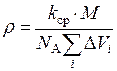 .
.
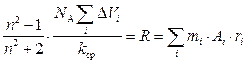 ,
,
 ,
,
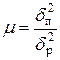 ; dп и dр – параметры Гильдебранда соответственно для полимера и растворителя; r – константа; gп и gр – поверхностное натяжение полимера и растворителя соответственно.
; dп и dр – параметры Гильдебранда соответственно для полимера и растворителя; r – константа; gп и gр – поверхностное натяжение полимера и растворителя соответственно. .
.

 , при которой возможна растворимость (например, при F» 0,95; а min = 0,1). Поскольку m всегда положительна, растворимость возможна при а min < а < 1. Тогда максимальное значение m max будет: m ma = 2 r ×F2. Таким образом, согласно критерию (27), растворимость будет наблюдаться в том случае, когда правая часть уравнения (27) будет больше левой части, причем обе части критерия вычисляются на основании химического строения повторяющегося звена полимера и молекулы растворителя [2].
, при которой возможна растворимость (например, при F» 0,95; а min = 0,1). Поскольку m всегда положительна, растворимость возможна при а min < а < 1. Тогда максимальное значение m max будет: m ma = 2 r ×F2. Таким образом, согласно критерию (27), растворимость будет наблюдаться в том случае, когда правая часть уравнения (27) будет больше левой части, причем обе части критерия вычисляются на основании химического строения повторяющегося звена полимера и молекулы растворителя [2].
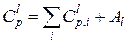 ,
,
 и
и  – молярные теплоемкости полимера, находящегося в стеклообразном и высокоэластическом состоянии, соответственно;
– молярные теплоемкости полимера, находящегося в стеклообразном и высокоэластическом состоянии, соответственно;  и
и 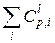 – инкременты для каждого атома, имеющие смысл приведенной к единице Ван-дер-ваальсового объема теплоемкости, действующие, соответственно, в стеклообразном и высокоэластическом состояниях; As и Al – параметры, равные As = 0,77 кал/(моль×град), Al = 0,69 кал/(моль×град).
– инкременты для каждого атома, имеющие смысл приведенной к единице Ван-дер-ваальсового объема теплоемкости, действующие, соответственно, в стеклообразном и высокоэластическом состояниях; As и Al – параметры, равные As = 0,77 кал/(моль×град), Al = 0,69 кал/(моль×град).