
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Занятие №3. Фармакогностический анализ лекарственного растительного сырья.Содержание книги
Поиск на нашем сайте
Фармакогнозия Методические указания
Занятие №3. ФАРМАКОГНОСТИЧЕСКИЙ АНАЛИЗ ЛЕКАРСТВЕННОГО РАСТИТЕЛЬНОГО СЫРЬЯ. Химический анализ цельного лекарственного растительного сырья. Список условных сокращений БАВ – биологически активное вещество ВЭЖХ - высокоэффективная жидкостная хроматография ГХ – газовая хроматография ГФ РБ – Государственная Фармакопея Республики Беларусь, первое издание, в трех томах; ГФ РБ II – Государственная Фармакопея Республики Беларусь, второе издание, том 1 ЛР – лекарственное растение ЛРС – лекарственное растительное сырье ЛС – лекарственное средство МЗ РБ – Министерство здравоохранения Республики Беларусь НД – нормативный документ, нормативная документация РБ – Республика Беларусь СО – стандартный образец УФ – ультрафиолетовый ФС – фармакопейная статья Учебные цели
Подготовка к занятию 1. Общая характеристика БАВ-представителей витаминов, дубильных веществ. Классификация, физико-химические свойства, локализация, биохимическая роль в растениях, химическое строение и химические свойства. Методы выделения и анализа. 2. Ознакомиться с требованиями разделов и общих статей ГФ РБ: · «Общие сведения»; · «Реактивы», в т.ч. «Реактивы, титрованные растворы для объемного анализа»; · «Определение показателя горечи»; · «Определение содержания экстрактивных веществ»; · «Коэффициент набухания»; · «Определение содержания эфирного масла».
Содержание занятия
Теоретические основы темы I. Общие сведения ГФ РБ Для правильного и эффективного пользования ГФ РБ необходимо знать общие для всех ФС ГФ РБ правила и положения. Основные из них перечислены ниже. ● Положения статьи «Общие сведения» распространяются на все общие статьи, частные статьи и другие материалы ГФ РБ. ФС ГФ РБ можно разделить на общие и частные. Все общие ФС и монографии ГФ РБ гармонизированы с Европейской фармакопеей и построены в следующем формате: - адаптированный перевод соответствующего материала ЕФ; - национальные дополнительные испытания, информационные и иные материалы отмечены значком «#». Ссылка в материалах Фармакопеи на какую-либо статью и/или ее раздел означает, что продукт соответствует требованиям этой статьи. Название статьи, на которую дается ссылка, и/или ее номер обычно выделены курсивом. Требования частных статей ГФ РБ являются обязательными, если нет специальных указаний в статье «Общие сведения» или в НД производителя. Общие статьи становятся обязательными, когда на них приводится ссылка в той или иной монографии или общей статье, если только специально не указано, что ссылка приводится исключительно как информация или рекомендация. ● НД по контролю качества производителя ЛС (субстанции, ЛРС) может содержать не все тесты (испытания), приведенные в аналогичной частной статье ГФ. Для подтверждения соответствия ЛС требованиям ГФ РБ производитель при выпуске должен представить доказательства того, что ЛС соответствует фармакопейному качеству, исходя из результатов валидационных испытаний в сочетании с результатами контроля процесса производства данного ЛС. Такой подход, если компетентные уполномоченные органы (МЗ РБ и УП «Центр экспертиз и испытаний в здравоохранении») считают его обоснованным, не противоречит необходимости соответствия требованиям ГФ. Испытания и методики количественного определения, приведенные в ГФ РБ, являются официальными методиками, однако по согласованию с компетентными уполномоченными органами могут использоваться и другие методики, при условии, что они дают результаты, соответствующие фармакопейным методикам. В случае сомнений или разногласий решающей является фармакопейная методика. ● Общая фармакопейная статья на ту или иную лекарственную форму распространяется на все ЛС, изготовленные в виде этой ЛФ. Для конкретного ЛС требования соответствующей общей фармакопейной статьи не обязательно являются исчерпывающими и могут быть дополнены компетентным уполномоченным органом в частной статье производителя. ● Словосочетание «если нет других указаний в частной статье» (под частной статьей подразумевается частная статья ГФ РБ на субстанцию или аналитический нормативный документ производителя, утвержденный уполномоченным органом) означает, что требования общей статьи должны быть выполнены, если только компетентный уполномоченный орган не внес в эти требования изменения, что указывается в частной статье. ● В некоторых общих статьях и частных статьях ГФ при описании реактива, микроорганизма, методики и т.д. используется термин «подходящий». Если при этом критерии их пригодности не сформулированы, то пригодность конкретных реактивов, методик и т.д., используемых в НД, должна быть обоснована перед компетентным уполномоченным органом. ● Количество вещества. При описании количественного определения или испытания с численно заданными пределами количество вещества, необходимое для проведения испытания, может отклоняться в пределах +10% от указанного количества. Необходимо взять точную навеску анализируемого вещества (или отмерить его каким-либо другим способом) и все вычисления производить для этого точного количества вещества. Например, если методика предписывает взять навеску вещества или ЛРС массой 1,00 г, то это значит, что фактически может быть использована навеска массой от 0,90 г до 1,10 г (±10%). Если в частной статье не указана точность взятия навески, вещество должно быть точно взвешено («точная навеска») таким образом, чтобы неточность взвешивания не превышала 0,1% от желаемого. Для титриметрического определения взвешивание должно обеспечивать то количество значащих цифр в навеске, которое соответствует количеству значащих цифр в концентрации титранта. Если пределы испытания заданы не численно, а определяются путем сравнения со стандартом при тех же условиях, для испытания берут строго указанное количество вещества. Реактивы всегда берут в строго указанных количествах. Если значения массы навесок или объемов не используют для дальнейших расчетов, то точность их взятия (отмеривания, отвешивания) должна согласовываться с указанной в статье точностью. Точность взвешивания должна быть ±5 единиц после последней указанной цифры; например, навеска 0,25 г может находиться в пределах от 0,245 г до 0,255 г, а навеска 0,2 г – от 0,15 г до 0,25 г. Объемы отмеривают следующим образом: если после десятичной запятой стоит 0 или число, заканчивающееся 0 (например, 10,0 мл или 0,50 мл), требуемый объем отмеривают с помощью пипетки, мерной колбы или бюретки. В остальных случаях можно использовать градуированный мерный цилиндр или градуированную пипетку. Микролитры отмеривают с помощью микропипетки или микрошприца. ● Если для проведения испытания или количественного определения требуется использовать растворитель с растворенным в нем индикатором и при этом не предусмотрен контрольный опыт, этот растворитель предварительно нейтрализуют по этому индикатору. ● Контрольный опыт. Под контрольным опытом подразумевают определение, проводимое с теми же количествами реактивов и в тех же условиях, но без испытуемого образца. ● Водяная баня. Если нет других указаний, то подразумевается баня с кипящей водой. Можно использовать и другие способы нагревания, если они гарантированно обеспечивают температуру, близкую, но не превосходящую 100˚С (или другую указанную температуру). ● Ледяная баня. Подразумевается баня с температурой 0˚С. Если необходимо охлаждение до более низкой температуры, применяют смесь льда с некоторыми электролитами (соли, кислоты). ● Высушивание и прокаливание до постоянной массы. Результаты двух последних взвешиваний должны отличаться не более чем на 0,5 мг; интервал времени между двумя взвешиваниями определяется свойствами и количеством высушиваемого/прокаливаемого остатка. В тех случаях, когда требуется высушивание «в эксикаторе» или «в вакууме», оно осуществляется в соответствии с условиями, описанными в статье «Потеря в массе при высушивании» (2.2.32, ГФ РБ II, т.1). ● Реактивы. Надежность результатов, получаемых с помощью методик, описанных в ФС, зависит, в частности, от качества используемых реактивов. Реактивы описаны в общей ФС «Реактивы». Подразумеваемая степень чистоты – не ниже квалификации «аналитической чистоты» (analytical grade) или квалификации «чистый для анализа» (ч.д.а.). Для некоторых реактивов включены испытания для определения пригодности. ● Растворители. Если для растворов не указан растворитель, то подразумевают водные растворы. Для проведения описанных в ФС аналитических операций и для приготовления реактивов используют воду, соответствующую требованиям частной статьи «Вода очищенная». Термин «вода дистиллированная» означает «вода очищенная», полученная путем дистилляции. Термин «этанол» без уточнений означает абсолютный спирт. Термин «спирт» без уточнений означает этиловый спирт, содержащий примерно 96 объемных процентов этанола. Другие степени разбавления обозначаются термином «спирт» с указанием содержания этанола в объемных процентах. Термин «эфир» без уточнений означает диэтиловый эфир. ● Способы выражения концентрации. Выражение «%» может иметь одно из трех значений: - массовый процент (м/м) – число граммов вещества в 100 граммах конечного продукта; - объемный процент (об/об) – число миллилитров вещества в 100 миллилитрах конечного продукта; - массо-объемный процент (м/об) – число граммов вещества в 100 миллилитрах конечного раствора. Обозначение «ppm» (частей на миллион) подразумевает массовое соотношение. Если указано, что при приготовлении смеси растворителей их берут в соотношении (a:b), то имеется в виду соотношение объемов. Например, соотношение: гексан-бензол (1:3) означает, что смешивают 1 объем гексана с 3 объемами бензола. ● Температура. Кроме конкретного указания температуры при проведении испытаний используют также следующие термины: - глубокое охлаждение – ниже -15˚С; - в холодильнике – от 2˚С до 8˚С; - в холодном или прохладном месте – от 8˚С до 15˚С; - при комнатной температуре – от 15˚С до 25˚С. Кроме терминов, приведенных выше, используются также следующие термины: - теплый – от 40˚С до 50˚С; - горячий – от 80˚С до 90˚С; - температура «водяной бани» – от 98˚С до 100˚С; - температура «ледяной бани» 0˚С. В «Общих сведениях» (ГФ РБ II, т. 1) приведены сокращения, используемые в общих и частных ФС ГФ РБ, таблицы единиц международной системы (СИ), используемые в ФС, и их соответствие другим единицам, правила отбора проб и приблизительная структура частных ФС. VII. Коэффициент набухания Коэффициент набухания – это объем в миллилитрах, занимаемый 1,0 г ЛРС, включая прилипшую слизь, после набухания в водном растворе в течение 4 ч. Этот показатель определяется для алтея корней, исландского мха слоевищ, льна семян. Методика определения коэффициента набухания описана в разделе 2.8.4 1 тома ГФ РБ II. В градуированный цилиндр с притертой пробкой вместимостью 25 мл и высотой 125±5 мм с делениями по 0,5 мл помещают 1,0 г образца ЛРС, цельного или измельченного, как указано в частной статье. Смачивают образец 1 мл спирта, если иного не указано в частной статье, добавляют 25 мл воды и закрывают цилиндр. Интенсивно встряхивают каждые 10 минут в течение часа. Затем оставляют стоять 3 ч. Через 1,5 ч после начала испытания сливают максимально возможное количество жидкости и любые частички сырья, плавающие на поверхности жидкости, путем вращения цилиндра вокруг вертикальной оси. Через 3 ч измеряют объем, занимаемый образцом вместе с прилипшей слизью. Параллельно проводят 3 испытания. Коэффициент набухания равняется среднему значению, вычисленному по результатам трех параллельных испытаний. Допускается использование другой градуированной посуды для проведения испытания, что указывается в частной статье.
IX. Стандартные образцы (для ознакомления) Термин «стандартный образец» включает стандартные вещества, стандартные ЛС и эталонные спектры. СО необходимы для проведения адекватного контроля качества субстанций для фармацевтического использования и ЛС. Необходимость использования СО предусматривается в ФС или НД по контролю качества. Если в частной или общей статье указан СО ЕФ (или другой подходящий СО), то только он принимается за официальный стандарт, т.е. единственно надежный в спорных случаях. Различают следующие виды СО: Первичный стандартный образец — это СО, обладающий подходящими свойствами для целенаправленного использования, проверка пригодности которого осуществляется без сравнения с существующим СО. Вторичный стандартный образец — это СО, утвержденный путем сравнения с первичным СО. Международный стандартный образец. Международный СО — это первичный СО, который определяет Международную Единицу. Эквивалентность международного СО в Международных Единицах устанавливается Всемирной Организацией Здравоохранения (ВОЗ). Стандартный образец Европейской Фармакопеи. СО, утвержденный и одобренный Европейской Фармакопейной Комиссией. Фармакопейный стандартный образец (ФСО) – это вещество или смесь веществ, предназначенные для использования как указано в частной или общей статье ГФ РБ. ФСО — это первичные стандартные образцы. Исключение составляют такие ФСО (особенно антибиотики), активность которых выражается в Международных Единицах, и которые, являясь вторичными СО, относятся к международным СО. Биологический стандартный препарат (БСП) - это вещество или смесь веществ, предназначенные для использования как указано в частной или общей статье ГФ РБ. БСП — это либо вторичные СО, активность которых выражается в Международных Единицах, либо первичные СО, которые могут использоваться для определения Европейской Фармакопейной Единицы. Могут использоваться и другие подходящие единицы измерения, например, вирусный титр или число бактерий. Специфичность фармакопейных стандартных образцов была официально признана во введении Руководства ИСО 34 — Общие требования к компетентности производителей стандартных материалов — (Второй выпуск 2000). Первичные СО используются для идентификации, в испытаниях на чистоту и количественном определении субстанций для фармацевтического использования и ЛС. СО используются также для определения содержания компонентов в ЛРС и ЛС на основе ЛРС. Это могут быть: непосредственно активные вещества, маркеры, используемые для количественного определения, или экстракты. Создание СО, представляющих собой экстракты, осуществляется с использованием образцов активных веществ или маркеров с известными характеристиками. Как правило, СО поставляются в соответствующих количествах для немедленного использования после вскрытия контейнера. За использование СО в других условиях ответственность несет аналитик. Если закрытый контейнер хранится в рекомендуемых условиях, он остается пригодным в течение срока годности данной серии. Например, информация о номерах серий стандартных образцов ЕФ имеется в каталоге Европейского управления по качеству лекарственных средств и здравоохранению при Совете Европы (European Directorate for the Quality of Medicines (Council of Europe)). Хранение растворов стандартных образцов не рекомендуется за исключением случаев, когда предварительно подтверждена их пригодность для использования. Вторичные СО могут быть использованы для рутинного контроля качества во всех случаях, описанных выше для первичных СО, при условии их утверждения по первичному стандартному образцу. Вторичные СО предназначены для сокращения использования первичных СО, требующих более тщательного описания и оценки и доступных в ограниченном количестве. Вторичные СО используется в тех же целях, что и первичные стандартные образцы, по которым они утверждены. Для подтверждения пригодности использования веществ или ЛС в качестве первичных СО используются различные аналитические методики. Для фармацевтических субстанций и их примесей обычно применяется значительная часть следующих программ испытаний: 1. Описание вещества (структурное описание) с помощью подходящих химических характеристик, таких как: структурная формула, эмпирическая формула и молекулярная масса. При этом могут быть использованы различные методы, включая: – спектрометрию ядерного магнитного резонанса; – масс-спектрометрию; – инфракрасную спектрометрию; – элементный анализ. 2. Определение чистоты: – определение содержания органических примесей подходящим методом разделения или спектрометрическим методом; – определение содержания воды; – определение содержания остаточных растворителей; – определение потери в массе при высушивании, которое может в некоторых случаях заменить определение воды и остаточных растворителей; – определение неорганических примесей (тяжелые металлы, сульфатная зола, атомная спектрометрия, спектрометрия индуктивно связанной плазмы, рентгеновская флуоресценция); результаты не используются при количественном определении устанавливаемого содержания основного компонента, за исключением значительного влияния на это содержание. Для использования первичных химических СО в количественном анализе устанавливаемое содержание основного компонента обычно рассчитывают исходя из значений, полученных при определении примесей (органические примеси, неорганические примеси, вода и остаточные растворители) используя принцип материального баланса; могут использоваться и другие пригодные методы. Если не указано иное, установленное содержание для субстанции или ЛС принимается таким, как указано на контейнере (‘as is’, «как есть»), и СО не требует высушивания перед использованием. Для стандартных образцов, использующихся при количественном определении и приготовленных путем лиофилизации, содержание чистой субстанции указывается в миллиграммах или в Международных Единицах на контейнер. Рамки испытаний СО, используемых в частных статьях на ЛС на основе ЛРС, варьируют в зависимости от типа этих стандартных образцов. Активные вещества или маркеры оцениваются по показателям подлинности и чистоты; значение количественного содержания устанавливается независимо от чистоты. Экстракт используется в качестве СО, если отсутствует достаточное количество соответствующего активного вещества или маркера. Вторичный СО должен проявлять те же значимые для испытания (испытаний) свойства, что и первичный СО. Вторичный СО утверждается путем сравнения с первичным СО. Производство, маркировка и хранение СО. Все производственные операции осуществляются в соответствии с существующими нормами надлежащей практики для того, чтобы гарантировать прослеживаемость и сохранность СО. Производственная документация включает информацию относительно упаковки, маркировки и хранения. Для обеспечения сохранности СО их помещают в контейнеры при соблюдении соответствующих условий наполнения и укупорки. Применяемые для этих целей контейнеры могут быть одноразового или многоразового использования, при этом для уменьшения риска разложения, контаминации или попадания воды, более предпочтительны одноразовые контейнеры. Маркировка включает название СО, название поставщика, номер серии, а также любую другую информацию, необходимую для правильного использования стандартного образца. Если СО используется для количественного определения, дополнительно указывают: – установленное процентное содержание; либо – концентрацию химического вещества в миллиграммах или миллилитрах на контейнер; либо – установленную активность (для биологического или микробиологического метода количественного определения) в единицах активности на миллиграмм или на контейнер. Маркировка СО содержит дату переконтроля или дату истечения срока годности. Для СО ЕФ дату переконтроля или дату истечения срока годности не приводят, так как в плане переконтроля (см. ниже) предусмотрен контроль непрерывной пригодности стандартных образцов для использования. Дополнительно может предоставляться сопроводительный пояснительный листок (вкладыш), содержащий информацию, необходимую для правильного использования СО. Пояснительный листок считается частью маркировки. Если это указано в частной статье, пояснительный листок содержит хроматограмму. СО должны храниться и распространяться в условиях, гарантирующих наилучшую стабильность. СО ЕФ, главным образом, хранятся в помещениях с контролируемым температурным режимом при температуре (5±3)°С. Однако, некоторые СО, являющиеся относительно нестабильными, хранятся при температуре (–20±5)°С; клеточные культуры — в жидком азоте (при температуре –180°С); или, в некоторых случаях (например, ЛС живых вирусов) — при температуре (–80±10)°С. Для минимизации риска повреждения при транспортировке используют специальную упаковку. СО, которые обычно хранятся при температуре (5±3)°С, отправляются обычной почтой, так как кратковременное отклонение от температурных условий долговременного хранения для таких образцов не опасно. СО, хранящиеся при температуре –20°С, упаковываются в контейнеры со льдом и отправляются экспресс-почтой. СО, хранящиеся при температуре –80°С или в жидком азоте, упаковываются в контейнеры с «сухим льдом» и отправляются экспресс-почтой. Для гарантирования непрерывной пригодности СО разработана и выполняется система переконтроля. Обычно в плане переконтроля учитывают известные физико-химические свойства и данные по стабильности СО. Периодичность и полнота переконтроля СО зависит от ряда следующих факторов: – стабильность; – контейнер и система укупоривания; – условия хранения; – гигроскопичность; – физическое состояние; – предполагаемое использование; – однократное или многократное использование. СО обычно представляют собой порошки, в некоторых случаях — растворы. Предпочтительно, чтобы СО были представлены в контейнере для однократного использования. Если СО представлены в контейнерах для многократного использования, переконтроль гигроскопичных или чувствительных к кислороду веществ может проводиться чаще. Методы испытаний включают определение воды и продуктов распада (если они известны). Период переконтроля может быть увеличен при наличии обоснованных данных. Максимально допустимое отклонение от установленного содержания должно быть заранее определено; в случае его превышения серию необходимо перепроверить или заменить. Программа мониторинга Европейского управления по качеству лекарственных средств и здравоохранению при Совете Европы (EDQM) включает набор следующих испытаний СО ЕФ, отличающихся быстротой, чувствительностью и применимостью для малых количеств: – определение воды, потеря в массе при высушивании и/или термогравиметрический анализ; – расчет содержания примесей с использованием методов разделения; – в некоторых случаях — определение молярной чистоты с помощью дифференциальной сканирующей калориметрии; – применение других специфических испытаний для определения примесей. Любые обнаруженные значимые различия, выявленные последним испытанием, ведут к более тщательному изучению серии и, в случае необходимости, к созданию новой серии.
Литература для подготовки к занятию
Государственная фармакопея Республики Беларусь. В 3 т. Т. 1 Общие методы контроля качества лекарственных средств / РУП «Центр экспертиз и испытаний в здравоохранении»; под ред. А. А. Шерякова. – Минск, 2007. – 656 с. Государственная фармакопея Республики Беларусь. В 3 т. Т. 2. Контроль качества вспомогательных веществ и лекарственного растительного сырья / УП «Центр экспертиз и испытаний в здравоохранении»; под ред. А.А. Шерякова. – Молодечно: Типография «Победа», 2008. – 472 с. Государственная фармакопея Республики Беларусь. В 3 т. Т.3. Контроль качества фармацевтических субстанций / УП «Центр экспертиз и испытаний в здравоохранении»; под ред. А.А. Шерякова. – Минск, 2009. Государственная фармакопея Республики Беларусь (ГФ РБ II). В 2 т. Т. 1 «Общие методы контроля лекарственных средств» / УП «Центр экспертиз и испытаний в здравоохранении»; под общ. ред. А. А. Шерякова. – Молодечно: Тип. «Победа», 2012. – 1220 с. Карпук В.В. Фармакогнозия: учеб. пособие / В.В. Карпук. – Минск: БГУ, 2011. – 340 с. – (Классическое университетское издание). Материалы лекций по фармакогнозии.
Работа на занятии
Объекты для лабораторного изучения: цельные шиповника плоды, измельченная дуба кора. ЗАДАНИЕ 1. Провести количественное определение аскорбиновой кислоты в шиповника плодах фармакопейным методом (титрование). Методика. Измельчить плоды (примерно 25 г) на кофемолке до размера частиц, проходящих сквозь сито 2000 мкм. 20,0 г измельченного сырья (2000) растереть в ступке с 5 г стеклянного порошка (осторожно: при растирании осколки стекла могут отскочить и поранить! Берегите глаза!), постепенно прибавить 300 мл воды Р, выдержать в течение 10 минут, перемешать и профильтровать в чистую и сухую стеклянную емкость через бумажный фильтр, отбросив первые 15 мл фильтрата. 1,0 мл (отмерить пипеткой) полученного раствора поместить в коническую колбу вместимостью 100 мл или 250 мл, прибавить 1 мл раствора 20 г/л хлористоводородной кислоты Р, 13 мл воды Р и титровать из микробюретки титрованным раствором дихлорфенолиндофенола Р до появления розовой окраски, не исчезающей в течение 30 - 60 секунд. Титрование проводить в течение не более 2 минут. В случае интенсивного окрашивания фильтрата или высокого содержания в нем аскорбиновой кислоты (расход титранта более 2 мл) исходное извлечение необходимо развести водой Р в два раза или более и повторить титрование. 1 мл титрованного раствора дихлорфенолиндофенола Р соответствует 0,0001 г аскорбиновой кислоты. Для расчета количественного содержания аскорбиновой кислоты в анализируемом образце, в процентах, в пересчете на сухое сырье, использовать формулу: X= V – объем титрованного раствора дихлорфенолиндофенола Р, израсходованный на титрование; T – титр соответствия, равный 0,0001 г/мл; m – масса навески сырья, г; W – потеря в массе при высушивании ЛРС, в %. Потерю в массе при высушивании принять равной 12,1%. Содержание аскорбиновой кислоты (C Примечание. Приготовление титрованного раствора дихлорфенолиндофенола Р. 50,0 мг дихлорфенолиндофенола натриевой соли P растворяют в 100,0 мл воды Р и фильтруют. Установка титра. 20,0 мг кислоты аскорбиновой P растворяют в 10 мл свежеприготовленного раствора 200 г/л кислоты метафосфорной Р и доводят объем раствора водой Р до 250,0 мл. 5,0 мл полученного раствора быстро титруют приготовленным раствором дихлорфенолиндолфенола из микробюретки с ценой деления 0,01 мл до розового окрашивания, не исчезающего в течение 10 секунд, время титрования должно быть не более 2 минут. Раствор дихлорфенолиндолфенола разводят водой Р до получения раствора, 1 мл которого соответствует 0,1 мг кислоты аскорбиновой (C Срок годности 3 суток. Титр устанавливают непосредственно перед использованием.
ЗАДАНИЕ 2. Провести количественное определение дубильных веществ в пересчете на танин в дуба коре методом титрования. Методика. 2,000 г измельченного сырья (2400) поместить в коническую колбу со шлифом вместимостью 500 мл, прибавить 250 мл кипящей воды Р и кипятить с обратным холодильником в течение 30 минут при периодическом перемешивании. Охладить до комнатной температуры, процедить и довести водой Р до объема 250,0 мл. 25,0 мл полученного извлечения поместить в коническую колбу вместимостью 750 мл, прибавить 500 мл воды Р, 25,0 мл раствора индигосульфокислоты (0,25 мг индигокармина Р растворить в 6,5 мл серной кислоты Р, прибавить 6,5 мл серной кислоты Р, довести водой Р до объема 250 мл и профильтровать). Титровать при постоянном перемешивании 0,02 М раствором калия перманганата до желтого окрашивания. Параллельно провести контрольный опыт. 1 мл 0,02 М раствора калия перманганата соответствует 0,004157 г дубильных веществ в пересчете на танин. Для расчета количественного содержания дубильных веществ в анализируемом сырье, в процентах, в пересчете на сухое сырье, использовать формулу: X= V – объем 0,02 М раствора калия перманганата, израсходованный на титрование; T – титр соответствия, равный 0,004157 г/мл; m – масса навески сырья, г; W – потеря в массе при высушивании ЛРС, в %. Содержание дубильных веществ в пересчете на танин в сухом сырье должно быть не менее 10%. Сделать заключение о качестве ЛРС.
Фармакогнозия Методические указания
Занятие №3. ФАРМАКОГНОСТИЧЕСКИЙ АНАЛИЗ ЛЕКАРСТВЕННОГО РАСТИТЕЛЬНОГО СЫРЬЯ. Химический анализ цельного лекарственного растительного сырья. Список условных сокращений БАВ – биологически активное вещество ВЭЖХ - высокоэффективная жидкостная хроматография ГХ – газовая хроматография ГФ РБ – Государственная Фармакопея Республики Беларусь, первое издание, в трех томах; ГФ РБ II – Государственная Фармакопея Республики Беларусь, второе издание, том 1 ЛР – лекарственное растение ЛРС – лекарственное растительное сырье ЛС – лекарственное средство МЗ РБ – Министерство здравоохранения Республики Беларусь НД – нормативный документ, нормативная документация РБ – Республика Беларусь СО – стандартный образец УФ – ультрафиолетовый ФС – фармакопейная статья Учебные цели
Подготовка к занятию 1. Общая характеристика БАВ-представителей витаминов, дубильных веществ. Классификация, физико-химические свойства, локализация, биохимическая роль в растениях, химическое строение и химические свойства. Методы выделения и анализа. 2. Ознакомиться с требованиями разделов и общих статей ГФ РБ: · «Общие сведения»; · «Реактивы», в т.ч. «Реактивы, титрованные растворы для объемного анализа»; · «Определение показателя горечи»; · «Определение содержания экстрактивных веществ»; · «Коэффициент набухания»; · «Определение содержания эфирного масла».
Содержание занятия
Теоретические основы темы I. Общие сведения ГФ РБ Для правильного и эффективного пользования ГФ РБ необходимо знать общие для всех ФС ГФ РБ правила и положения. Основные из них перечислены ниже. ● Положения статьи «Общие сведения» распространяются на все общие статьи, частные статьи и другие материалы ГФ РБ. ФС ГФ РБ можно разделить на общие и частные. Все общие ФС и монографии ГФ РБ гармонизированы с Европейской фармакопеей и построены в следующем формате: - адаптированный перевод соответствующего материала ЕФ; - национальные дополнительные испытания, информационные и иные материалы отмечены значком «#». Ссылка в материалах Фармакопеи на какую-либо статью и/или ее раздел означает, что продукт соответствует требованиям этой статьи. Название статьи, на которую дается ссылка, и/или ее номер обычно выделены курсивом. Требования частных статей ГФ РБ являются обязательными, если нет специальных указаний в статье «Общие сведения» или в НД производителя. Общие статьи становятся обязательными, когда на них приводится ссылка в той или иной монографии или общей статье, если только специально не указано, что ссылка приводится исключительно как информация или рекомендация. ● НД по контролю качества производителя ЛС (субстанции, ЛРС) может содержать не все тесты (испытания), приведенные в аналогичной частной статье ГФ. Для подтверждения соответствия ЛС требованиям ГФ РБ производитель при выпуске должен представить доказательства того, что ЛС соответствует фармакопейному качеству, исходя из результатов валидационных испытаний в сочетании с результатами контроля процесса производства данного ЛС. Такой подход, если компетентные уполномоченные органы (МЗ РБ и УП «Центр экспертиз и испытаний в здравоохранении») считают его обоснованным, не противоречит необходимости соответствия требованиям ГФ. Испытания и методики количественного определения, приведенные в ГФ РБ, являются официальными методиками, однако по согласованию с компетентными уполномоченными органами могут использоваться и другие методики, при условии, что они дают результаты, соответствующие фармакопейным методикам. В случае сомнений или разногласий решающей является фармакопейная методика. ● Общая фармакопейная статья на ту или иную лекарственную форму распространяется на все ЛС, изготовленные в виде этой ЛФ. Для конкретного ЛС требования соответствующей общей фармакопейной статьи не обязательно являются исчерпывающими и могут быть дополнены компетентным уполномоченным органом в частной статье производителя. ● Словосочетание «если нет других указаний в частной статье» (под частной статьей подразумевается частная статья ГФ РБ на субстанцию или аналитический нормативный документ производителя, утвержденный уполномоченным органом) означает,
|
||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 886; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.88.132 (0.012 с.) |

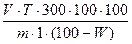 , где
, где H
H  O
O  ; М.м. 176,1) в пересчете на сухое сырье должно быть не менее 0,2%.
; М.м. 176,1) в пересчете на сухое сырье должно быть не менее 0,2%. , где
, где


