
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Метод биологической оценки на голубяхСодержание книги Поиск на нашем сайте
Отбор голубей и их содержание Для опытов отбирают беспородных здоровых голубей массой 280 - 400 г, находившихся в условиях лабораторного содержания в течение 5 - 7 суток. За 18 - 24 ч до начала опыта птиц лишают пищи, но не воды.
Техника испытания и принцип расчета. Опыт проводят под легким тиопентал - натриевым наркозом (35 мг/кг внутримышечно в лапку). Наркотизированных голубей привязывают к станку для мелких животных в положении на спине таким образом, чтобы голова голубя находилась ниже туловища (во избежание попадания в дыхательные пути слизи и рвотных масс). С внутренней стороны крыла удаляют перья, находят и отсепаровывают вену крыла. В вену вводят металлическую канюлю (затупленная инъекционная игла N 19-22), соединенную тонкой каучуковой трубкой с градуированной бюреткой вместимостью 5 мл, имеющей деления 0,05 мл. Бюретку предварительно наполняют раствором испытуемого ЛС, приготовленным на 0,9% растворе натрия хлорида. Испытуемый раствор вводят отдельными дозами по 0,3 мл через каждые 5 минут до наступления остановки сердца голубя. Остановку сердца определяют по характерному изменению положения головы и шеи голубя и контролируют последующим вскрытием грудной клетки. Длительность опыта должна составлять не менее 65 и не более 95 минут. Голуби, смерть которых наступает в другие сроки, в расчет не принимаются. В течение опыта голубю вводят не менее 13 и не более 19 доз (0,3 мл) испытуемого раствора. Испытание обычно проводят на 6 голубях. Результаты опытов могут быть использованы для расчета биологической активности лишь в том случае, если в одной и той же серии опытов расхождение между максимальными и минимальными числами введенных доз не превышает 4, а общее число доз не выходит за установленные пределы (13-19). В противном случае увеличивают количество подопытных голубей или повторяют опыт с новой концентрацией испытуемого раствора. Оценку активности испытуемых ЛС можно проводить двумя способами: 1) по сравнению со стандартным образцом; 2) в голубиных единицах действия. а) Оценка активности испытуемого ЛС по сравнению со стандартным образцом. В опыт берут не менее 12 голубей — по 6 голубей для стандартного образца и испытуемого ЛС. Данные, полученные при биологическом испытании стандартного образца, могут быть использованы для расчета и последующих опытов в течение 30 суток без повторного испытания. Из полученных в опыте со стандартным или испытуемым ЛС данных вычисляют величину смертельной дозы ЛС для каждого голубя в миллилитрах на 1 кг массы. б) Определение активности испытуемого ЛС в ГЕД. Для выражения активности испытуемого ЛС в голубиных единицах действия (ГЕД) расчет проводят для каждого голубя по формуле:
где К — разведение испытуемого ЛС; m - масса голубя в килограммах; а — доза разведенного ЛС в миллилитрах. Из данных, полученных в опытах, выводят среднее число ГЕД и вычисляют в процентах отклонение отдельных опытов от среднего числа. Сведения о требуемом содержании ЛЕД, КЕД и ГЕД в отдельных ЛС и растительном сырье, а также методики их определения приведены в соответствующих фармакопейных статьях.
● Химические методы. Длительность, трудоемкость, строго установленные условия биологических методов испытаний ЛРС и ЛС, содержащих сердечные гликозиды, побудили исследователей к поиску адекватных химических методов. В НД конкретно указывается, в каких случаях применяется биологическая стандартизация, и в каких –количественное определение сердечных гликозидов химическим путем. Так, например, в случае производства ЛС ланатозида в листьях наперстянки шерстистой определяют биологическую активность, а при получении ЛС целанида в сырье химическим методом определяют сумму дигиланидов (ланатозидов) А, В и С. Принцип химического метода заключается в следующем. Из навески сырья гликозиды экстрагируют 80% метанолом (1:10). Экстрагент отгоняют, вытяжку очищают путем встряхивания с тетрахлометаном; гликозиды переводят в смесь хлороформа с изопропиловым спиртом. Извлечение сгущают досуха, гликозиды растворяют в точном объеме смеси хлороформа и метанола, и полученный раствор хроматографируют на бумаге. Подвижная фаза: хлороформ – диоксан – н-бутанол, насыщенная формамидом. Вырезанные участки бумаги с пятнами гликозидов помещают в одинаковые объемы ксантгидролового реактива. Полученные растворы колориметрируют на ФЭК-М. По калибровочному графику находят концентрацию для каждого дигиланида (ланатозида) в миллиграммах в 1 мл раствора, после чего рассчитывают сумму дигиланидов, которых должно быть не менее 1%. IX. Стандартные образцы (для ознакомления) Термин «стандартный образец» включает стандартные вещества, стандартные ЛС и эталонные спектры. СО необходимы для проведения адекватного контроля качества субстанций для фармацевтического использования и ЛС. Необходимость использования СО предусматривается в ФС или НД по контролю качества. Если в частной или общей статье указан СО ЕФ (или другой подходящий СО), то только он принимается за официальный стандарт, т.е. единственно надежный в спорных случаях. Различают следующие виды СО: Первичный стандартный образец — это СО, обладающий подходящими свойствами для целенаправленного использования, проверка пригодности которого осуществляется без сравнения с существующим СО. Вторичный стандартный образец — это СО, утвержденный путем сравнения с первичным СО. Международный стандартный образец. Международный СО — это первичный СО, который определяет Международную Единицу. Эквивалентность международного СО в Международных Единицах устанавливается Всемирной Организацией Здравоохранения (ВОЗ). Стандартный образец Европейской Фармакопеи. СО, утвержденный и одобренный Европейской Фармакопейной Комиссией. Фармакопейный стандартный образец (ФСО) – это вещество или смесь веществ, предназначенные для использования как указано в частной или общей статье ГФ РБ. ФСО — это первичные стандартные образцы. Исключение составляют такие ФСО (особенно антибиотики), активность которых выражается в Международных Единицах, и которые, являясь вторичными СО, относятся к международным СО. Биологический стандартный препарат (БСП) - это вещество или смесь веществ, предназначенные для использования как указано в частной или общей статье ГФ РБ. БСП — это либо вторичные СО, активность которых выражается в Международных Единицах, либо первичные СО, которые могут использоваться для определения Европейской Фармакопейной Единицы. Могут использоваться и другие подходящие единицы измерения, например, вирусный титр или число бактерий. Специфичность фармакопейных стандартных образцов была официально признана во введении Руководства ИСО 34 — Общие требования к компетентности производителей стандартных материалов — (Второй выпуск 2000). Первичные СО используются для идентификации, в испытаниях на чистоту и количественном определении субстанций для фармацевтического использования и ЛС. СО используются также для определения содержания компонентов в ЛРС и ЛС на основе ЛРС. Это могут быть: непосредственно активные вещества, маркеры, используемые для количественного определения, или экстракты. Создание СО, представляющих собой экстракты, осуществляется с использованием образцов активных веществ или маркеров с известными характеристиками. Как правило, СО поставляются в соответствующих количествах для немедленного использования после вскрытия контейнера. За использование СО в других условиях ответственность несет аналитик. Если закрытый контейнер хранится в рекомендуемых условиях, он остается пригодным в течение срока годности данной серии. Например, информация о номерах серий стандартных образцов ЕФ имеется в каталоге Европейского управления по качеству лекарственных средств и здравоохранению при Совете Европы (European Directorate for the Quality of Medicines (Council of Europe)). Хранение растворов стандартных образцов не рекомендуется за исключением случаев, когда предварительно подтверждена их пригодность для использования. Вторичные СО могут быть использованы для рутинного контроля качества во всех случаях, описанных выше для первичных СО, при условии их утверждения по первичному стандартному образцу. Вторичные СО предназначены для сокращения использования первичных СО, требующих более тщательного описания и оценки и доступных в ограниченном количестве. Вторичные СО используется в тех же целях, что и первичные стандартные образцы, по которым они утверждены. Для подтверждения пригодности использования веществ или ЛС в качестве первичных СО используются различные аналитические методики. Для фармацевтических субстанций и их примесей обычно применяется значительная часть следующих программ испытаний: 1. Описание вещества (структурное описание) с помощью подходящих химических характеристик, таких как: структурная формула, эмпирическая формула и молекулярная масса. При этом могут быть использованы различные методы, включая: – спектрометрию ядерного магнитного резонанса; – масс-спектрометрию; – инфракрасную спектрометрию; – элементный анализ. 2. Определение чистоты: – определение содержания органических примесей подходящим методом разделения или спектрометрическим методом; – определение содержания воды; – определение содержания остаточных растворителей; – определение потери в массе при высушивании, которое может в некоторых случаях заменить определение воды и остаточных растворителей; – определение неорганических примесей (тяжелые металлы, сульфатная зола, атомная спектрометрия, спектрометрия индуктивно связанной плазмы, рентгеновская флуоресценция); результаты не используются при количественном определении устанавливаемого содержания основного компонента, за исключением значительного влияния на это содержание. Для использования первичных химических СО в количественном анализе устанавливаемое содержание основного компонента обычно рассчитывают исходя из значений, полученных при определении примесей (органические примеси, неорганические примеси, вода и остаточные растворители) используя принцип материального баланса; могут использоваться и другие пригодные методы. Если не указано иное, установленное содержание для субстанции или ЛС принимается таким, как указано на контейнере (‘as is’, «как есть»), и СО не требует высушивания перед использованием. Для стандартных образцов, использующихся при количественном определении и приготовленных путем лиофилизации, содержание чистой субстанции указывается в миллиграммах или в Международных Единицах на контейнер. Рамки испытаний СО, используемых в частных статьях на ЛС на основе ЛРС, варьируют в зависимости от типа этих стандартных образцов. Активные вещества или маркеры оцениваются по показателям подлинности и чистоты; значение количественного содержания устанавливается независимо от чистоты. Экстракт используется в качестве СО, если отсутствует достаточное количество соответствующего активного вещества или маркера. Вторичный СО должен проявлять те же значимые для испытания (испытаний) свойства, что и первичный СО. Вторичный СО утверждается путем сравнения с первичным СО. Производство, маркировка и хранение СО. Все производственные операции осуществляются в соответствии с существующими нормами надлежащей практики для того, чтобы гарантировать прослеживаемость и сохранность СО. Производственная документация включает информацию относительно упаковки, маркировки и хранения. Для обеспечения сохранности СО их помещают в контейнеры при соблюдении соответствующих условий наполнения и укупорки. Применяемые для этих целей контейнеры могут быть одноразового или многоразового использования, при этом для уменьшения риска разложения, контаминации или попадания воды, более предпочтительны одноразовые контейнеры. Маркировка включает название СО, название поставщика, номер серии, а также любую другую информацию, необходимую для правильного использования стандартного образца. Если СО используется для количественного определения, дополнительно указывают: – установленное процентное содержание; либо – концентрацию химического вещества в миллиграммах или миллилитрах на контейнер; либо – установленную активность (для биологического или микробиологического метода количественного определения) в единицах активности на миллиграмм или на контейнер. Маркировка СО содержит дату переконтроля или дату истечения срока годности. Для СО ЕФ дату переконтроля или дату истечения срока годности не приводят, так как в плане переконтроля (см. ниже) предусмотрен контроль непрерывной пригодности стандартных образцов для использования. Дополнительно может предоставляться сопроводительный пояснительный листок (вкладыш), содержащий информацию, необходимую для правильного использования СО. Пояснительный листок считается частью маркировки. Если это указано в частной статье, пояснительный листок содержит хроматограмму. СО должны храниться и распространяться в условиях, гарантирующих наилучшую стабильность. СО ЕФ, главным образом, хранятся в помещениях с контролируемым температурным режимом при температуре (5±3)°С. Однако, некоторые СО, являющиеся относительно нестабильными, хранятся при температуре (–20±5)°С; клеточные культуры — в жидком азоте (при температуре –180°С); или, в некоторых случаях (например, ЛС живых вирусов) — при температуре (–80±10)°С. Для минимизации риска повреждения при транспортировке используют специальную упаковку. СО, которые обычно хранятся при температуре (5±3)°С, отправляются обычной почтой, так как кратковременное отклонение от температурных условий долговременного хранения для таких образцов не опасно. СО, хранящиеся при температуре –20°С, упаковываются в контейнеры со льдом и отправляются экспресс-почтой. СО, хранящиеся при температуре –80°С или в жидком азоте, упаковываются в контейнеры с «сухим льдом» и отправляются экспресс-почтой. Для гарантирования непрерывной пригодности СО разработана и выполняется система переконтроля. Обычно в плане переконтроля учитывают известные физико-химические свойства и данные по стабильности СО. Периодичность и полнота переконтроля СО зависит от ряда следующих факторов: – стабильность; – контейнер и система укупоривания; – условия хранения; – гигроскопичность; – физическое состояние; – предполагаемое использование; – однократное или многократное использование. СО обычно представляют собой порошки, в некоторых случаях — растворы. Предпочтительно, чтобы СО были представлены в контейнере для однократного использования. Если СО представлены в контейнерах для многократного использования, переконтроль гигроскопичных или чувствительных к кислороду веществ может проводиться чаще. Методы испытаний включают определение воды и продуктов распада (если они известны). Период переконтроля может быть увеличен при наличии обоснованных данных. Максимально допустимое отклонение от установленного содержания должно быть заранее определено; в случае его превышения серию необходимо перепроверить или заменить. Программа мониторинга Европейского управления по качеству лекарственных средств и здравоохранению при Совете Европы (EDQM) включает набор следующих испытаний СО ЕФ, отличающихся быстротой, чувствительностью и применимостью для малых количеств: – определение воды, потеря в массе при высушивании и/или термогравиметрический анализ; – расчет содержания примесей с использованием методов разделения; – в некоторых случаях — определение молярной чистоты с помощью дифференциальной сканирующей калориметрии; – применение других специфических испытаний для определения примесей. Любые обнаруженные значимые различия, выявленные последним испытанием, ведут к более тщательному изучению серии и, в случае необходимости, к созданию новой серии.
Литература для подготовки к занятию
Государственная фармакопея Республики Беларусь. В 3 т. Т. 1 Общие методы контроля качества лекарственных средств / РУП «Центр экспертиз и испытаний в здравоохранении»; под ред. А. А. Шерякова. – Минск, 2007. – 656 с. Государственная фармакопея Республики Беларусь. В 3 т. Т. 2. Контроль качества вспомогательных веществ и лекарственного растительного сырья / УП «Центр экспертиз и испытаний в здравоохранении»; под ред. А.А. Шерякова. – Молодечно: Типография «Победа», 2008. – 472 с. Государственная фармакопея Республики Беларусь. В 3 т. Т.3. Контроль качества фармацевтических субстанций / УП «Центр экспертиз и испытаний в здравоохранении»; под ред. А.А. Шерякова. – Минск, 2009. Государственная фармакопея Республики Беларусь (ГФ РБ II). В 2 т. Т. 1 «Общие методы контроля лекарственных средств» / УП «Центр экспертиз и испытаний в здравоохранении»; под общ. ред. А. А. Шерякова. – Молодечно: Тип. «Победа», 2012. – 1220 с. Карпук В.В. Фармакогнозия: учеб. пособие / В.В. Карпук. – Минск: БГУ, 2011. – 340 с. – (Классическое университетское издание). Материалы лекций по фармакогнозии.
Работа на занятии
Объекты для лабораторного изучения: цельные шиповника плоды, измельченная дуба кора. ЗАДАНИЕ 1. Провести количественное определение аскорбиновой кислоты в шиповника плодах фармакопейным методом (титрование). Методика. Измельчить плоды (примерно 25 г) на кофемолке до размера частиц, проходящих сквозь сито 2000 мкм. 20,0 г измельченного сырья (2000) растереть в ступке с 5 г стеклянного порошка (осторожно: при растирании осколки стекла могут отскочить и поранить! Берегите глаза!), постепенно прибавить 300 мл воды Р, выдержать в течение 10 минут, перемешать и профильтровать в чистую и сухую стеклянную емкость через бумажный фильтр, отбросив первые 15 мл фильтрата. 1,0 мл (отмерить пипеткой) полученного раствора поместить в коническую колбу вместимостью 100 мл или 250 мл, прибавить 1 мл раствора 20 г/л хлористоводородной кислоты Р, 13 мл воды Р и титровать из микробюретки титрованным раствором дихлорфенолиндофенола Р до появления розовой окраски, не исчезающей в течение 30 - 60 секунд. Титрование проводить в течение не более 2 минут. В случае интенсивного окрашивания фильтрата или высокого содержания в нем аскорбиновой кислоты (расход титранта более 2 мл) исходное извлечение необходимо развести водой Р в два раза или более и повторить титрование. 1 мл титрованного раствора дихлорфенолиндофенола Р соответствует 0,0001 г аскорбиновой кислоты. Для расчета количественного содержания аскорбиновой кислоты в анализируемом образце, в процентах, в пересчете на сухое сырье, использовать формулу: X= V – объем титрованного раствора дихлорфенолиндофенола Р, израсходованный на титрование; T – титр соответствия, равный 0,0001 г/мл; m – масса навески сырья, г; W – потеря в массе при высушивании ЛРС, в %. Потерю в массе при высушивании принять равной 12,1%. Содержание аскорбиновой кислоты (C Примечание. Приготовление титрованного раствора дихлорфенолиндофенола Р. 50,0 мг дихлорфенолиндофенола натриевой соли P растворяют в 100,0 мл воды Р и фильтруют. Установка титра. 20,0 мг кислоты аскорбиновой P растворяют в 10 мл свежеприготовленного раствора 200 г/л кислоты метафосфорной Р и доводят объем раствора водой Р до 250,0 мл. 5,0 мл полученного раствора быстро титруют приготовленным раствором дихлорфенолиндолфенола из микробюретки с ценой деления 0,01 мл до розового окрашивания, не исчезающего в течение 10 секунд, время титрования должно быть не более 2 минут. Раствор дихлорфенолиндолфенола разводят водой Р до получения раствора, 1 мл которого соответствует 0,1 мг кислоты аскорбиновой (C Срок годности 3 суток. Титр устанавливают непосредственно перед использованием.
ЗАДАНИЕ 2. Провести количественное определение дубильных веществ в пересчете на танин в дуба коре методом титрования. Методика. 2,000 г измельченного сырья (2400) поместить в коническую колбу со шлифом вместимостью 500 мл, прибавить 250 мл кипящей воды Р и кипятить с обратным холодильником в течение 30 минут при периодическом перемешивании. Охладить до комнатной температуры, процедить и довести водой Р до объема 250,0 мл. 25,0 мл полученного извлечения поместить в коническую колбу вместимостью 750 мл, прибавить 500 мл воды Р, 25,0 мл раствора индигосульфокислоты (0,25 мг индигокармина Р растворить в 6,5 мл серной кислоты Р, прибавить 6,5 мл серной кислоты Р, довести водой Р до объема 250 мл и профильтровать). Титровать при постоянном перемешивании 0,02 М раствором калия перманганата до желтого окрашивания. Параллельно провести контрольный опыт. 1 мл 0,02 М раствора калия перманганата соответствует 0,004157 г дубильных веществ в пересчете на танин. Для расчета количественного содержания дубильных веществ в анализируемом сырье, в процентах, в пересчете на сухое сырье, использовать формулу: X= V – объем 0,02 М раствора калия перманганата, израсходованный на титрование; T – титр соответствия, равный 0,004157 г/мл; m – масса навески сырья, г; W – потеря в массе при высушивании ЛРС, в %. Содержание дубильных веществ в пересчете на танин в сухом сырье должно быть не менее 10%. Сделать заключение о качестве ЛРС.
|
||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 398; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.113.71 (0.012 с.) |

 ,
,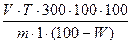 , где
, где H
H  O
O  ; М.м. 176,1) в пересчете на сухое сырье должно быть не менее 0,2%.
; М.м. 176,1) в пересчете на сухое сырье должно быть не менее 0,2%. , где
, где


