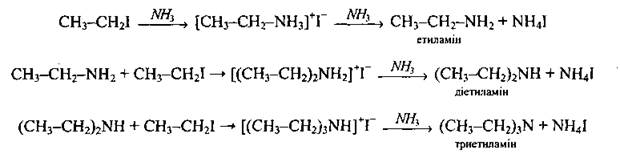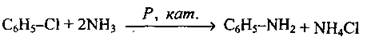Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Аліфатичні та ароматичні аміни. Одержання та властивості. Аміноспирти.Содержание книги
Поиск на нашем сайте Аміни — органічні сполуки, похідні аміаку, у молекулі якого один, два чи три атоми Гідрогену заміщені на вуглеводневі замісники: •Аліфатичні аміни — основи, сильніші за аміак, оскільки під впливом алкільних замісників навколо атома Нітрогену зростає електронна густина Зі збільшенням кількості алкільних замісників основні властивості зростають: первинні < вторинні < третинні. Аміни можна розглядати також як похідні вуглеводнів, що містять одну чи декілька функціональних груп -NH2. • Ароматичні аміни — це похідні ароматичних вуглеводнів, у яких атом (атоми) Гідрогену заміщені на аміногрупу. Ароматичні аміни можна розглядати також як похідні аміаку, у якому атоми Гідрогену (один, два або всі три) заміщені на ароматичні замісники. Ароматичні аміни — основи слабші, ніж аміак і аліфатичні аміни.
• Одержання аліфатичних амінів: 1.Відновлення нітроалканів: 2. Взаємодія галогеноалканів з аміаком:
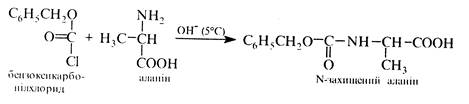
• Хім власт
• Одержання ароматичних амінів:
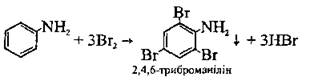
•Хім.власт: 1)Якісна реакція на анілін: 2)
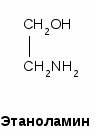
•Аміноспирти:
33. Поліпептиди і білки. Пептидний зв’язок. Прості та складні білки, їх загальна характеристика. Будова, властивості. Синтез пептидів і білків. •Поліпептид -високомолекулярна сполука, що представляє собою ланцюжок амінокислотних залишків, з’єднаних пептидним зв’язком; П. відрізняються від білків меншою молекулярною вагою •Білки - складні високомолекулярні природні органічні речовини, що складаються з амінокислот, сполучених пептидними зв'язками. Зазвичай білки є лінійними полімерами — поліпептидами, хоча інколи мають складнішу структуру. Невеликі білкові молекули, тобто олігомери поліпептидів, називаються пептидами
• Пептидний зв’язок. хімічний зв'язок, що виникає між двома молекулами внаслідок реакції конденсації між карбоксильною групою (-СООН) однієї і аміногрупою (-NH2) іншої, при цьому виділяється одна молекула води (H2O).
• Прості та складні білки, їх загальна характеристика. - Прості білки або протеїни — білки, які побудовані тільки із залишків α-амінокислот (при гідролізі розпадаються тільки на амінокислоти) та не вимагають для функціонування наявності небілкових простетичних груп. - Складні́ білки́ (протеїди) — складні речовини, які крім амінокислотних залишків містять вуглеводи, нуклеотиди тощо; білки,[1] в яких окрім пептидних ланцюгів (як у простих білків) міститься компонент неамінокислотної природи — простетична група. Складний білок без простетичної групи називається апопротеїном, повний активний білок із всіма необхідними простетичними групами — голопротеїном. При гідролізі складних білків, окрім вільних амінокислот, звільняється небілкова частина або продукти її розпаду.
• Будова, властивості:
В основі синтезу пептидів лежить процес утворення пептидного (амідного) зв'язку між карбоксильною групою одної α-амінокислоти та аміногрупою — іншої.
Нижче наведено схему синтезу дипептиду аланіл-гліцину.↓
Синтез білка – це багатоступінчастий ферментативний процес, який здійснюється в клітинах живих організмів і забезпечує постійне оновлення білків органів і тканин. Процес синтезу білка складається з чотирьох послідовних стадій, або етапів: •На другому етапі відбувається з’єднання амінокислот з молекулами т-РНК, які послідовно складаються з трьох нуклеотидів – антикодон, за допомогою яких визначається свій триплет-кодон. - •Третій етап – це процес безпосереднього синтезу поліпептидних зв’язків, званий трансляцією. Він відбувається в рибосомах. • На четвертому етапі відбувається утворення вторич ної та третинної структури білка, тобто формування остаточної структури білка.
|
||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 845; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.02 с.) |