
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Газообразное состояние веществСодержание книги Поиск на нашем сайте
Беспорядочно движущиеся в пространстве и относительно слабо взаимодействующие молекулы представляют собой газ. Газообразн состояние хар-ется сравнительно малыми силами межмолекулярного взаимодействия между молекулами, которые нах-ся на достаточно больших расстояниях друг от друга, вследствие чего газ занимает весь предоставленный ему объем. Газы, находящиеся при температурах, значительно превышающих их критическую температуру и при давлениях, ниже критических, являются очень разреженными. Если газ очень разрежен, расстояния между молекулами очень велики, молекулярные силы взаимодействия ничтожно малы и ими можно пренебречь. При этом объем молекул составляет ничтожно малую часть объема, занимаемого газом, и межмолекулярных соударений практически не происходит. Такое предельно разреженное состояние газа называется идеальным. Состояние идеального газа можно описать объединенным газовым законом: Жидкое состояние веществ В жидком состоянии расстояние между частицами значительно меньше, чем в газах, поэтому между ними возникают вандерваальсовы взаимодействия: дисперсионные, диполь-дипольные, индукционные. Эти взаимодействия удерживают молекулы друг около друга и приводят к некоторому их упорядочению или объединению частиц. Жидкое состояние характеризуется меньшим свободным пробегом молекул от одного межмолекулярного столкновения до другого, поэтому молекулы теряют способность перемещаться независимо и не удаляются значительно друг от друга. Жидкое вещество легко меняет свою форму, но незначительно изменяет объем. Если объем одного моль идеального газа при одинаковых условиях – величина постоянная, то для жидкостей объем различен и зависит от массы моль и плотности. Объем моль жидкости равен V = M/r, где М - молярная масса молекул жидкости, г/моль; r - плотность жидкости, г/см3. Жидкость в отличие от газов обладает значительно большей плотностью и силами притяжения между молекулами, а также почти постоянным объемом. Сжимаемость жидкости незначительна, что связано с наличием большого внутреннего давления. С ним связано значительное поглощение теплоты при испарении. Коэффициенты объемного расширения жидкостей значительно меньше, чем коэффициенты объемного расширения газов. Вещество находится в твердом состоянии, но структура его приближена к структуре жидкости. Такое состояние называется аморфным, например, стекло, некоторые смолы. Частицы в аморфном теле расположены беспорядочно, возможен лишь некоторый порядок в непосредственной близости от данной частицы. Однако в отличие от жидкостей, частицы в аморфных телах не обмениваются местами. Жидкости обладают поверхностью раздела, и, следовательно, поверхностной энергией. Из физических свойств жидкостей большое значение имеют поверхностное натяжение, вязкость и давление (упругость) насыщенного пара. Поверхностный слой жидкости обладает несколько иными свойствами, чем ее внутренний объем. Молекулы внутренних слоев равномерно окружены со всех сторон такими же молекулами, и силы их взаимного притяжения уравновешиваются. Молекулы поверхностного слоя оказываются под действием сил притяжения преимущественно со стороны жидкости, вследствие чего они как бы втягиваются во внутрь жидкости. Результирующая сила взаимодействия поверхностных молекул направлена в глубь жидкости и под действием этой силы жидкость стремится к сокращению площади поверхности при неизменном объеме. Этим объясняется сферическая форма капель. При любой температуре в замкнутом объеме над поверхностью жидкости устанавливается равновесие между скоростью испарения жидкости и скоростью конденсации пара в жидкость. Давление насыщенного пара зависит от температуры. Если давление насыщенного пара равно внешнему давлению и пар по мере испарения удаляется (давление не растет), то испарение протекает не только с поверхности, но и внутри жидкости, путем образования пузырьков пара во всем объеме. В этом случае происходит кипение и температура, при которой это происходит, называют температурой (точкой) кипения. Таким образом, если испарение с поверхности жидкости происходит при любой температуре, то кипение происходит только при определенной температуре, когда давление насыщенного пара становится равным внешнему давлению. Если уменьшать температуру, то давление насыщенного пара будет также уменьшаться. При температуре, когда давление пара над жидкостью станет равным давлению пара над поверхностью твердого тела, происходит замерзание жидкости и такую температуру называют температурой замерзания.
|
||||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 242; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.146.12 (0.008 с.) |

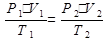 , где Р – давление; V – объем; Т – абсолютная температура. Для одного моль при нормальных условиях (н.у.) Р0 = 1,01325×105 Па; V0= 22,4 л/моль; Т = 273 К. Отсюда следует, что
, где Р – давление; V – объем; Т – абсолютная температура. Для одного моль при нормальных условиях (н.у.) Р0 = 1,01325×105 Па; V0= 22,4 л/моль; Т = 273 К. Отсюда следует, что  = 8,314 Дж/моль×К. Константу R называют универсальной газовой постоянной. В этом случае объединенный газовый закон будет иметь вид P×V = R×T. Для n молей газа оно становится таким: P×V = n×R×T. Данное уравнение носит название уравнения Менделеева-Клапейрона. У реальных газов наблюдаются отклонения значений Р и V от значений для идеальных газов, рассчитываемых по уравнениям газовых законов. Эти отклонения растут с увеличением давления и с понижением температуры. Если газ находится при условиях, отличных от идеальных, на его свойства начинают влиять межмолекулярные силы взаимодействия и объем, занимаемый самими молекулами. В этом случае свойства газов можно описать уравнением состояния реальных газов Ван-дер-Ваальса:
= 8,314 Дж/моль×К. Константу R называют универсальной газовой постоянной. В этом случае объединенный газовый закон будет иметь вид P×V = R×T. Для n молей газа оно становится таким: P×V = n×R×T. Данное уравнение носит название уравнения Менделеева-Клапейрона. У реальных газов наблюдаются отклонения значений Р и V от значений для идеальных газов, рассчитываемых по уравнениям газовых законов. Эти отклонения растут с увеличением давления и с понижением температуры. Если газ находится при условиях, отличных от идеальных, на его свойства начинают влиять межмолекулярные силы взаимодействия и объем, занимаемый самими молекулами. В этом случае свойства газов можно описать уравнением состояния реальных газов Ван-дер-Ваальса:  , где V – объем газа; a и b – постоянные Ван-дер-Ваальса. Постоянная а учитывает межмолекулярное взаимодействие, а постоянная b – объем молекул. Соответственно значение b растет с увеличением размера молекул, а значение a ‑ с увеличением энергии вандерваальсовского взаимодействия молекул. Поскольку уравнение является кубическим относительно V, то одному значению давления при некоторой температуре отвечают три значения объема – большее значение отвечает объему одного моль газа в момент начала конденсации, меньшее – объему одного моля жидкости в момент окончания конденсации газа, промежуточное значение не имеет определенного смысла. При понижении температуры ниже критического значения и при повышении давления газ начинает конденсироваться и под действием межмолекулярных сил между отдельными молекулами газ переходит в жидкое состояние. Процесс конденсации газов сопровождается значительным выделением энергии.
, где V – объем газа; a и b – постоянные Ван-дер-Ваальса. Постоянная а учитывает межмолекулярное взаимодействие, а постоянная b – объем молекул. Соответственно значение b растет с увеличением размера молекул, а значение a ‑ с увеличением энергии вандерваальсовского взаимодействия молекул. Поскольку уравнение является кубическим относительно V, то одному значению давления при некоторой температуре отвечают три значения объема – большее значение отвечает объему одного моль газа в момент начала конденсации, меньшее – объему одного моля жидкости в момент окончания конденсации газа, промежуточное значение не имеет определенного смысла. При понижении температуры ниже критического значения и при повышении давления газ начинает конденсироваться и под действием межмолекулярных сил между отдельными молекулами газ переходит в жидкое состояние. Процесс конденсации газов сопровождается значительным выделением энергии.


