Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 3. Система включение генаСодержание книги Поиск на нашем сайте
Однажды в июле 1958 г. Франсуа Жакоб сидел в парижском кинотеатре и изнывал от беспокойства. Его жена Лиз по опыту знала, что у мужа вот — вот родится какая‑то неожиданная идея. Они вышли из зрительного зала и направились домой. — Кажется, я только что придумал кое‑что важное, — сказал Франсуа жене. — Расскажи! — попросила она. В тот момент Жакобу, как он позже писал, казалось, что ему удалось добраться «до самой сути вещей». Он вдруг понял, как гены взаимодействуют между собой и как они делают жизнь возможной. Надо сказать, что Жакоб давно мечтал о подобном озарении. Хирург по образованию, он бежал из Парижа после прихода нацистов и следующие четыре года служил в медицинской роте союзников, участвовал в боях в Северной Африке. Ранение и контузия положили конец его планам стать хирургом, и после войны, вновь оказавшись в Париже, молодой человек просто не знал, как ему распорядиться своей жизнью. Он поступил на работу в лабораторию по разработке антибиотиков и неожиданно почувствовал интерес к научным исследованиям. Но Жакоб хотел не просто найти новое лекарство, он решил посвятить себя изучению «сути жизни». В 1950 г. Жакоб пришел на работу в Институт Пастера и присоединился к команде биологов, упорно работавших в мансарде института с E. coli и другими бактериями. Жакоб пришел в науку, не имея собственного плана исследований, но в конце концов он занялся двумя кусочками глобальной биологической головоломки: вопросом о том, почему гены иногда активны, а иногда нет. Несколько лет Жакоб изучал умеренных бактериофагов — вирусы, которые умеют «растворяться» в клетке хозяина — бактерии, а потом, спустя несколько поколений, появляться вновь. Вместе с Эли Вольман Жакоб продемонстрировал, что такие бактериофаги на самом деле встраивают свои гены в ДНК E. coli. Ученые позволяли инфицированным бактериофагами бактериям вступить в конъюгацию с неинфицированными, а затем их разделяли. Если конъюгация прекращалась слишком быстро, передачи профага[11]не происходило. Эксперименты показали, что профаг стабильно встраивается в одно и то же место хромосомы E. coli. Гены вируса уютно устраивались между генами клетки — хозяина и «молчали» в течение нескольких поколений. E. coli предоставила Жакобу еще одну возможность изучить гены, которые иногда работают, а иногда нет. Чтобы утилизировать определенный вид сахара, E. coli необходимо производить определенные ферменты. Так, чтобы расщеплять лактозу, бактерии необходим фермент бета — галактозидаза, способный разрезать молекулу лактозы на кусочки. Коллега Жакоба по Институту Пастера Жак Моно обнаружил, что, если давать E. coli глюкозу (а это гораздо более эффективный источник энергии для бактерии, чем лактоза), она производит бета — галактозидазу в очень малых количествах. Если добавить в питательную среду лактозу, производство фермента увеличится незначительно. Только после того, как глюкоза закончится, синтез бета — галактозидазы начнется всерьез. Никто в то время не мог вразумительно объяснить, как гены E. coli или ее профагов могут то включаться, то выключаться. Прежде многие ученые считали, что синтез белков в клетке идет постоянно и непрерывно. Чтобы объяснить реакцию E. coli на лактозу, они выдвинули предположение, что на самом деле бактерия вырабатывает бета — галактозидазу постоянно, но только при реальном контакте с лактозой фермент меняет форму и приходит в то состояние, которое позволяет ему ее расщеплять. Стремясь выяснить, что происходит на самом деле, Моно, Жакоб и их коллеги из Института Пастера начали серию экспериментов. Они выделили мутантные формы E. coli, которые по каким‑то причинам не могли утилизировать лактозу. К примеру, один из мутантов не расщеплял лактозу, хотя у него присутствовал нормальный ген, отвечающий за производство бета — галактозидазы. Ученые поняли, что E. coli использует для утилизации лактозы несколько генов. Один из них кодирует образование белка пермеазы, который встраивается в мембрану микроба, соединяется с молекулой лактозы и переносит ее внутрь клетки. Но самыми странными среди обнаруженных мутантных форм оказались бактерии, которые производили бета — галактозидазу и пермеазу непрерывно, вне зависимости от того, имелась ли в окружающей питательной среде лактоза. Стало ясно, что у E. coli есть еще какая‑то молекула, которая в обычных условиях не допускает активации генов, отвечающих за производство бета — галактозидазы и пермеазы. Этот белок ученые назвали репрессором. Но Жакоб и его коллеги ничего не могли сказать о том, каким образом репрессор подавляет работу генов. И вот в темном зале кинотеатра Жакоба осенило. Репрессор, решил он, — это белок, который связывается с ДНК E. coli и блокирует считывание соответствующих генов (в данном случае генов бета — галактозидазы и других, отвечающих за расщепление лактозы). По определенному сигналу, как по щелчку выключателя, репрессор прекращает блокировать гены. Возможно, подумал Жакоб, профаги тоже блокируются каким‑нибудь репрессором. Не исключено, что эта система универсальна и работает во всех живых организмах. «Я больше не чувствую себя посредственностью и даже смертным», — писал Жакоб. Но попытка рассказать в общих чертах о новых идеях жене принесла одно только разочарование. — Ты мне уже об этом рассказывал, — сказала Лиз. — Это же давно известно, разве не так? Идея Жакоба была настолько проста и элегантна, что любому человеку, не связанному с биологией, казалась самоочевидной. Тем не менее она представляла новый подход к проблеме жизни. Гены работают не по одному, а блоками. Следующие несколько недель Жакоб пытался обсудить свои новые идеи с коллегами — биологами, но особого интереса вызвать не сумел. Благодарный слушатель у него появился только осенью, когда в Париж вернулся Моно. Вдвоем они начали рисовать на доске блок — схемы генетического механизма, обозначать стрелками входы и выходы. Осенью 1958 г. Моно и Жакоб запустили новую серию экспериментов для проверки гипотезы Жакоба. Эксперименты дали ожидаемый результат. Но для подробного изучения работы генов, отвечающих за утилизацию лактозы, потребовались годы труда множества ученых. Оказалось, что эти гены располагаются на хромосоме E. coli общим кластером, один за другим. Белок — репрессор связывается со специальным участком ДНК в начале группы генов и блокирует работу ферментов, считывающих их. Когда репрессор связан с этим участком, E. coli не может использовать лактозу в качестве источника питания. Лучший способ удалить репрессор, блокирующий работу генов, отвечающих за расщепление лактозы, заключается в том, чтобы добавить ее в питательную среду, на которой растут колонии E. coli. Попав внутрь бактериальной клетки, молекулы лактозы взаимодействуют с закрепившимся на хромосоме белком — репрессором. Они изменяют его форму так, что он теряет сродство к соответствующему участку ДНК, открывая доступ ферментам РНК — полимеразам, считывающим гены, которые участвуют в метаболизме лактозы. В результате E. coli получает возможность синтезировать ферменты, необходимые для утилизации лактозы. Но E. coli нужен второй сигнал, чтобы запустить производство бета — галактозидазы на полную мощность: бактерии необходимо знать, что запасы глюкозы исчерпались. Таким сигналом служит комплекс двух молекул — циклического аденозинмонофосфата (цАМФ) и белка под названием САР. В бактериальной клетке происходит накопление цАМФ, когда сильно падает уровень глюкозы. САР связывается с цАМФ, и получившийся комплекс прикрепляется к ДНК перед генами, отвечающими за метаболизм лактозы. Этот комплекс изгибает ДНК и тем самым облегчает связывание с ней фермента РНК — полимеразы, осуществляющей считывание генов, — в результате начинается синтез РНК на матрице ДНК. Стоит комплексу цАМФ — САР связаться с ДНК, как производство ферментов, участвующих в метаболизме лактозы, разворачивается полным ходом. Получается, что репрессор выключает, а комплекс цАМФ — САР включает этот процесс. Жакоб с коллегами окрестили гены, отвечающие за расщепление лактозы, опероном lac. Оперон — это группа функционально связанных генов, которые регулируются одними и теми же факторами. Жакоб подозревал, что опероны олицетворяют общий принцип работы генов. Сотни генов E. coli объединены в опероны, каждым из которых управляют собственные переключатели. У некоторых оперонов переключателей несколько, и для запуска производства белков все они должны сработать. Иногда одного — единственного белка оказывается достаточно, чтобы запустить целый каскад реакций, включить гены, отвечающие за производство еще каких‑нибудь переключателей, и в конечном итоге позволить E. coli изготовить сотни новых типов белков. Вообще, включатели и выключатели встречаются в природе повсеместно. Профаги спят внутри бактерии благодаря репрессорам, которые не позволяют их генам активироваться. При воздействии стрессовых факторов репрессоры освобождают ДНК, и профаги начинают производство новых вирусов. Опероны можно обнаружить и в других бактериях. В клетках животных, таких как мы с вами, опероны, судя по всему, встречаются гораздо реже. Но даже гены, расположенные в нашем геноме не по соседству друг с другом, иногда включаются в результате действия одного и того же регуляторного белка. Только за счет включения и выключения генов наши клетки могут вести себя по — разному — ведь геном во всех клетках организма одинаковый. Этот механизм дает им возможность стать клетками печени или частью кости, обрести чувствительность к свету или теплу. Выяснив, как E. coli пьет молоко, Жакоб и его коллеги открыли путь к пониманию того, почему мы с вами люди, а не просто амебы.
Живые схемы
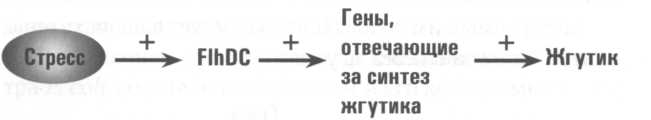
Для инженера схема — это совокупность проводов, резисторов и других электронных компонентов, организованных таким образом, чтобы получить из входного сигнала выходной. Счетчик Гейгера, зарегистрировав пролетающую через него радиоактивную частицу, производит щелчок. Нажатие на клавишу выключателя погружает комнату в темноту. Гены работают в соответствии с той же логикой. У генетической схемы тоже есть входы и выходы. Lac — оперон срабатывает лишь при получении на вход двух сигналов: сигнала о том, что у E. coli закончилась глюкоза, и сигнала о наличии лактозы. На выходе этой схемы — белки, необходимые E. coli для расщепления лактозы. У E. coli нет проводов, которые ученые могли бы разомкнуть, чтобы посмотреть, как работают ее схемы. Вместо этого им приходится ставить эксперименты вроде тех, что проводили Моно и Жакоб. Экспериментаторы наблюдают, как быстро микроорганизмы откликаются на изменение окружающей среды, с какой скоростью они способны произвести тот или иной белок или, наоборот, избавиться от него. Они объединяют результаты множества экспериментов в модели и с их помощью предсказывают, как поведет себя E. coli в следующем эксперименте. Фундаментальные открытия, сделанные Моно, Жакобом и их коллегами на E. coli, позволили другим ученым разобраться в схемах разных видов, в том числе и нашего. Но в течение всех 50 лет, что прошли с того памятного вечера в кинотеатре, исследователи продолжали всерьез изучать E. coli. Им удалось обнаружить в генетическом аппарате бактерии интереснейшие структуры, а позже составить его карту — самую подробную из всех обитающих на Земле видов живых существ; попутно выяснилось, что генетические схемы во многом напоминают схемы электронные, которые сегодня можно обнаружить в цифровых камерах или спутниковых радиоприемниках. Чтобы доказать, что это не пустое сравнение, я хочу разобрать работу всего лишь одной из множества схем E. coli. Эта схема управляет биосинтезом и сборкой жгутиков. Ученые потратили немало лет на то, чтобы выяснить, какие гены в нее входят. А в 2005 г. Ури Алон и его коллеги из Института Вейцмана определили наконец, что эта схема делает. Она работает как противопомеховый фильтр. Инженеры используют подобные фильтры для блокирования атмосферных помех в телефонных линиях, борьбы с размыванием изображений и другими внешними воздействиями, затрудняющими прием сигнала. В случае E. coli в роли помех выступает лишняя, несущественная информация об окружающей среде, а противопомеховый фильтр позволяет бактерии обращать внимание только на те факторы, которые имеют принципиальное значение. Для E. coli при сборке жгутика крайне важно отсекать помехи, потому что его сооружение во многом напоминает строительство собора. Бактерия должна включить около 50 генов, синтезирующих десятки тысяч белков, причем белки эти синтезируются и действуют в строго согласованном порядке. Сначала мотор встраивается в клеточную оболочку. Затем стержень с центральным каналом, работающий наподобие шприца, пройдя сквозь центр мотора, выталкивает наружу тысячи белковых молекул. Белки проходят через полую трубочку и появляются с другой стороны, наращивая жгутик. Весь процесс занимает один — два часа, что для E. coli может означать несколько поколений. При делении клетки новая бактерия наследует частично выстроенный жгутик и передает его, по — прежнему в незавершенном виде, своим потомкам. К моменту окончания синтеза жгутиков проблема, заставившая микроорганизм отращивать их, может разрешиться сама собой. Вся затраченная на эту работу энергия пропадает впустую. Поэтому E. coli внимательно следит за тем, что происходит вокруг, и как только дела начинают идти на лад, останавливает сборку жгутика. Единственная причина, из‑за которой эта стратегия способна привести к неудаче, заключается в том, что наступление лучших времен может обернуться мимолетным миражом. Если E. coli прекратит сборку жгутика при первом проблеске надежды — скажем, случайно проплывающей мимо молекулы кислорода, — она может застрять там, где ее жизни грозит опасность. Такие сигналы играют для E. coli роль помех, которые она должна отсекать. Чтобы объяснить, как E. coli отфильтровывает из сигнала помехи, я нарисую блок — схему соответствующей системы. Стрелка со знаком «плюс» означает, что данный сигнал или ген стимулирует активность другого гена. Знак «минус» означает, что ген подавлен. Первая стрелка на этой схеме ведет из внешнего мира внутрь клетки E. coli. Почувствовав, что условия окружающей среды стали неблагоприятными, бактерия в некоторых случаях производит в ответ белки FlhD и FlhC, которые формируют тетрамерный комплекс, состоящий из двух молекул FlhD и двух молекул FlhC.
Этот комплекс — один из главных переключателей E. coli. Он способен закрепляться в разных местах бактериальной хромосомы и включать разные гены, которые отвечают за производство многих белков, необходимых для синтеза жгутика.
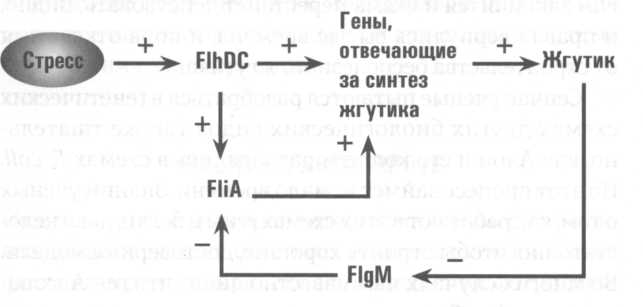
Именно здесь кроется основной недостаток механизма, отвечающего за синтез жгутика. В ответ на стрессовое воздействие этот механизм может включить соответствующие гены, но ему же придется их выключать, когда кризис завершится. Без воздействия стрессового фактора бактерия прекращает производить новые молекулы FlhD/FlhC. Старые молекулы постепенно исчезают, и контролируемые FlhD/FlhC гены теряют способность производить свои белки. В результате сложный процесс синтеза жгутика начинает давать сбои и вообще прекращается при малейшем, хотя и недолгом, улучшении ситуации. Когда же условия вновь ухудшатся, бактерии придется паскочегапивать свою жгутикостпоительную машину практически с нуля. Понятно, что в критических обстоятельствах любая задержка может оказаться фатальной. На самом деле E. coli не страдает и не гибнет от ложных сигналов тревоги, потому что в ее генетическом аппарате имеются дополнительные системы регуляции. При включении генов, отвечающих за синтез жгутика, комплекс FlhD/FlhC запускает резервный ген fliA.
Кодируемый им белок FliA тоже может включать гены, отвечающие за синтез жгутика.
Но fliA, помимо всего прочего, находится под контролем еще одного белка, получившего название FlgM. Этот белок захватывает молекулы белка FliA сразу же, как только E. coli их синтезирует, и не позволяет им включать гены синтеза жгутика. Вот как выглядит схема с участием FlgM:
Однако FlgM не способен долго подавлять работу fliA, потому что E. coli выбрасывает его наружу через ту же шприцеподобную структуру, через которую подается строительный материал для жгутика. По мере того как число молекул FlgM снижается, высвобождается все больше молекул белка FliA, которые начинают включать гены синтеза жгутика один за другим. Вот, наконец, полная схема противопомехового фильтра E. coli, составленная Алоном и его коллегами:
Этот элегантный генетический механизм делает E. coli царицей в лучшем из миров. В начале процесса синтеза жгутика бактерия сохраняет высочайшую чувствительность к любым признакам улучшения ситуации, потому что за работу соответствующих генов в этот момент отвечает только FlhD/FlhC. Но когда «шприц» построен и E. coli начинает выкачивать FlgM наружу, в дело вступает противопомеховый фильтр. Если теперь стрессовые факторы ослабевают, снижается и уровень FlhD/FlhC. Но к этому моменту E. coli уже успевает выработать достаточное количество свободных молекул белка FliA, чтобы удерживать гены синтеза жгутика в рабочем состоянии более часа. Затем, если улучшение ситуации окажется временным, E. coli возобновит производство FlhD/FlhC, и синтез жгутика продолжится без сбоев. E. coli способна отфильтровывать помехи и шум, но она отнюдь не глуха. Если обстановка значительно улучшится, бактерия прекратит синтез жгутика. Дело в том, что запаса FliA надолго не хватит. Молекулы белка одна за другой получают повреждения, и молекулярные мусорщики E. coli их уничтожают. Если стрессовое воздействие не возобновится в течение определенного времени, запасы белка FliA закончится и схема перестанет действовать. Видно, и правда вернулись сытые времена, и пора отказаться от строительства бесполезного жгутика. Сейчас ученые пытаются разобраться в генетических схемах других биологических видов так же тщательно, как Алон и его коллеги разобрались в схемах E. coli. Но этот процесс займет немало времени. Знаний ученых о том, как работают в этих схемах гены и белки, пока недостаточно, чтобы строить хорошие, достоверные модели. Во многих случаях нам известно лишь, что ген А включает гены В и С; мы не представляем, что заставляет его «щелкать выключателем» и что происходит после этого. Но Алон сумел извлечь замечательный урок даже из такого крохотного объема информации. Вместе с коллегами он тщательно исследовал гены E. coli и нескольких других хорошо изученных видов — дрожжей, уксусных нематод, плодовых мушек, мышей и человека. Соединение отдельных блоков этих схем стрелками происходит в соответствии с неким шаблоном намного чаще, чем можно было бы ожидать при их случайном формировании. Противопомеховый фильтр E. coli, к примеру, принадлежит к классу схем, которые инженеры называют схемами регулирования с прямой связью или схемами непосредственного регулирования. (Цепочка связей в противопомеховом фильтре идет от FlhDC к FliA и далее к генам синтеза жгутика.) Как показали Алон и его коллеги, схемы непосредственного или прямого регулирования необычайно популярны в живых системах. Кроме того, природа демонстрирует склонность к использованию еще нескольких типов схем, которые, судя по всему, также дают жизни возможность извлекать выгоду из таких инженерных решений, как противопомеховые фильтры. E. coli и слон, похоже, не просто построены на базе одного и того же генетического кода. Вдобавок, они скомпонованы с использованием одних и тех же стандартных схемотехнических приемов.
Жизнь на автопилоте
На землю опустились оранжевые зимние сумерки. За окном виднеется паутина голых кленовых ветвей. Поток фотонов струится через окно и попадает на фоторецепторы, выстилающие сетчатку моих глаз. Фоторецепторы вырабатывают электрические сигналы, которыми они сначала обмениваются между собой, а затем посылают по волокнам оптических нервов в затылочную часть мозга. Сигналы проходят сквозь мозг по сети из миллиардов нейронов, связанных между собой триллионами отростков. В мозгу формируется изображение. Я встаю из‑за стола, чтобы включить свет. В первый момент заоконный мир погружается для меня в темноту, но через мгновение мои глаза приспосабливаются к новым условиям. Я снова вижу раскачивающиеся деревья с голыми сучьями. Мне приходится напоминать себе, насколько это замечательно — то, что я по — прежнему их вижу. Мгновением раньше мое зрение было тончайшим образом настроено на восприятие мира в сумерках. Если бы после включения света в настройках моего зрения ничего не изменилось, я бы практически ослеп. К счастью, мои глаза и мозг умеют настраиваться и на полуденное солнце, и на слабый свет молодого месяца. Если свет усиливается, моя нервная система быстро сужает зрачки, чтобы в глаз проникало меньше света. Когда свет пропадает, мои зрачки расширяются, а нейроны сетчатки усиливают контраст между светлым и темным в поле моего зрения. Инженер назвал бы человеческое зрение робастным — устойчивым к изменению внешних условий. Иными словами, оно надежно работает в нашем нестабильном мире. Человеческое тело устойчиво во многих отношениях. Человеческий мозг нуждается в постоянной подпитке глюкозой, но мы не теряем сознания, если случайно пропустим обед. Чтобы сохранить нужную концентрацию сахара, тело прибегает к резервным запасам глюкозы. Из небольшого скопления клеток, непрерывно обменивающихся целыми водопадами сигналов, координирующих деление, развивается зародыш. На эти сигналы воздействуют разнообразные помехи, но все же из большинства зародышей получаются совершенно здоровые младенцы. Раз за разом жизнь умудряется избежать катастрофических неудач и не сбиться с курса. До недавнего времени у ученых не было достоверных свидетельств о том, почему жизнь обладает такой устойчивостью. Чтобы определить источник устойчивости, необходимо изучить живые системы на глубочайшем уровне подробнейшим образом, сжиться с ними — примерно так же, наверное, как конструктор сживается с создаваемой им системой автопилотирования, используя ее схему для проведения экспериментов. Однако принципиальные схемы живых существ по большей части по — прежнему остаются для нас тайной за семью печатями. E. coli — одно из немногих исключений. В борьбе за выживание E. coli постоянно сталкивается с серьезнейшими угрозами. Положите в солнечный день чашку Петри на подоконник, и вы поставите обитающих в ней бактерий на грань катастрофы. Жара оказывает на белки E. coli губительное действие. Чтобы работать правильно, каждому белку необходимо все время сохранять характерную только для него скрученную форму, по сложности напоминающую оригами. Перегретый белок разворачивается и становится похожим на спутанный клубок — он денатурируется. Такой белок уже не способен выполнять работу, от которой зависит выживание E. coli. И все же кишечная палочка не умирает от повышения температуры на несколько градусов. Когда температура поднимается, бактерия начинает синтезировать так называемые белки теплового шока. Они выполняют двойную защитную функцию. Некоторые обхватывают начавшие денатурироваться белки E. coli и возвращают им надлежащую форму. Остальные распознают белки, пострадавшие от жары настолько, что их уже невозможно привести в порядок, и разрезают на части, пригодные для строительства новых белков. Белки теплового шока вполне способны спасти хозяйке жизнь, но E. coli не в состоянии держать «под рукой» запас таких белков на случай будущих неприятностей. Надо сказать, что эти белки — одни из самых крупных в ее арсенале, а чтобы пережить тепловой удар, могут потребоваться десятки тысяч таких молекул. Производить их про запас — все равно что заставить двор своего дома пожарными машинами на случай, если дом вдруг загорится. С другой стороны, если пожарная машина нужна, то нужна она быстро. E. coli, затратив слишком много времени на производство белков теплового шока, может погибнуть, не дождавшись помощи. Эта особенность привлекла внимание инженера Калифорнийского технологического института Джона Дойла и его коллег. В прошлом Дойл занимался теорией создания систем управления для самолетов и космических кораблей многоразового использования. Однако оказалось, что в клетке E. coli скрыты конструкторские решения, ничуть не уступающие тем механизмам, в создании которых ему довелось принимать участие. Вместе с коллегами Дойл начал изучать белки теплового шока и то, как бактерия с их помощью выживает. Исследователи выяснили, что E. coli контролирует запас белков теплового шока с помощью механизма отрицательной обратной связи. С точки зрения инженера, обратная связь возникает тогда, когда выход какой‑то схемы начинает влиять на ее же вход. Так, термостат поддерживает температуру в доме примерно на одном уровне при помощи одной из простейших форм обратной связи. Термостат измеряет температуру в доме и, если она оказывается слишком низкой, включает обогреватель. Если температура слишком высокая, он выключает обогреватель. E. coli защищается от высокой температуры примерно так же. Ключевой белок ее «термостата» называется сигма-32, который регулирует, какие именно гены будет считывать РНК — полимераза. Даже при невысокой температуре бактерия постоянно считывает ген, отвечающий за синтез сигма-32, и синтезирует его РНК — копии. Но при нормальной температуре молекулы РНК сигма-32 находятся в свернутом состоянии, и E. coli не может использовать их для синтеза белка. Поэтому при нормальной температуре в бактериальной клетке много РНК сигма-32, но совсем нет соответствующего белка. Однако, когда температура окружающей среды повышается, РНК сигма-32 разворачивается. Теперь рибосомы могут прочитать эти молекулы и синтезировать по ним белок сигма-32, и E. coli за короткое время производит огромное количество этого белка. Молекулы сигма-32 быстро находят молекулы РНК — полимеразы и направляют их к генам, отвечающим за производство белков теплового шока. Таким образом, на синтез десятков тысяч молекул белка теплового шока уходит всего несколько минут. Столь стремительный ответ может спасти E. coli от перегрева, но в нем же скрыт и большой риск. Внезапный и бесконтрольный синтез белка сигма-32 опасен — даже хорошей вещи может быть слишком много. Ведь описанным способом бактерия наверняка произведет намного больше белков теплового шока, чем нужно. Но мы знаем, что этих молекул в клетке E. coli появляется ровно столько, сколько необходимо для данной температуры: больше, если температура высокая, и меньше, если не очень. Такое тонкое регулирование осуществляется при помощи целой системы петель обратных связей. Белки теплового шока не просто защищают E. coli от перегрева, но и контролируют количество сигма-32. Одни из них хватают молекулы сигма-32 и прячут «в карман»; другие режут их на части. Когда температура поднимается, в первые несколько мгновений белки теплового шока слишком заняты, чтобы нападать на сигма-32, — ведь необходимо помочь множеству других молекул, подвергшихся губительному воздействию высокой температуры. Но как только им удается взять ситуацию под контроль, свободные белки теплового шока (а их становится все больше) переносят свое внимание на сигма-32. А по мере снижения числа молекул сигма-32 падает и производство новых белков теплового шока. Этот механизм обратной связи не позволяет E. coli синтезировать слишком много белков теплового шока. Кроме того, она достаточно точно регулирует уровень этих белков. Если температура окружающей среды лишь слегка повысилась, но E. coli еще не умирает от жары, то белки теплового шока быстро снижают уровень сигма-32. Но если температура продолжает повышаться, то их внимание поглощено помощью развернувшимся молекулам и уровень сигма-32 — а значит, и производство белков теплового шока — остается высоким. Когда же окружающая среда остывает до комфортной температуры, «термостат» E. coli практически полностью прекращает производство белков теплового шока. Устойчивость системы саморегуляции E. coli объясняется наличием в ее управляющих схемах встроенной системы петель обратных связей. Для инженера такая конструкция совершенно естественна. Автопилот в «Боинге-777» использует примерно такие же обратные связи, чтобы удерживать самолет на нужной высоте при любых порывах ветра и нисходящих течениях. Устойчивость и бактерии, и самолета обеспечивает не всезнающее сознание, а сама управляющая схема.
Общая картина
Объедините гены в группы, и они смогут сделать намного больше, чем сделали бы по отдельности. Объедините группы в единую систему — и получите живой организм. В 1940–е гг. Эдвард Тейтем и другие ученые получили первые сведения о том, для чего предназначены некоторые гены E. coli. К 2007 г. исследователи имели более или менее полное представление о том, чем занимаются примерно 85 % ее генов, что превратило обычную кишечную палочку в золотой стандарт расшифрованности генома. Сегодня по генам E. coli, ее оперонам и метаболическим путям созданы и работают онлайновые базы данных. Загадки, конечно, остаются. Так, у E. coli обнаружен 41 фермент, для которых ученым еще только предстоит найти кодирующие их гены. Тем не менее постепенно вырисовывается примерный портрет E. coli. Пока это максимум того, что удалось сделать биологам в плане полной расшифровки устройства живого организма. Ученые под руководством Бернарда Палссона, профессора биоинженерии из Калифорнийского университета в Сан — Диего, попытались построить модель метаболизма клетки E. coli. По состоянию на 2007 г. они ввели в компьютер данные о 1260 генах и 2077 реакциях. На базе этой информации компьютер может вычислить, сколько углерода проходит по метаболическим путям E. coli в зависимости от характера поглощаемой ею пищи. Модель Палссона умеет делать то, что делают все хорошие модели, — предсказывать реальность. В частности, она очень неплохо предсказывает, как быстро E. coli будет расти на глюкозе и сколько углекислого газа она при этом выделит. Если Палссон условно отключит бактерии кислород, модель перенаправит углерод на другую, не связанную с кислородом метаболическую траекторию (точно так, как это делает E. coli). Если Палссон исключит из схемы один из белков, модель реорганизует свой метаболизм так же, как это делает реальная мутантная E. coli, у которой отсутствует этот белок. Модель надежно предсказывает поведение E. coli в тысячах самых разных ситуаций; она показывает, что E. coli действительно всегда выбирает наилучший путь и настраивает свой метаболизм так, чтобы размножаться как можно быстрее. Каким образом обмен веществ E. coli остается таким гибким, если в него входят сотни химических реакций? Почему бактерия, имея перед собой тысячи возможных метаболических путей, всегда выбирает несколько самых лучших? Почему вся эта система попросту не рушится? Оказывается, устойчивости системы способствует сама форма сети, география ее лабиринтов. Когда ученые изобразили на бумаге метаболический маршрут атома углерода в клетке E. coli, получилась фигура, напоминающая галстук — бабочку. Одно его «крыло» образуют химические реакции поступления в клетку и расщепления пищи. Они следуют одна за другой по простым маршрутам, которые можно изобразить веером стрелок, сходящихся в центре «галстука», на «узле». Здесь траектории становятся гораздо более сложными. Продукт, полученный в результате какой‑то реакции, может быть вовлечен во множество других реакций в зависимости от текущих условий. Именно на «узле» — там, где скрещиваются маршруты — E. coli создает строительные кирпичики для всех своих молекул. Затем эти кирпичики поступают в другое «крыло», образуя веер расходящихся траекторий, на каждой из которых производится свой тип молекул: на одной — молекула мембраны, на другой — кусочек РНК, на третьей — какой‑то белок. Расходящиеся траектории второго «крыла» никогда не пересекаются. Молекула, начавшая движение к тому, чтобы войти в белок, уже не станет частью молекулы ДНК. Надо сказать, что архитектурное решение в виде «бабочки» с инженерной точки зрения имеет для E. coli глубокий смысл. Рукотворные сети — например, телефонные или электрические — нередко тоже прокладывают по схеме «бабочки». Такая архитектура позволяет сетям работать эффективно и устойчиво. В Интернете, к примеру, входящий веер составляют сигналы всевозможных программ: браузеров, почтовых программ и многих других, причем каждая из них обрабатывает информацию по — своему. Чтобы все эти данные попали в Интернет, их следует преобразовать в коды, соответствующие интернет — протоколам. Потоки данных движутся от персональных компьютеров к серверам, а затем на небольшую группу роутеров, установленных в Лос — Анджелесе, Нью- Йорке и других крупных городах. Роутеры, подобно узлу галстука — бабочки E. coli, прочно связаны между собой. После этого сигналы через веер расходящихся маршрутов направляются к другому персональному компьютеру, где стандартный поток данных будет преобразован в картинку, текстовый документ или другую конкретную форму. И для работы Интернета, и для E. coli самое главное — центральный узел. Именно он позволяет той и другой сети работать даже при отказе каких‑то частей. Мутация, исключившая из арсенала бактерии одну из метаболических реакций, не убьет E. coli, потому что в «узле» есть и другие траектории, на которые она сможет перевести углерод. Интернет способен продолжать передачу данных даже после того, как откажет один из серверов, так же потому, что сообщения можно направить по другой траектории. Помимо всего прочего в обеих системах архитектура в виде «бабочки» помогает сберечь энергию. Если бы E. coli функционировала иначе, ей пришлось бы создавать особую цепочку ферментов для производства любой молекулы. Для каждого из этих ферментов потребовался бы собственный ген. Вместо этого у E. coli все входящие траектории сбрасывают свои продукты в одну и ту же сеть в центральном узле. Точно так же Интернету нет необходимости связывать компьютеры напрямую или использовать специальные коды для каждого типа файлов. В обоих случаях такая организация работы возможна только потому, что сеть подчиняется определенным правилам. В Интернете каждое сообщение обязательно переводится на общий язык. И в E. coli энергия всегда передается одним и тем же способом — с помощью АТФ. Изобретатели Интернета не думали, что создают подобную сеть. Они всего лишь пытались сбалансировать затраты и скорости при объединении серверов. Но, сами того не подозревая, они создали модель E. coli, которая к настоящему моменту охватила всю Землю.
Да здравствуют различия
У каждого из нас свои вкусы. Я, к примеру, не понимаю, почему некоторые любят улиток. Я не могу точно сказать, почему они мне не нравятся, но вполне могу выдвинуть несколько предположений. Может быть, у меня на языке есть особые клетки, в которых от вкуса улитки возникает спазм ужаса. А может, какая‑то нейронная сеть в моем мозгу связывает вкус улиток с каким‑то давним, но очень неприятным воспоминанием. Или, может быть, у меня просто не было возможности полюбить улиток, потому что я вырос на пицце, гамбургерах и арахисовом масле. Ясно одно: этот гастрономический путь для меня закрыт. Я не знаю наверняка, справедливо ли хоть одно из этих предположений. Я не могу совершить путешествие во времени, переиграть свою жизнь с момента зачатия и посмотреть, как бы оберн
|
||||
|
Последнее изменение этой страницы: 2016-08-10; просмотров: 387; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.136.236.17 (0.022 с.) |