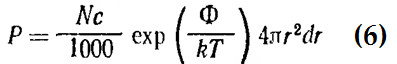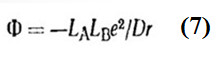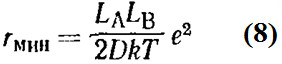Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общие закономерности ионной полимеризациииСтр 1 из 3Следующая ⇒
ДОКЛАД по учебной дисциплине: «Теоретические и экспериментальные методы в химии» на тему: «Энергетические и термодинамические параметры ионной полимеризации» Выполнил: магистрант 1 курса группы МП-11 Хавпачев М.А. Принял: д.х.н., проф., зав. каф. химической технологии пластических масс, Киреев В.В. Москва 2016 СОДЕРЖАНИЕ 1.Термодинамика полимеризации……………………………………………………3 2. ИОННАЯ ПОЛИМЕРИЗАЦИЯ………………..…………………………….…….5 2.1. Общие закономерности ионной полимеризациии………………………………5 2.2. КАТИОННАЯ ПОЛИМЕРИЗАЦИЯ………………………………………….….9 2.2.1. Инициирование, рост и обрыв цепи в катионной полимеризации………….10 2.2.2. Образование иона карбония…………………………………………………...15 2.2.3. Сродство к протону……………………………………………………….……16 2.2.4. Изменение свободной энергии при образовании иона карбония………...…18 2.2.5. Энергия сольватации…………………………………………………….……..19 2.2.6. Энергия реакции инициирования галогенсодержащими кислотами……….20 2.2.7. Теплота реакции катионов с олефинами……………………………………...22 2.3. АНИОННАЯ ПОЛИМЕРИЗАЦИЯ………………………………………..……24 2.3.1. Общие положения………………………………………………………...……24 2.3.2. Инициирование, рост и обрыв цепи в анионной полимеризации……….….25 2.3.3. Ионные пары и свободные ионы…………………………………………..….31 СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ………………………….………34 Термодинамика полимеризации Основным термодинамическим условием протекания реакции полимеризации, как и любого другого химического процесса, является убыль свободной энергии Гиббса или изобарно-изотермического потенциала:
где Δ G – изменение свободной энергии Гиббса или изобарно-изотермического потенциала; Δ H – изменение энтальпии системы, равное суммарному тепловому эффекту процесса с обратным знаком; Δ S – изменение энтропии системы. Если полимер имеет более низкую свободную энергию, чем соответствующий мономер, то полимеризация может протекать самопроизвольно, и ΔG отрицательно. Положительное ΔG означает, что полимеризация не может протекать самопроизвольно. Если система находится в равновесии при определенной критической температуре и полимеризация не происходит, что ΔG=0.
Три перечисленных выше случая изменения свободной энергии при полимеризации могут быть записаны в следующей форме:
Из уравнения (1), определяющего термодинамическую возможность протекания полимеризации, следует, что при повышении температуры может быть достигнуто равенство энтальпийного и энтропийного членов ΔН=ТΔS, ΔG станет равным нулю и процесс прекратится. Дальнейший рост температуры способствует повышению свободной энергии (ΔG>0) и вызывает обратный процесс образования мономера из полимера – деполимеризацию. Следовательно, процесс полимеризации является равновесным, а температура, при которой скорости прямого и обратного процессов сравняются, называется предельной – Тпр. Поскольку при равновесии ΔG=ΔH –TΔS=0, то предельная температура равна:
где ΔНр и ΔSр – изменение энтальпии и энтропии в расчете на мономерное звено Для больших степеней полимеризации эти величины называются энтальпией и энтропией полимеризации. Если за стандартное состояние принята единичная концентрация мономера и раствор является идеальным, то ΔS=ΔS
ΔS Из уравнения (4) следует, что Тпр характеристической величиной для равновесия мономер-полимер, не зависящей от природы активных центров в системе. Для данного значения концентрации мономера предельная температура будет одинаковой для активных центров радикального и ионного типа. Многие полимеры вполне стабильны выше их предельной температуры, так как образование активных центров при деструкции полимерных молекул затруднено. Подобное состояние является метастабильным равновесием. Таким образом, полимер не может деполимеризоваться самопроизвольно, но будет разлагаться при определенных условиях. Остатки катализатора, не удаленные в процессе очистки полимера, также могут вызывать деполимеризацию. Можно выделить четыре области условий протекания полимеризации: 1. Если ΔН и ΔS отрицательны, то ΔG становится положительной величиной выше Тпр системы, и высокомолекулярный полимер не может быть получен выше Тпр.
2. Если полимеризация эндотермична (ΔН>0) и ΔS больше нуля, то полимер не может существовать ниже предельной температуры, выше которой ΔG становится отрицательной. 3. Если ΔН – положительная величина, а ΔS – отрицательная, ΔG всегда положительно, поэтому полимер не может существовать ни при какой температуре. 4. Если ΔН – отрицательная величина, а ΔS – положительная, то ΔG всегда отрицательно, поэтому полимер может существовать при любой температуре. ИОННАЯ ПОЛИМЕРИЗАЦИЯ КАТИОННАЯ ПОЛИМЕРИЗАЦИЯ Катионной (электрофильной) полимеризацией называют процесс образования макромолекул, в котором активные растущие цепи несут положительный заряд. Для ненасыщенных мономеров с двойной связью С=С главным критерием способности к катионной полимеризации является нуклеофильность двойной связи. Поэтому заместители, увеличивающие электронную плотность на этой связи, повышают ее склонность к катионной полимеризации:
Если обозначить катализатор (кислоту) Н+А-, а мономер М, то отдельные стадии полимеризации можно представить следующим образом:
Основные характеристики катионной полимеризации: 1. Общая энергия активации при катионной полимеризации обычно находится в пределах -42 – 63 кДж/моль (-10 – 15 ккал/моль). При отрицательном значении энергии активации скорость полимеризации уменьшается при повышении температуры. Энергия активации инициирования составляет 21 – 29 кДж/моль (5 – 7) ккал/моль и очень низка по сравнению с энергией активации радикальной полимеризации 84-126 кДж/моль (20 – 30 ккал/моль). Разрыв ковалентной связи в инициаторе связан с большими затратами энергии, в то время, как ионный инициатор поляризован, и реакция инициирования в катионной полимеризации не требует такой высокой энергии. Поэтому катионная полимеризация протекает с высокой скоростью, часто почти мгновенно при низких температурах, когда рост цепи превалирует над обрывом и передачей цепи. 2. Диэлектрическая проницаемость и сольватация среды играют важную роль для конкретного ионного процесса. Среда с низкой диэлектрической проницаемостью и слабой сольватирующей способностью благоприятствует образованию ковалентных связей. Среда с высокой диэлектрической проницаемостью и большой сольватирующей способностью способствует образованию разделенных ионных пар. Образование иона карбония Ионизационный потенциал (энергия ионизации) I определяют как энергию, необходимую для удаления электрона из молекулы или атома в газовой фазе:
Потенциалы ионизации алкильных радикалов приведены в таблице 2. Таблица 2. Ионизационные потенциалы алкильных радикалов
Сравнение ионизации метильного и этильного радикалов показано на рис. 2.
Рисунок 2. Сравнение потенциалов ионизации для метильного и этильного радикалов. Энергия стабилизации иона карбония ΔС+ и радикала ΔС. Стабилизация карбониевого иона метильной группой составляет 147 кДж/моль (35 ккал/моль), в то время, как стабилизация радикала метильной группой составляет 33,6 кДж/моль (8 ккал/моль). Сродство к протону Важно оценить основность различных олефинов в смысле сродства к протону и иону карбония в соответствии с уравнениями:
Сродство олефинов к протону определяется следующими четырьмя стадиями:
Здесь i – сродство протона к электрону – определяется как величина, обратная потенциалу ионизации атома водорода; β – энергия раскрытия двойной связи; D – энергия связи С – Н; I – потенциал ионизации радикала, образующегося при присоединении атома водорода к олефину. Для любого несимметричного олефина сродство к протону будет зависеть от того, к какому атому углерода он присоединяется. Данные для этилена, пропилена и изобутилена приведены в таблице 3. Таблица 3. Сродство протона и атома (ккал/моль) к олефинам
Сродство к иону карбония (С1 и С2 соответственно, как и Р1 и Р2) изменяется также как и сродство к протону Р1 (и соответственно С1) и значительно возрастает от этилена к изобутилену. Этим объясняется то обстоятельство, что реакционноспособность возрастает от этилена, который не активен к катионным катализаторам, к изобутилену, который обладает высокой активностью. Как видно из таблицы 3. уменьшение потенциала ионизации радикала вызывает увеличение сродства к протону. На рис 3. показано, что потенциалы ионизации радикала и мономера связаны линейной зависимостью.
2.2.4. Изменение свободной энергии при образовании иона карбония Стабильность иона должна быть связана с изменением свободной энергии при его образовании. Таблица 4. Энтальпии ионизации в газовой фазе R – Br → R+ + Br – (энергии гетеролитической диссоциации связей)
Однако, для образования карбониевых ионов из алкилгалогенидов в газовой фазе известны только значения энтальпии, которая определяется по данным измерения электронного удара и, следовательно, является производной энергии гетеролитической диссоциации. Поскольку соответствующие изменения энтропии невелики, в принципе возможно оценить изменение свободной энергии через изменение энтальпии (таблица 4.) Энергию, необходимую для диссоциации алкилгалогенида RX на ионы R+ и X-, можно представить как сумму изменения энергии в трех гипотетических стадиях:
Величина ΔН1 представляет собой энергию гомолитической диссоциации связи; ΔН2-ионизационный потенциал алкильного радикала; ΔН3-сродство к электрону атома Х (не зависящее от природы алкила). Ионизационные потенциалы алкильных радикалов и ΔН при образовании карбониевых ионов алкилгалогенидов даны в таблице 4. Эти данные относятся к полностью разделенным ионам в газовой фазе. Как видно из таблицы 4, энергия диссоциации алкильных соединений и ионизационные потенциалы неожиданно зависят от природы R. Образование газообразных карбониевых ионов путем гетеролиза нейтральных молекул требует больших затрат энергии и поэтому редко наблюдается экспериментально.
Органические реакции, включающие образование иона карбония в растворе, гораздо более распространены. Энергия сольватации Реакции карбониевого иона в растворе обязательно включают сольватацию ионов. Взаимодействие с растворителем стабилизирует карбониевый ион и его противоион. Так как стабилизация, прежде всего, связана с присутствием электрических зарядов, то ионизированные формы будут лучше сольватироваться, чем неионизированные. Все растворители способствуют некоторой сольватации (по сравнению с газовой фазой). Схема ионизации органической молекулы RX в газовой фазе и в растворе представлена на рис 4., на котором
Вполне очевидно, что ΔG0 – стандартное изменение свободной энергии образования ионов в растворе из газообразного алкилгалогенида – должно выражаться суммой ΔG0р + ΔG0г. Из рисунка 4. следует:
Свободную энергию сольватации иона обычно рассчитывают по эмпирическому уравнению, часто называемому уравнением Борна. Изменение свободной энергии при перемещении иона с радиусом r и зарядом e из газовой фазы в растворитель (D) равно:
Согласно уравнению (11), энергия сольватации иона будет больше в растворителях с высокой диэлектрической проницаемостью. Важное значение имеет также специфическая сольватация и поляризуемость. По-видимому, ионы маленького радиуса должны лучше сольватироваться, и это действительно справедливо для неорганических катионов. Отсюда следует, что наиболее сильное взаимодействие между ионом и растворителем будет иметь место при малом радиусе иона и большом значении диэлектрической проницаемости среды. АНИОННАЯ ПОЛИМЕРИЗАЦИЯ Общие положения Анионная полимеризация – процесс образования макромолекул с участием отрицательно заряженного концевого атома растущей цепи. Для того, чтобы анионная полимеризация началась, мономер должен удовлетворять определенным критериям: 1) он должен образовывать достаточно стабильный анион; 2) этот анион должен быть способен к росту цепи; 3) мономер не должен содержать реакционноспособных групп, которые могли бы взаимодействовать с анионом; 4) анион не должен изомеризоваться в стабильную форму. Анионная полимеризация винилхлорида, винилацетата невозможна, так как их полярные группы взаимодействуют с анионными инициаторами. Только сопряженные мономеры способны к анионной полимеризации. Примерами подобных мономеров являются следующие классы соединений (в порядке уменьшения их реакционной способности): тиолы, диены > акриловые эфиры > циклические окиси > изоцианаты > нитроалкены.
Рост цепи Скорость полимеризации живых полимеризационных систем описывается уравнением:
где [М] – концентрация мономера; [P0*] – концентрация живых анионных растущих цепей. Значение kр в анионной полимеризации стирола больше, чем в радикальной всего в 25-30 раз, хотя оно может быть больше еще на порядок при использовании сильно полярных растворителей. Большое различие в скоростях анионной и радикальной полимеризации, наблюдаемое в большинстве случаев, обусловлено тем, что при анионной полимеризации концентрация растущих частиц значительно выше. Концентрация растущих радикалов в обычной радикальной полимеризации 10-8 – 10-7 молей, в то время как растущих анионов 10-3 – 10-2 молей. Вследствие этого различия, т.е. более высокой концентрации активных центров, скорость анионной полимеризации в 104 – 107 раз выше, чем скорость радикальной полимеризации. СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ 1. Савада Х., Темодинамика полимеризации, перевод с англ. – М.: Химия, 1979. – стр. 44 – 83. 2. Киреев В.В., Высокомолекулярные соединения. – М.: Юрайт, 2013. – стр. 238 – 270 ДОКЛАД по учебной дисциплине: «Теоретические и экспериментальные методы в химии» на тему: «Энергетические и термодинамические параметры ионной полимеризации» Выполнил: магистрант 1 курса группы МП-11 Хавпачев М.А. Принял: д.х.н., проф., зав. каф. химической технологии пластических масс, Киреев В.В. Москва 2016 СОДЕРЖАНИЕ 1.Термодинамика полимеризации……………………………………………………3 2. ИОННАЯ ПОЛИМЕРИЗАЦИЯ………………..…………………………….…….5 2.1. Общие закономерности ионной полимеризациии………………………………5 2.2. КАТИОННАЯ ПОЛИМЕРИЗАЦИЯ………………………………………….….9 2.2.1. Инициирование, рост и обрыв цепи в катионной полимеризации………….10 2.2.2. Образование иона карбония…………………………………………………...15 2.2.3. Сродство к протону……………………………………………………….……16 2.2.4. Изменение свободной энергии при образовании иона карбония………...…18 2.2.5. Энергия сольватации…………………………………………………….……..19 2.2.6. Энергия реакции инициирования галогенсодержащими кислотами……….20 2.2.7. Теплота реакции катионов с олефинами……………………………………...22 2.3. АНИОННАЯ ПОЛИМЕРИЗАЦИЯ………………………………………..……24 2.3.1. Общие положения………………………………………………………...……24 2.3.2. Инициирование, рост и обрыв цепи в анионной полимеризации……….….25 2.3.3. Ионные пары и свободные ионы…………………………………………..….31 СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ………………………….………34 Термодинамика полимеризации Основным термодинамическим условием протекания реакции полимеризации, как и любого другого химического процесса, является убыль свободной энергии Гиббса или изобарно-изотермического потенциала:
где Δ G – изменение свободной энергии Гиббса или изобарно-изотермического потенциала; Δ H – изменение энтальпии системы, равное суммарному тепловому эффекту процесса с обратным знаком; Δ S – изменение энтропии системы. Если полимер имеет более низкую свободную энергию, чем соответствующий мономер, то полимеризация может протекать самопроизвольно, и ΔG отрицательно. Положительное ΔG означает, что полимеризация не может протекать самопроизвольно. Если система находится в равновесии при определенной критической температуре и полимеризация не происходит, что ΔG=0. Три перечисленных выше случая изменения свободной энергии при полимеризации могут быть записаны в следующей форме:
Из уравнения (1), определяющего термодинамическую возможность протекания полимеризации, следует, что при повышении температуры может быть достигнуто равенство энтальпийного и энтропийного членов ΔН=ТΔS, ΔG станет равным нулю и процесс прекратится. Дальнейший рост температуры способствует повышению свободной энергии (ΔG>0) и вызывает обратный процесс образования мономера из полимера – деполимеризацию. Следовательно, процесс полимеризации является равновесным, а температура, при которой скорости прямого и обратного процессов сравняются, называется предельной – Тпр. Поскольку при равновесии ΔG=ΔH –TΔS=0, то предельная температура равна:
где ΔНр и ΔSр – изменение энтальпии и энтропии в расчете на мономерное звено Для больших степеней полимеризации эти величины называются энтальпией и энтропией полимеризации. Если за стандартное состояние принята единичная концентрация мономера и раствор является идеальным, то ΔS=ΔS
ΔS Из уравнения (4) следует, что Тпр характеристической величиной для равновесия мономер-полимер, не зависящей от природы активных центров в системе. Для данного значения концентрации мономера предельная температура будет одинаковой для активных центров радикального и ионного типа. Многие полимеры вполне стабильны выше их предельной температуры, так как образование активных центров при деструкции полимерных молекул затруднено. Подобное состояние является метастабильным равновесием. Таким образом, полимер не может деполимеризоваться самопроизвольно, но будет разлагаться при определенных условиях. Остатки катализатора, не удаленные в процессе очистки полимера, также могут вызывать деполимеризацию. Можно выделить четыре области условий протекания полимеризации: 1. Если ΔН и ΔS отрицательны, то ΔG становится положительной величиной выше Тпр системы, и высокомолекулярный полимер не может быть получен выше Тпр. 2. Если полимеризация эндотермична (ΔН>0) и ΔS больше нуля, то полимер не может существовать ниже предельной температуры, выше которой ΔG становится отрицательной. 3. Если ΔН – положительная величина, а ΔS – отрицательная, ΔG всегда положительно, поэтому полимер не может существовать ни при какой температуре. 4. Если ΔН – отрицательная величина, а ΔS – положительная, то ΔG всегда отрицательно, поэтому полимер может существовать при любой температуре. ИОННАЯ ПОЛИМЕРИЗАЦИЯ Общие закономерности ионной полимеризациии В отличие от гомолитической радикальной полимеризации общей чертой ионных процессов полимеризации является гетеролитический характер актов превращения молекул мономера в составные повторяющиеся звенья полимерных молекул. Можно отметить следующие основные отличия ионной полимеризации от радикальной. 1. Скорость ионной полимеризации и строение образующихся макромолекул зависят от природы реакционной среды — ее полярности и сольватирующей способности. Для одной и той же системы «мономер — ионный инициатор» в разных растворителях могут наблюдаться различные кинетические закономерности. В случае радикальной полимеризации природа растворителя не влияет на характер кинетических уравнений и может сказываться только на молекулярной массе вследствие возможного участия растворителя в реакциях передачи или обрыва цепи. 2. Существенное влияние природы ионного инициатора на закономерности полимерообразования и практически отсутствие такового для свободнорадикального инициирования. В радикальных процессах специфика инициатора проявляется почти исключительно в его относительной стабильности как источника свободных радикалов и мало зависит от особенностей последних, когда они образовались. Действительно, как указано выше, константа скорости разложения инициатора 3. Специфика механизма и роль реакций кинетического обрыва цепи. При гомогенной радикальной полимеризации обрыв цепи — это бимолекулярное взаимодействие растущих цепей. Вместе с медленной стадией инициирования оно определяет квазистационарный характер процесса до глубоких степеней превращения благодаря практически постоянной концентрации активных центров. В ионной полимеризации реакции обрыва, как правило, являются мономолекулярными, а могут и вообще отсутствовать (безобрывная полимеризация с «живущими» цепями). Поэтому стационарное состояние в ионной полимеризации или совсем не достигается, или имеет особую природу; постоянная концентрация активных центров в ионной полимеризации достигается только в случае высокой скорости инициирования и отсутствия реакций обрыва. 4. Возможность более тонкого регулирования при ионной полимеризации размеров и структуры макромолекул: с использованием ионных инициаторов удается синтезировать полимеры с заданной молекулярной массой и сравнительно узким молекулярно-массовым распределением, а также стереорегулярные полимеры, которые при радикальной полимеризации вообще не образуются. В зависимости от природы реагирующих веществ и реакционной среды ионные процессы полимеризации соответствуют различным кинетическим схемам, справедливым лишь для строго определенных условий. Активные центры ионной полимеризации можно представить общей формулой R – X, где R — атом, группа атомов или полимерная цепь с частичным или полным зарядом любого знака; X — фрагмент инициатора или растущей цепи с частичным или полным зарядом противоположного знака. Ионный инициатор R – X в реакционной среде может находиться в различных формах:
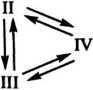
Молекулы исходного инициатора в форме 1, возможно сольватированнные растворителем, состоят из связанных ковалентной связью фрагментов R и Х. Эту форму обычно исключают из рассмотрения, так как она не участвует в инициировании полимеризации. Промежуточные состояния включают прочно связанную или контактную ионную пару II, а также разделенную молекулами растворителя (сольватно – разделенную) ионную пару III. Наконец, система IV представляет собой свободные ионы, образовавшиеся при полной диссоциации молекул инициатора. Переход контактных ионных пар в разделенные не является обязательной стадией, предшествующей диссоциации. Более точно возможные превращения ионных пар можно представить схемой
Теплоту диссоциации ионной пары можно определить непосредственно методом разбавления или оценить по уравнению:
Рис. 1. Свободная энергия как функция координаты реакции. Диаграмма образования карбониевой ионной пары Для системы сферических ионов в бесструктурной диэлектрической среде (диэлектрическая проницаемость D) вероятность нахождения иона В на расстоянии r от иона А равна:
Работа разделения определяется по закону Кулона:
Для одноименных ионов величина Р очень мала, для противоположно заряженных ионов Р проходит через минимум, когда
В этой точке работа разделения ионов равна 2kT, т.е. в 4 раза больше средней кинетической энергии на одну степень свободы. Этот результат впервые получил Бьёррум. При разделении ионов на расстояние большее чем rмин, термическая энергия ионов становится больше, чем электростатическая энергия, и ионы становятся свободными. При расстоянии меньшем чем rмин, справедливо обратное утверждение, и два иона могут рассматриваться как единая частица или ионная пара. Согласно этому определению, в среде с низкой полярностью два иона могут рассматриваться как ионная пара, даже если они разделены одной или несколькими молекулами растворителя. Полной ионизации инициатора R – X способствует повышенная полярность среды; в малополярных средах, например в углеводородных, ионизация уменьшается или исключается полностью и становится все более вероятной ассоциация молекул инициатора: n R – X ↔ (R – X) n причем в указанном равновесии возможно участие нескольких ассоциированных форм, различающихся величиной п. Согласно общепринятой терминологии фрагмент R называется ионом, а X — противоионом; для удобства эти названия распространяют часто и на поляризованные соединения, не являющиеся ионными парами. Наиболее важные активные центры процессов ионной полимеризации представлены ниже: Как и любой процесс, ионная полимеризация включает в себя три стадии: 1. Возникновение активных центров 2. Многократно повторяющийся процесс присоединения к этим активным центрам молекул мономера (рост цепи): КАТИОННАЯ ПОЛИМЕРИЗАЦИЯ Катионной (электрофильной) полимеризацией называют процесс образования макромолекул, в котором активные растущие цепи несут положительный заряд. Для ненасыщенных мономеров с двойной связью С=С главным критерием способности к катионной полимеризации является нуклеофильность двойной связи. Поэтому заместители, увеличивающие электронную плотность на этой связи, повышают ее склонность к катионной полимеризации:
Если обозначить катализатор (кислоту) Н+А-, а мономер М, то отдельные стадии полимеризации можно представить следующим образом:
Основные характеристики катионной полимеризации: 1. Общая энергия активации при катионной полимеризации обычно находится в пределах -42 – 63 кДж/моль (-10 – 15 ккал/моль). При отрицательном значении энергии активации скорость полимеризации уменьшается при повышении температуры. Энергия активации инициирования составляет 21 – 29 кДж/моль (5 – 7) ккал/моль и очень низка по сравнению с энергией активации радикальной полимеризации 84-126 кДж/моль (20 – 30 ккал/моль). Разрыв ковалентной связи в инициаторе связан с большими затратами энергии, в то время, как ионный инициатор поляризован, и реакция инициирования в катионной полимеризации не требует такой высокой энергии. Поэтому катионная полимеризация протекает с высокой скоростью, часто почти мгновенно при низких температурах, когда рост цепи превалирует над обрывом и передачей цепи. 2. Диэлектрическая проницаемость и сольватация среды играют важную роль для конкретного ионного процесса. Среда с низкой диэлектрической проницаемостью и слабой сольватирующей способностью благоприятствует образованию ковалентных связей. Среда с высокой диэлектрической проницаемостью и большой сольватирующей способностью способствует образованию разделенных ионных пар.
|
|||||||||
|
Последнее изменение этой страницы: 2016-08-06; просмотров: 647; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.220.120 (0.135 с.) |
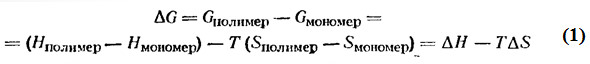


 +Rln[M] и:
+Rln[M] и: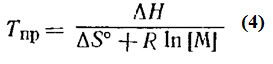
 -энтропия полимеризации в стандартном состоянии при единичной концентрации мономера. Поэтому Тпр можно повысить, увеличивая концентрацию мономера при полимеризации в растворе.
-энтропия полимеризации в стандартном состоянии при единичной концентрации мономера. Поэтому Тпр можно повысить, увеличивая концентрацию мономера при полимеризации в растворе.
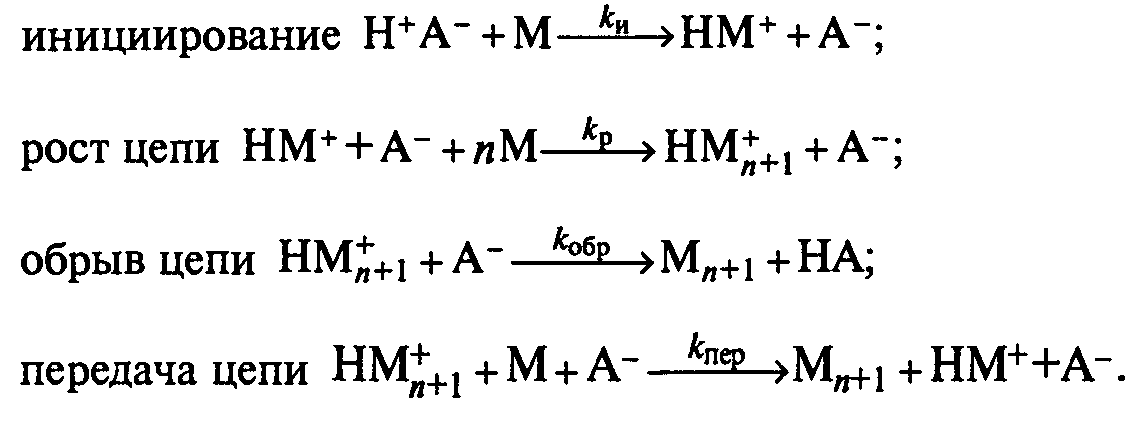










 - переходное состояние ионизации R+ и X- - разделенные ионы.
- переходное состояние ионизации R+ и X- - разделенные ионы.