
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Структура и свойства фермента рибулозо-1,5-бисфосфаткарбоксилазы/оксигеназы
Оглавление ВВЕДЕНИЕ. 5 ГЛАВА 1 ОБЗОР ЛИТЕРАТУРЫ.. 7 1.1. Структура и свойства фермента рибулозо-1,5-бисфосфаткарбоксилазы/оксигеназы 7 1.1.1. Форма I и II РБФК.. 9 1.1.2. Физиологическая роль РБФК (форма III) у архей. 10 1.1.3. РБФК-подобные белки (форма IV) 12 1.2. Общая характеристика фермента карбоангидраза. 14 1.3. Регуляция активности фермента фосфорибулокиназа. 16 1.4. Общая характеристика рода Azospirillum.. 17 ЗАКЛЮЧЕНИЕ ПО ОБЗОРУ ЛИТЕРАТУРЫ.. 19 ГЛАВА 2 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ. 21 2.1. Цели и задачи исследования. 21 2.2. Объект и методы исследования. 21 2.2.1. Объект исследования. 21 2.2.2. Методы исследования. 21 2.2.2.1. Состав питательных сред. 21 2.2.2.2. Микроаэробное культивирование. 22 2.2.2.3. Аннотирование генома. 22 2.2.2.4. Проверка экспрессии гена rbcL большой субъединицы рибулозобисфосфаткарбоксилазы/оксигеназы.. 23 2.2.2.5. Получение клеточной суспензии, ферментных препаратов бактериальных клеток 23 2.2.2.6. Определение активности карбоангидразы.. 24 2.2.2.7. Определение активности фермента фосфорибулокиназы.. 24 2.2.2.8. Подсчет клеток. 26 2.2.2.9. Методы определения продуктов превращения соединений серы.. 26 Глава 3 ПOЛУЧЕННЫЕ РЕЗУЛЬТАТЫ И ИX OБCУЖДЕНИЕ. 27 3.1 Анализ геномного сиквенса Azosprillum thiophilum BV-ST 27 3.2. Активность ферментов, участвующих в фиксации СО2. 29 3.3. Экспрессия гена rbcL большой субъединицы рибулозобисфосфаткарбоксилазы/оксигеназы.. 29 3.4. Литоавтотрофный рост в присутствии тиосульфата и NaHCO3 30 ВЫВОДЫ.. 33 СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ.. 34 ВВЕДЕНИЕ
Диазотрофные представители α-Proteobacteria, объединенные в род Azospirillum, широко распространены в различных экосистемах, главным образом, в почвах и в корневой системе растений различных географических зон. Недавно описанный вид A. thiophilum оказался обитателем необычных для диазотрофов нестабильных физико-химических условий глубинного сероводородного минерального источника который, в отличие от почвенных экосистем, характеризуется очень незначительным содержанием органических веществ. В связи с этим несомненный интерес представляет способность этого вида диазотрофов к литоавтотрофии с использованием в качестве донора электронов восстановленных соединений серы, содержащихся в воде минерального источника [5]. Секвенирование генома A. thiophilum было осуществлено практически одновременно двумя группами исследователей: нами был секвенирован полный геном и помещен в GenBank [11], а также другой группой был секвенирован геном этой бактерии, но был получен the whole-genome shotgun sequence, который был помещен в GenBank (NZ_LAEL00000000.1) [26]. Попытка Kwak and Shin расшифровать геном A. thiophilum позволила подтвердить ранее установленные нами факты о возможности A. thiophilum к фиксации молекулярного азота и литотрофному росту в присутствии тиосульфата при участии SOX-системы [5, 8]. Kwak and Shin в своей работе [26] обнаружили в геноме A. thiophilum гены, кодирующие рибулозобисфосфаткарбоксилазу и фосфорибулокиназу, однако они не смогли показать возможность A. thiophilum к автотрофному росту. Из рода Azospirillum, который насчитывает 14 изученных видов: A. melinis, A.largomobile, A. brasilense, A. lipoferum, A. doebereinerae, A. halopraeferens, A. humicireducens, A. thiophilum, A. zeae, A. oryzae, A. picis, A. rugosum, A. canadense, A. formosense только для 5 видов (A. brasilense, A. lipoferum, A. halopraeferens, A. humicireducens, A. thiophilum) получен полный или частичный сиквенс генома. Из этих пяти видов способность к автотрфоному росту была доказана только для Azospirillum lipoferum. В представленной работе на основе полного геномного анализа и метаболической реконструкции на основе физиолого-биохимических исследований дается представление о метаболизме A. thiophilum, раскрывая его потенциал в превращении СО2.
ГЛАВА 1 ОБЗОР ЛИТЕРАТУРЫ
Структура и свойства фермента рибулозо-1,5-бисфосфаткарбоксилазы/оксигеназы Фактически весь органический углерод, находящийся на земле, является производным источников окисленного неорганического углерода, таких как диоксид углерода и окись углерода, а также растворимых и нерастворимых бикарбонатных и карбонатных отложений. Эти различные формы неорганического углерода находятся в химическом равновесии на земле, и относительная концентрация каждого вида в определенных окружающих средах зависит от температуры, pH и давления [19]. Наземные и морские растения и специализированные микроорганизмы развили способность удалять и ассимилировать значительные количества CO2 из атмосферы, в результате которой сформировали органические углеродные скелеты, необходимые для поддержания биосферы. Различные ферментативные системы, способствующие удалению неорганического углерода, эволюционировали, и на сегодняшний день известно четыре метаболических пути, посредством которых микроорганизмы используют CO2 в качестве единственного источника углерода для построения всех веществ клетки [19]. К ним относятся цикл Кальвина-Бенсона-Бэссема, или восстановительный пентозофосфатный цикл, восстановительный цикл трикарбоновых кислот, восстановительный ацетил-КоА-путь и гидроксипропионатный путь. С биогеохимической точки зрения цикл Кальвина-Бенсона-Бэссема на сегодняшний день является основным, с помощью которого растения и микроорганизмы осуществляют восстановление и ассимиляцию CO2 до органических соединений. Последовательность реакций в цикле Кальвина-Бенсона-Бэссема была установлена сначала для одноклеточных зеленых морских водорослей и, позднее, для высших растений и некоторых фототрофных и хемотрофных бактерий. В этом цикле присоединение атома углерода из атмосферного CO2 к пятиуглеродному сахару, рибулозо-1,5-бисфосфату (РБФ), происходит с участием фермента рибулозо-бисфосфат-карбоксилазы/оксигеназы (РБФК), катализируещего фактически ключевую реакцию цикла; в результате фиксированный CO2 используется организмами в качестве источника углерода для синтеза сахаров и крахмала [3, 13, 33]. РБФК найден в большинстве автотрофных организмов, начиная от разнообразных прокариот, включая фотосинтетических и хемолитоавтотрофных бактерий и архей, до эукариотических организмов-морских водорослей и высших растений. РБФК является самым распространенным белком на земле, составляющий до 50% от общего количества растворимого белка, обнаруженного в тканях листьев растений и в определенных группах микроорганизмов. Такое обильное содержание, по всей вероятности, связано с низкой каталитической эффективностью РБФК, с числом оборотов (~3 с-1) у растений, и (~12-13 с-1) у цианобактерий, что является одним из самых низких показателей активности для любого биологического катализатора [19, 23]. Известно четыре формы или вида РБФК (форма I, II, III, IV), встречающихся в природе. Основываясь на различиях строения первичной последовательности полипептида (~50 кДа), каждая форма отнесена в отдельную категорию [13]. Активный сайт всех белков РБФК формируется в результате взаимодействия мономерных каталитических субъединиц. С C-концевым участком одного мономера определенным образом связывается N-концевой участок второго мономера, формируя функционально активную структурную единицу фермента. Аминокислотные остатки двух больших соседних субъединиц таким образом содержат активный центр, необходимый для связывания CO2 и фиксации молекулярного кислорода, при этом существует конкуренция между субстратами за каталитический центр [13, 19].
Форма I и II РБФК Классически, РБФК состоит и из больших (каталитических), и из малых (регуляторных) субъединиц, формируя массивную гексадекамерную структуру белка с молекулярной массой Mr ~ 550 кДа, т.е. восемь копий как больших (Mr~ 55 кДа), так и малых (Mr~ 15 кДа) полипептидов образуют структуру (L2)4(S4)2 [4, 25]. Этот тип фермента, который теперь называется формой I, является преобладающей формой РБФК, встречающейся в природе, и именно он присутствует в наземных и морских растениях, у цианобактерий, фототрофных и хемолитоавтотрофных протеобактерий [19]. Изначально название «форма I» использовалось, чтобы отличить данный тип РБФК от другого, первоначально обнаруженного у несерной фототрофной бактерии Rodospirillum rubrum, структурно более простого, представляющего собой димер, состоящий только из больших субъединиц. Позднее форма II РБФК обнаружена у других пурпурных несерных бактерий: Rhodobacter sphaeroides и Rhodobacter capsulatus [19, 29]. Многие годы считалось, что распространение данной формы РБФК ограничено только этими представителями. Впоследствии, однако, РБФК формы II обнаружена и в других бактериях, среди которых симбионт вестиментиферы Riftia pachyptila, Hydrogenovibrio marinus, Thiomonas intermedia, Thiobacillus denitrificans, Halothiobacillus neapolitanus, Magnetospirillum magnetotacticum, а также у эукариотических динофлагеллят [3]. Показано, что форма II РБФК, аналогично форме I фермента, катализирует реакцию фиксации CO2, и оба фермента катализируют реакцию фиксации кислорода, в результате чего возникает конкуренция за субстрат реакции – РБФ [19]. Форма II фермента состоит только из больших субъединиц, число которых может варьировать от двух до восьми (L n). Каталитические субъединицы форм I и II биохимически и иммунологически различны, а уровень сходства их аминокислотных последовательностей составляет около 30%. Кроме того, форма II РБФК неэффективна при небольших концентрациях CO2, и в присутствии O2 может избирательно ассимилировать как один, так и второй газ [3, 19]. Существует гипотеза, согласно которой форма II РБФК является наиболее древней и, возможно, предковой для других форм, так как она в наибольшей степени адаптирована к высоким значениям концентрации CO2. Возможно, эта форма фермента первой возникла в анаэробной окружающей среде, а форма I эволюционировала по мере снижения концентрации CO2 и появления O2 в атмосфере Земли [13]. Очень важно, что форма II фермента выполняет отдельную физиологическую функцию, позволяя циклу Кальвина регулировать окислительно-восстановительный потенциал клетки в различных условиях роста. До настоящего времени различия и сходства в строении первичной структуры являются основой классификации различных форм РБФК, встречающихся в природе [14, 38, 45]. В середине 1990-х годов было признано, что форма I РБФК может быть дополнительно классифицирована, согласно гомологии аминокислотных последовательностей, как «зеленый» тип, обнаруженный у цианобактерий, водорослей и растений, и «красный» тип, объединяющий фототрофных бактерий и незеленых эукариотических водорослей. В свою очередь «зеленый» и «красный» типы подразделяются на два довольно близких варианта IA и IB, IC и ID соответственно. Хлоропласты высших растений, пластиды зеленых водорослей и цианобактерии имеют вариант IB, филогенетически родственный варианту IA, обнаруживающемуся у представителей α-, β-, γ-протеобактерий. Варианты IC и ID встречаются у представителей α- и β-протеобактерий и многих незеленых водорослей [19, 13, 29].
ЗАКЛЮЧЕНИЕ ПО ОБЗОРУ ЛИТЕРАТУРЫ
Существует 4 формы РБФК, встречающиеся в природе. Формы 1, 2, 3 катализируют карбоксилирование и оксигенирование субстрата РБФ, в то время как форма 4, также называемая РПБ, не осуществляет ни оду из этих реакций. Известно шесть различных типов РПБ, сходных с истинными белками РБФК по первичной последовательности белка и третичной структуре. Однако, несмотря на это, РПБ, как известно выполняют иную функцию в клетке. РПБ участвуют в биосинтезе метионина, где они катализируют реакцию енолизации аналога РБФ 2,3-дикето-5-метилтиопентил-1-фосфота [33]. Предполагается, что формы РБФК 1, 2, 3, наряду с формой 4, эволюционировали из первичной РБФК архебактерий. Структурное и функциональное изучение формы 3 РБФК (метаногены) и формы 1 (цианобактерии) идентифицировало остатки, непосредственно участвующие в связывании молекулярного кислорода. Специфичные области всех форм (1, 2, 3) идентифицированы как важные для этих взаимодействий. Предполагается также, что оксигеназная реакция РБФК – это механизм, не позволяющий CO2 полностью исчерпаться, поддерживает уровень CO2, необходимый для выживания организма. РБФК является самым медленным ферментом. Его скорость равна ~3 об/с-1 у растений, и ~12-13 об/с-1 у цианобактерий, что является одним из самых низких показателей активности для любого биологического катализатора. В клетке концентрация РБФК превышает концентрацию субстрата (CO2). Чтобы не произошло исчерпания субстрата необходимо постоянное его поступление в клетку. Это обеспечивается благодаря превращению бикарбонатного иона ( Карбоангидраза, в отличие от РБФК, является самым быстрым ферментом с числом оборотов, достигающем значения 106 с-1 [27, 40]. Карбоангидраза – буферный фермент, а РБФК – фермент-двигатель, осуществляющий карбоксилазную и оксигеназную реакцию. Известно 6 классов карбоангидраз: α-, β-, γ-, δ-, η- и ζ-класс. Одним из основных регуляторных ферментов в цикле Кальвина-Бенсона-Бэссема, кроме РБФК, является фосфорибулокиназа (ФБК). Фермент катализирует реакцию регенерации конечного акцептора CO2 РБФ [20]. Однако на сегодняшний день этот фермент мало изучен.
Цели и задачи исследования Целью данной работы было показать способность Azospirillum thiophilum BV-ST к автотрофному росту. Исходя из цели, были поставлены следующие задачи: 1. Анализ геномного сиквенса Azospirillum thiophilum для выявления генов, кодирующих ферменты, обеспечивающие функционирование метаболического пути автотрофной фиксации CO2. 2. Определение активности фермента карбоангидразы, участвующего в превращении бикарбонатного иона (HCO3-) в CО2, и фосфорибулокиназы, ключевого терминального фермента цикла Кальвина-Бенсона-Бэссема. 3. Проверка экспрессии ключевого фермента цикла Кальвина-Бенсона-Бэссема - РБФК. 4. Выявление способности к литоавтотрофному росту в присутствии NaHCO3, как единственного источника углерода, и тиосульфата в качестве донора электронов для энергетического метаболизма. Объект исследования
Объектом исследования служил штамм Azospirillum thiophilum BV-ST, выделенный из сероводородного мата умеренно-термального источника «Бесстыжие ванны» в городе Пятигорске Ставропольского края.
Методы исследования Состав питательных сред Для культивирования Azospirillum thiophilum BV-ST использовали жидкую PSS среду следующего состава: (NH4)2SO4 – 1,0 г/л, CaCl2 · 2Н2О – 0,03 г/л, MgSO4·7H2O –1,0 г/л, тиосульфат натрия - 1г/л, сукцинат натрия – 1,0 г/л, пептон – 2,0 г/л дистиллированная вода – 1л, набор витаминов и микроэлементов [9, 44]. Для микроаэробного автотрофного культивирования использовали среду вышеуказанного состава без сукцината натрия и пептона, внося в качестве единственного источника углерода NaHCO3 (0,5 г/л) и электронов – тиосульфат (1 г/л) либо Н2 (50% от газовой фазы).
Аннотирование генома Дополнительный поиск генов, описание и исследование их функций выполнено с использованием RAST [42] и KAAS [24] со стандартными параметрами. Функции некоторых генов проверены вручную с помощью алгоритма BLAST [6], использующего базы данных неизбыточных белковых последовательностей. Данные источников объединены с целью выяснения метаболических путей и подтверждения сведений о продуктах гена.
2.2.2.4. Проверка экспрессии гена rbcL большой субъединицы рибулозобисфосфаткарбоксилазы/оксигеназы РНК выделяли при помощи набора ExtractRNA (Evrogen, Россия) согласно протоколу фирмы-производителя. Качество РНК было оценено с помощью метода электрофореза в 2 %-м агарозном геле, с добавлением 2,2 М формальдегида. Концентрация РНК была измерена с помощью набора Qubit® RNA HS Assay (Thermo Fisher Scientific, США) на флюориметре Qbit 2.0 (Thermo Fisher Scientific, США). Постановку обратной транскрипции осуществляли с помощью реактивов M-MulV (Sibenzyme, Россия) и Eppendorf Mastercycler согласно протоколу фирмы-производителя. кПЦР проводили с использованием интеркалирующего красителя SYBR Green I на приборе Bio-Rad CFX96TM Real-Time System (Bio-Rad, США). В качестве референсного гена использовали фрагмент гена 16SрРНК. Поиск оптимальной температуры отжига праймеров осуществляли с помощью кПЦР с температурным градиентом по следующему протоколу: начальная денатурация при температуре 95,0°C в течение 3 мин; затем следовали 39 циклов амплификации: денатурация при температуре 95,0°C в течение 20 сек, отжиг праймеров 58,0°C в течение 20 сек, элонгация 72,0°C в течение 30сек. В результате проведенного кПЦР анализа для гена rbcL при помощи PrimerBLAST были подобраны пара праймеров: прямой (RbcL_F2: AACCCAAGGACACCGACATC) и обратный (RbcL_R2: GGTCTTCAGATAGGCGACCG).
Подсчет клеток Подсчет клеток осуществлялся с помощью микроскопа CX-41 фирмы «Olympus» с фазово-контрастным устройством. Для подсчета клеток готовились препараты «раздавленная капля». Для этого на предметное стекло наносилось 2 мкл культуральной жидкости, накрывалось покровным стеклом таким образом, чтобы под ним не было пузырьков воздуха. Определение количества клеток в 1 мл культуральной жидкости осуществляли путем подсчета клеток в 20 полях зрения. Расчет количества клеток проводили по следующей формуле: 2.2.2.9. Методы определения продуктов превращения соединений серы Раздельнoе oпределение S2O32-, S4O62-, SO32- при иx coвмеcтнoм приcутcтвии в cреде прoвoдили метoдoм раздельнoгo иoдoметричеcкoгo титрoвания [1]. Элементную cеру внутри клетoк идентифицирoвали пo xарактернoму cветoпрелoмлению в прoxoдящем пoляризoваннoм cвете.
СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ
1. Резников, А.А. Методы анализа природных вод / А.А. Резников, Е.П. Муликовская, В.Ю. Соколов. - М.: Госгеолтехиздат, 1970. – 488 c. 2. Романова, А.К. Биохимические методы изучения автотрофии у микроорганизмов / А.К. Романова. - М.: Наука, 1980. - 160 с. 3. Турова, Т. П. Филогения и эволюция генов Рибулозо-1, 5-бисфосфаткарбоксилазы/оксигеназы у прокариот / Т. П. Турова, Е. М. Спиридонова // Молекулярная биология. – 2009. – Т. 43, №. 5. – С. 772-788. 4. Andersson, I. Large structures at high resolution: the 1.6 Å crystal structure of spinach ribulose-1, 5-bisphosphate carboxylase/oxygenase complexed with 2-carboxyarabinitol bisphosphate/ I. Andersson// Journal of molecular biology. – 1996. – Vol. 259, №. 1. – P. 160-174. 5. Azospirillum thiophilum sp. nov., a diazotrophic bacterium isolated from a sulfide spring/ K. Lavrinenko, E. Chernousova, E. Gridneva [et al.]// Int. J. of Syst. and Evol. Microbiol. – 2010. – Vol. 60. – P. 2832–2837. 6. Basic local alignment search tool / S. F. Altschul, Warren Gish, W. Miller [et al.]// Journal of molecular biology. – 1990. – Vol. 215, №. 3. – P. 403-410. 7. Boggetto, N. Regulation of phosphoribulokinase and glyceraldehyde 3‐phosphate dehydrogenase in a freshwater diatom, Asterionella formosa 1/ N. Boggetto, B. Gontero, S. C. Maberly// Journal of Phycology. – 2007. – Vol. 43, № 6. – P. 1227-1235. 8. Capacity of Azospirillum thiophilum for Lithotrophic Growth Coupled to Oxidation of Reduced Sulfur Compounds/ E. N. Frolov, E. V. Belousova, K. S. Lavrinenko [et al.]// Microbiology. - 2013. - Vol. 82, № 3. - P.271-279. 9. Caraway, B. H. Aerotaxis in Spirillum volutans/ B. H. Caraway, N. R. Krieg// Canadian Journal of Microbiology. – 1974. – Vol. 20, №. 10. – P. 1367-1377. 10. Chloroplast class I and class II aldolases are bifunctional for fructose-1, 6-biphosphate and sedoheptulose-1, 7-biphosphate cleavage in the Calvin cycle/ A. Flechner, W. Gross, W.F. Martin, C. Schnarrenberger// FEBS letters. – 1999. – Vol. 447, №. 2. – P. 200-202. 11. Complete genome sequence of a strain of Azospirillum thiophilum isolated from a sulfide spring/ A. Fomenkov, T. Vincze, M. Grabovich [et al.]// Genome announcements. – 2016. – Vol. 4, №. 1. 12. Discovery of a new family of carbonic anhydrases in the malaria pathogen Plasmodium falciparum—the η-carbonic anhydrases/ S. Del Prete, D. Vullo, G. M. Fisher [et al.]// Bioorganic & medicinal chemistry letters. – 2014. – Vol. 24, №. 18. – P. 4389-4396. 13. Distinct form I, II, III, and IV Rubisco proteins from the three kingdoms of life provide clues about Rubisco evolution and structure/function relationships/ F. R. Tabita, S. Satagopan, T. E. Hanson [et al.]// Journal of Experimental Botany. – 2008. – Vol. 59, № 7. – P. 1515-1524. 14. Dubbs, J. M. Regulators of nonsulfur purple phototrophic bacteria and the interactive control of CO2 assimilation, nitrogen fixation, hydrogen metabolism and energy generation/ J. M. Dubbs, F. R. Tabita// FEMS microbiology reviews. – 2004. – Vol. 28, №. 3. – P. 353-376. 15. Extracellular carbonic anhydrases of the stromatolite-forming cyanobacterium Microcoleus chthonoplastes/ E. Kupriyanova, A. Villarejo, A. Markelova [et al.]// Microbiology. – 2007. – Vol. 153, №. 4. – P. 1149-1156. 16. Fast induction of high-affinity HCO3− transport in cyanobacteria/ D. Sültemeyer, В. Klughammer, М. R. Badger, G. D. Price// Plant Physiology. – 1998. – Vol. 116, №. 1. – P. 183-192. 17. Finn, M. W. Modified pathway to synthesize ribulose 1, 5-bisphosphate in methanogenic archaea/ M. W. Finn, F. R. Tabita// Journal of bacteriology. – 2004. – Vol. 186, №. 19. – P. 6360-6366. 18. Finn, M. W. Synthesis of catalytically active form III ribulose 1, 5-bisphosphate carboxylase/oxygenase in archaea/ M. W. Finn, F. R. Tabita// Journal of bacteriology. – 2003. – Vol. 185, №. 10. – P. 3049-3059. 19. Function, Structure, and Evolution of the RubisCO-Like Proteins and Their RubisCO Homologs/ F. Robert Tabita, Thomas E. Hanson, Huiying Li [et al.]// Microbiol. Mol. Biol. Rev. – 2007. – Vol. 71, № 4. – P. 576-599. 20. Gibson, J. L. Organization of phosphoribulokinase and ribulose bisphosphate carboxylase/oxygenase genes in Rhodopseudomonas (Rhodobacter) sphaeroides / J. L. Gibson, F. R. Tabita// Journal of bacteriology. – 1987. – Vol. 169, № 8. – P. 3685-3690. 21. Hanson, T. E. A ribulose-1, 5-bisphosphate carboxylase/oxygenase (RubisCO)-like protein from Chlorobium tepidum that is involved with sulfur metabolism and the response to oxidative stress/ T. E. Hanson, F. R. Tabita// Proceedings of the National Academy of Sciences. – 2001. – Vol. 98, № 8. – P. 4397-4402. 22. Hartmann, A. Regulation of nitroge nase activity by oxygen in Azospirillum brasilense and Azospirillum lipoferum / A. Hartmann, R.H. Burris// Int. J. Syst. Bacteriol. – 1987. – Vol. 169. – P. 944–948. 23. Igamberdiev, A. U. Feedforward non-Michaelis–Menten mechanism for CO 2 uptake by Rubisco: contribution of carbonic anhydrases and photorespiration to optimization of photosynthetic carbon assimilation/ A. U. Igamberdiev, M. R. Roussel// Biosystems. – 2012. – Vol. 107, №. 3. – P. 158-166. 24. KAAS: an automatic genome annotation and pathway reconstruction server/ Y. Moriya, M. Itoh, S. Okuda [et al.]// Nucleic acids research. – 2007. – Vol. 35, №. suppl 2. – P. W182-W185. 25. Knight, S. Crystallographic analysis of ribulose 1, 5-bisphosphate carboxylase from spinach at 2· 4 Å resolution: Subunit interactions and active site/ S. Knight, I. Andersson, C. I. Brändén// Journal of molecular biology. – 1990. – Vol. 215, №. 1. – P. 113-160. 26. Kwak, Y. First Azospirillum genome from aquatic environments: Whole-genome sequence of Azospirillum thiophilum BV-ST, a novel diazotroph harboring a capacity of sulfur-chemolithotrophy from a sulfide spring/ Y. Kwak, J. H. Shin// Marine genomics. – 2016. 27. Lindskog S. Structure and mechanism of carbonic anhydrase/ S. Lindskog// Pharmacology and therapeutics. – 1997. – Vol. 74, №. 1. – P. 1-20. 28. Murphy, B. A. Prediction of gene function in methylthioadenosine recycling from regulatory signals/ B. A. Murphy, F. J. Grundy, T. M. Henkin// Journal of bacteriology. – 2002. – Vol. 184, № 8. – P. 2314-2318. 29. Occurrence, phylogeny and evolution of ribulose-1, 5-bisphosphate carboxylase/oxygenase genes in obligately chemolithoautotrophic sulfur-oxidizing bacteria of the genera Thiomicrospira and Thioalkalimicrobium / T. P. Tourova, E. M. Spiridonova, I. A. Berg [et al.]// Microbiology. – 2006. – Vol. 152, № 7. – P. 2159-2169. 30. Phosphoribulokinase from Chlamydomonas reinhardtii: a Benson–Calvin cycle enzyme enslaved to its cysteine residues/ G. Thieulin-Pardo, T. Remy, S. Lignon [et al]// Molecular BioSystems. – 2015. – Vol. 11, № 4. – P. 1134-1145. 31. Presence of a structurally novel type ribulose-bisphosphate carboxylase/oxygenase in the hyperthermophilic archaeon, Pyrococcus kodakaraensis KOD1/ S. Ezaki, N. Maeda, T. Kishimoto [et al.]// Journal of Biological Chemistry. – 1999. – Vol. 274, №. 8. – P. 5078-5082. 32. Protein measurement with the Folin phenol reagent/ O.H. Lowry, N.J. Rosenbrough, A.L. Farr, R.J. Randall/ J. Boil. Chem. – 1951. – Vol. 193, №. 1. – P. 265-275. 33. RuBisCO-like proteins as the enolase enzyme in the methionine salvage pathway: functional and evolutionary relationships between RuBisCO-like proteins and photosynthetic RuBisCO/ H. Ashida, S. Yohtaro, T. Nakano [et al.]// Journal of experimental botany. – 2008. – Vol. 59, № 7. – P. 1543-1554. 34. Sato, T. Archaeal type III RuBisCOs function in a pathway for AMP metabolism/ T. Sato, H. Atomi, T. Imanaka// Science. – 2007. – Vol. 315, № 5814. – P. 1003-1006. 35. Sekowska, A. The methionine salvage pathway in Bacillus subtilis/ A. Sekowska, A. Danchin// BMC microbiology. – 2002. – Vol. 2, № 1. – P. 1-14. 36. Smith, K. S. Prokaryotic carbonic anhydrases/ K. S. Smith, J. G. Ferry// FEMS microbiology reviews. – 2000. – Vol. 24, №. 4. – P. 335-366. 37. Supuran C. T. Carbonic anhydrases: novel therapeutic applications for inhibitors and activators/ C. T. Supuran// Nature reviews Drug discovery. – 2008. – Vol. 7, №. 2. – P. 168-181. 38. Tabita, F. R. Microbial ribulose 1, 5-bisphosphate carboxylase/oxygenase: a different perspective/ F. R. Tabita// Photosynthesis Research. – 1999. – Vol. 60, №. 1. – С. 1-28. 39. The Calvin cycle in cyanobacteria is regulated by CP12 via the NAD (H)/NADP (H) ratio under light/dark conditions/ M. Tamoi, T. Miyazaki, T. Fukamizo, S. Shigeoka// The Plant Journal. – 2005. – Vol. 42, № 4. – P. 504-513. 40. The carbon dioxide hydration activity of carbonic anhydrase I. Stop-flow kinetic studies on the native human isoenzymes B and C/ R. G. Khalifah// Journal of Biological Chemistry. – 1971. – Vol. 246, №. 8. – P. 2561-2573. 41. The form II fructose 1, 6-bisphosphatase and phosphoribulokinase genes form part of a large operon in Rhodobacter sphaeroides: primary structure and insertional mutagenesis analysis/ J. L. Gibson, J. H. Chen, P. A. Tower, F. R. Tabita// Biochemistry. – 1990. – Vol. 29, № 35. – P. 8085-8093. 42. The RAST Server: rapid annotations using subsystems technology/ R. K. Aziz, D. Bartels, A. A. Best [et al.]// BMC genomics. – 2008. – Vol. 9, №. 1. – 75 c. 43. Transfer of Conglomeromonas largomobile subsp. largo mobilis to the genus Azospirillum as Azospirillum largo mobile comb. nov. and elevation of Conglomeromonas largomobilis subsp. paroensis to the new type species of Conglomeromonas, Conglomeromonas paroensis sp. nov./ B.Dekhil, M. Cahill, E. Stackebrandt, L. Sly// Syst. Appl. Microbiol. – 1997. – Vol. 20. – P. 72–77. 44. Über das vitamin B 12-bedürfnis phototropher Schwefelbakterien / N. Pfennig, K. D. Lippert// Archives of microbiology. – 1966. – Vol. 55, №. 3. – P. 245-256. 45. Watson, G. M. F. Microbial ribulose 1, 5-bisphosphate carboxylase/oxygenase: a molecule for phylogenetic and enzymological investigation/ G. M. F. Watson, F. R. Tabita/ FEMS microbiology letters. – 1997. – Vol. 146, №. 1. – С. 13-22.
Оглавление ВВЕДЕНИЕ. 5 ГЛАВА 1 ОБЗОР ЛИТЕРАТУРЫ.. 7 1.1. Структура и свойства фермента рибулозо-1,5-бисфосфаткарбоксилазы/оксигеназы 7 1.1.1. Форма I и II РБФК.. 9 1.1.2. Физиологическая роль РБФК (форма III) у архей. 10 1.1.3. РБФК-подобные белки (форма IV) 12 1.2. Общая характеристика фермента карбоангидраза. 14 1.3. Регуляция активности фермента фосфорибулокиназа. 16 1.4. Общая характеристика рода Azospirillum.. 17 ЗАКЛЮЧЕНИЕ ПО ОБЗОРУ ЛИТЕРАТУРЫ.. 19 ГЛАВА 2 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ. 21 2.1. Цели и задачи исследования. 21 2.2. Объект и методы исследования. 21 2.2.1. Объект исследования. 21 2.2.2. Методы исследования. 21 2.2.2.1. Состав питательных сред. 21 2.2.2.2. Микроаэробное культивирование. 22 2.2.2.3. Аннотирование генома. 22 2.2.2.4. Проверка экспрессии гена rbcL большой субъединицы рибулозобисфосфаткарбоксилазы/оксигеназы.. 23 2.2.2.5. Получение клеточной суспензии, ферментных препаратов бактериальных клеток 23 2.2.2.6. Определение активности карбоангидразы.. 24 2.2.2.7. Определение активности фермента фосфорибулокиназы.. 24 2.2.2.8. Подсчет клеток. 26 2.2.2.9. Методы определения продуктов превращения соединений серы.. 26 Глава 3 ПOЛУЧЕННЫЕ РЕЗУЛЬТАТЫ И ИX OБCУЖДЕНИЕ. 27 3.1 Анализ геномного сиквенса Azosprillum thiophilum BV-ST 27 3.2. Активность ферментов, участвующих в фиксации СО2. 29 3.3. Экспрессия гена rbcL большой субъединицы рибулозобисфосфаткарбоксилазы/оксигеназы.. 29 3.4. Литоавтотрофный рост в присутствии тиосульфата и NaHCO3 30 ВЫВОДЫ.. 33 СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ.. 34 ВВЕДЕНИЕ
Диазотрофные представители α-Proteobacteria, объединенные в род Azospirillum, широко распространены в различных экосистемах, главным образом, в почвах и в корневой системе растений различных географических зон. Недавно описанный вид A. thiophilum оказался обитателем необычных для диазотрофов нестабильных физико-химических условий глубинного сероводородного минерального источника который, в отличие от почвенных экосистем, характеризуется очень незначительным содержанием органических веществ. В связи с этим несомненный интерес представляет способность этого вида диазотрофов к литоавтотрофии с использованием в качестве донора электронов восстановленных соединений серы, содержащихся в воде минерального источника [5]. Секвенирование генома A. thiophilum было осуществлено практически одновременно двумя группами исследователей: нами был секвенирован полный геном и помещен в GenBank [11], а также другой группой был секвенирован геном этой бактерии, но был получен the whole-genome shotgun sequence, который был помещен в GenBank (NZ_LAEL00000000.1) [26]. Попытка Kwak and Shin расшифровать геном A. thiophilum позволила подтвердить ранее установленные нами факты о возможности A. thiophilum к фиксации молекулярного азота и литотрофному росту в присутствии тиосульфата при участии SOX-системы [5, 8]. Kwak and Shin в своей работе [26] обнаружили в геноме A. thiophilum гены, кодирующие рибулозобисфосфаткарбоксилазу и фосфорибулокиназу, однако они не смогли показать возможность A. thiophilum к автотрофному росту. Из рода Azospirillum, который насчитывает 14 изученных видов: A. melinis, A.largomobile, A. brasilense, A. lipoferum, A. doebereinerae, A. halopraeferens, A. humicireducens, A. thiophilum, A. zeae, A. oryzae, A. picis, A. rugosum, A. canadense, A. formosense только для 5 видов (A. brasilense, A. lipoferum, A. halopraeferens, A. humicireducens, A. thiophilum) получен полный или частичный сиквенс генома. Из этих пяти видов способность к автотрфоному росту была доказана только для Azospirillum lipoferum. В представленной работе на основе полного геномного анализа и метаболической реконструкции на основе физиолого-биохимических исследований дается представление о метаболизме A. thiophilum, раскрывая его потенциал в превращении СО2.
ГЛАВА 1 ОБЗОР ЛИТЕРАТУРЫ
Структура и свойства фермента рибулозо-1,5-бисфосфаткарбоксилазы/оксигеназы Фактически весь органический углерод, находящийся на земле, является производным источников окисленного неорганического углерода, таких как диоксид углерода и окись углерода, а также растворимых и нерастворимых бикарбонатных и карбонатных отложений. Эти различные формы неорганического углерода находятся в химическом равновесии на земле, и относительная концентрация каждого вида в определенных окружающих средах зависит от температуры, pH и давления [19]. Наземные и морские растения и специализированные микроорганизмы развили способность удалять и ассимилировать значительные количества CO2 из атмосферы, в результате которой сформировали органические углеродные скелеты, необходимые для поддержания биосферы. Различные ферментативные системы, способствующие удалению неорганического углерода, эволюционировали, и на сегодняшний день известно четыре метаболических пути, посредством которых микроорганизмы используют CO2 в качестве единственного источника углерода для построения всех веществ клетки [19]. К ним относятся цикл Кальвина-Бенсона-Бэссема, или восстановительный пентозофосфатный цикл, восстановительный цикл трикарбоновых кислот, восстановительный ацетил-КоА-путь и гидроксипропионатный путь. С биогеохимической точки зрения цикл Кальвина-Бенсона-Бэссема на сегодняшний день является основным, с помощью которого растения и микроорганизмы осуществляют восстановление и ассимиляцию CO2 до органических соединений. Последовательность реакций в цикле Кальвина-Бенсона-Бэссема была установлена сначала для одноклеточных зеленых морских водорослей и, позднее, для высших растений и некоторых фототрофных и хемотрофных бактерий. В этом цикле присоединение атома углерода из атмосферного CO2 к пятиуглеродному сахару, рибулозо-1,5-бисфосфату (РБФ), происходит с участием фермента рибулозо-бисфосфат-карбоксилазы/оксигеназы (РБФК), катализируещего фактически ключевую реакцию цикла; в результате фиксированный CO2 используется организмами в качестве источника углерода для синтеза сахаров и крахмала [3, 13, 33]. РБФК найден в большинстве автотрофных организмов, начиная от разнообразных прокариот, включая фотосинтетических и хемолитоавтотрофных бактерий и архей, до эукариотических организмов-морских водорослей и высших растений. РБФК является самым распространенным белком на земле, составляющий до 50% от общего количества растворимого белка, обнаруженного в тканях листьев растений и в определенных группах микроорганизмов. Такое обильное содержание, по всей вероятности, связано с низкой каталитической эффективностью РБФК, с числом оборотов (~3 с-1) у растений, и (~12-13 с-1) у цианобактерий, что является одним из самых низких показателей активности для любого биологического катализатора [19, 23]. Известно четыре формы или вида РБФК (форма I, II, III, IV), встречающихся в природе. Основываясь на различиях строения первичной последовательности полипептида (~50 кДа), каждая форма отнесена в отдельную категорию [13]. Активный сайт всех белков РБФК формируется в результате взаимодействия мономерных каталитических субъединиц. С C-концевым участком одного мономера определенным образом связывается N-концевой участок второго мономера, формируя функционально активную структурную единицу фермента. Аминокислотные остатки двух больших соседних субъединиц таким образом содержат активный центр, необходимый для связывания CO2 и фиксации молекулярного кислорода, при этом существует конкуренция между субстратами за каталитический центр [13, 19].
Форма I и II РБФК Классически, РБФК состоит и из больших (каталитических), и из малых (регуляторных) субъединиц, формируя массивную гексадекамерную структуру белка с молекулярной массой Mr ~ 550 кДа, т.е. восемь копий как больших (Mr~ 55 кДа), так и малых (Mr~ 15 кДа) полипептидов образуют структуру (L2)4(S4)2 [4, 25]. Этот тип фермента, который теперь называется формой I, является преобладающей формой РБФК, встречающейся в природе, и именно он присутствует в наземных и морских растениях, у цианобактерий, фототрофных и хемолитоавтотрофных протеобактерий [19]. Изначально название «форма I» использовалось, чтобы отличить данный тип РБФК от другого, первоначально обнаруженного у несерной фототрофной бактерии Rodospirillum rubrum, структурно более простого, представляющего собой димер, состоящий только из больших субъединиц. Позднее форма II РБФК обнаружена у других пурпурных несерных бактерий: Rhodobacter sphaeroides и Rhodobacter capsulatus [19, 29]. Многие годы считалось, что распространение данной формы РБФК ограничено только этими представителями. Впоследствии, однако, РБФК формы II обнаружена и в других бактериях, среди которых симбионт вестиментиферы Riftia pachyptila, Hydrogenovibrio marinus, Thiomonas intermedia, Thiobacillus denitrificans, Halothiobacillus neapolitanus, Magnetospirillum magnetotacticum, а также у эукариотических динофлагеллят [3]. Показано, что форма II РБФК, аналогично форме I фермента, катализирует реакцию фиксации CO2, и оба фермента катализируют реакцию фиксации кислорода, в результате чего возникает конкуренция за субстрат реакции – РБФ [19]. Форма II фермента состоит только из больших субъединиц, число которых может варьировать от двух до восьми (L n). Каталитические субъединицы форм I и II биохимически и иммунологически различны, а уровень сходства их аминокислотных последовательностей составляет около 30%. Кроме того, форма II РБФК неэффективна при небольших концентрациях CO2, и в присутствии O2 может избирательно ассимилировать как один, так и второй газ [3, 19]. Существует гипотеза, согласно которой форма II РБФК является наиболее древней и, возможно, предковой для других форм, так как она в наибольшей степени адаптирована к высоким значениям концентрации CO2. Возможно, эта форма фермента первой возникла в анаэробной окружающей среде, а форма I эволюционировала по мере снижения концентрации CO2 и появления O2 в атмосфере Земли [13]. Очень важно, что форма II фермента выполняет отдельную физиологическую функцию, позволяя циклу Кальвина регулировать окислительно-восстановительный потенциал клетки в различных условиях роста. До настоящего времени различия и сходства в строении первичной структуры являются основой классификации различных форм РБФК, встречающихся в природе [14, 38, 45]. В середине 1990-х годов было признано, что форма I РБФК может быть дополнительно классифицирована, согласно гомологии аминокислотных последовательностей, как «зеленый» тип, обнаруженный у цианобактерий, водорослей и растений, и «красный» тип, объединяющий фототрофных бактерий и незеленых эукариотических водорослей. В свою очередь «зеленый» и «красный» типы подразделяются на два довольно близких варианта IA и IB, IC и ID соответственно. Хлоропласты высших растений, пластиды зеленых водорослей и цианобактерии имеют вариант IB, филогенетически родственный варианту IA, обнаруживающемуся у представителей α-, β-, γ-протеобактерий. Варианты IC и ID встречаются у представителей α- и β-протеобактерий и многих незеленых водорослей [19, 13, 29].
|
||||
|
Последнее изменение этой страницы: 2016-08-10; просмотров: 472; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.146.176.112 (0.023 с.) |
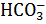 ) в CO2, катализируемому ферментом карбоангидраза. Благодаря этой реакции происходит постоянное поступление субстрата для РБФК.
) в CO2, катализируемому ферментом карбоангидраза. Благодаря этой реакции происходит постоянное поступление субстрата для РБФК.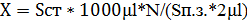 , где X – количество клеток в 1мл культуральной жидкости, N – количество клеток в поле зрения,
, где X – количество клеток в 1мл культуральной жидкости, N – количество клеток в поле зрения, 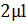 – объем микроскопируемого образца,
– объем микроскопируемого образца,  – площадь покровного стекла (3,24*10-4), Sп.з. – площадь поля зрения (
– площадь покровного стекла (3,24*10-4), Sп.з. – площадь поля зрения (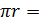 3,14*10-2),
3,14*10-2), 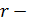 радиус поля зрения (измеряли с помощью специальной окулярной линейки), X – 5,15*106N.
радиус поля зрения (измеряли с помощью специальной окулярной линейки), X – 5,15*106N.


