Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Участие Р-гликопротеина в выведении ксенобиотиковСодержание книги
Поиск на нашем сайте
Очень важный механизм выведения из клетки гидрофобных ксенобиотиков - функционирование Р-гликопротеина (транспортная АТФ-аза). Р-гликопротеин - фосфогликопротеин с молекулярной массой 170 кД, присутствующий в плазматической мембране клеток многих тканей, в частности почек и кишечника. Полипептидная цепь этого белка содержит 1280 аминокислотных остатков, образуя 12 трансмембранных доменов и два АТФ-связывающих центра (рис. 12-15). В норме его функция состоит в экскреции ионов хлора и гидрофобных токсичных соединений из клеток. Когда гидрофобное вещество (например, противоопухолевое лекарство) проникает в клетку, то оно удаляется из неё Р-гликопротеином с затратой энергии (рис. 12-16). Уменьшение количества лекарства в клетке снижает эффективность его применения при химиотерапии онкологических заболеваний. Д. Индукция защитных систем Многие ферменты, участвующие в первой и второй фазе обезвреживания, - индуцируемые белки. Ещё в древности царь Митридат знал, что если сисгематически принимать небольшие дозы яда, можно избежать острого отравления. "Эффект Митридата" основан на индукции определённых защитных систем (табл. 12-3). В мембранах ЭР печени цитохрома Р450 содержится больше (20%), чем других мембрано-связанных ферментов. Лекарственное вещество фенобарбитал активирует синтез цитохрома Р450, УДФ-глюкуронилтрансферазы и эпоксид гидролазы. Например, у животных, которым вводили индуктор фенобарбитал, увеличивается площадь мембран ЭР, которая достигает 90% всех мембранных структур клетки, и, как следствие, - увеличение количества ферментов, участвующих в обезвреживании ксенобиотиков или токсических веществ эндогенного происхождения. При химиотерапии злокачественных процессов начальная эффективность лекарства часто постепенно падает. Более того, развивается множественная лекарственная устойчивость, т.е. устойчивость не только к этому лечебному препарату, но и целому ряду других лекарств. Это происходит потому, что противоопухолевые лекарства индуцируют синтез Р-гликопротеина, глутатионтрансферазы и глутатиона. Использование веществ, ингибирующих или активирующих синтез Р-гликопротеина, а также ферменты синтеза глутатиона, повышает эффективность химиотерапии.
Металлы являются индукторами синтеза глутатиона и низкомолекулярного белка металлотионеина, имеющих SH-группы, способные связывать их. В результате возрастает устойчивость клеток организма к ядам и лекарствам. Повышение количества глутатионтрансфераз увеличивает способность организма приспосабливаться к возрастающему загрязнению внешней среды. Индукцией фермента объясняют отсутствие антиканцерогенного эффекта при применении ряда лекарственных веществ. Кроме того, индукторы синтеза глутатионтрансферазы - нормальные метаболиты - половые гормоны, йодтиронины и кортизол. Катехол-амины через аденилатциклазную систему фосфорилируют глутатионтрансферазу и повышают её активность. Ряд веществ, в том числе и лекарств (например, тяжёлые металлы, полифенолы, S-алкилы глутатиона, некоторые гербициды), ингибируют глутатионтрансферазу.
37. Конъюгация - вторая фаза обезвреживание веществ Вторая фаза обезвреживания веществ - реакции конъюгации, в ходе которых происходит присоединение к функциональным группам, образующимся на первом этапе, других молекул или групп эндогенного происхождения, увеличивающих гидрофильность и умеНbшающих токсичность ксенобиотиков (табл. 12-2). Участие трансферам в реакциях конъюгации Все ферменты, функционирующие во второй фазе обезвреживания ксенобиотиков, относят к классу трансфераз. Они характеризуются широкой субстратной специфичностью. УДФ-глюкуронилтрансферазы Локализированные в основном в ЭР уридин-дифосфат (УДФ)-глюкуронилтрансферазы присоединяют остаток глюкуроновой кислоты к молекуле вещества, образованного в ходе мик-росомального окисления (рис. 12-4). В общем виде реакция с участием УДФ-глюкуронилтрансферазы записывается так: ROH + УДФ-С6Н9О6 = RO-C6H9O6 + УДФ. Сульфотрансферазы Цитоплазматические cульфотрансферазы катализируют реакцию конъюгации, в ходе которой остаток серной кислоты (-SO3H) от 3'-фосфоаденозин-5'-фосфосульфата (ФАФС) присоединяется к фенолам, спиртам или аминокислотам (рис. 12-5).
Рис. 12-4. Уридиндифосфоглюкуроновая кислота (УДФ-C6H9O6). Реакция с участием сульфотрансферазы в общем виде записывается так: ROH + ФАФ-SO3H = RO-SO3H + ФАФ. Ферменты сульфотрансферазы и УДФ-глюкуронилтрансферазы участвуют в обезвреживании ксенобиотиков, инактивации лекарств и эндогенных биологически активных соединений.
Глутатионтрансферазы Особое место среди ферментов, участвующих в обезвреживании ксенобиотиков, инактивации нормальных метаболитов, лекарств, занимают глутатионтрансферазы (ГТ). Глутатионтрансферазы функционируют во всех тканях и играют важную роль в инактивации собственных метаболитов: некоторых стероидных гормонов, простагландинов, билирубина, жёлчных кислот, продуктов ПОЛ. Известно множество изоформ ГТ с различной субстратной специфичностью. В клетке ГТ в основном локализованы в цитозоле, но имеются варианты ферментов в ядре и митохондриях. Для работы ГТ требуется глутатион (GSH) (рис. 12-6). Глутатион - трипептид Глу-Цис-Гли (остаток глутаминовой кислоты присоединён к цис-теину карбоксильной группой радикала). ГТ обладают широкой специфичностью к субстратам, общее количество которых превышает 3000. ГТ связывают очень многие гидрофобные вещества и инактивируют их, но химической модификации с участием глугатиона подвергаются только те, которые имеют полярную группу. То есть субстратами служат вещества, которые, с одной стороны, имеют электрофильный центр (например, ОН-группу), а с другой стороны - гидрофобные зоны. Обезвреживание, т.е. химическая модификация ксенобиотиков с участием ГТ, может осуществляться тремя различными способами:
R + GSH → GSRH,
RX + GSH → GSR + НХ,
R-HC-O-OH + 2 GSH → R-HC-OH + GSSG + H2O
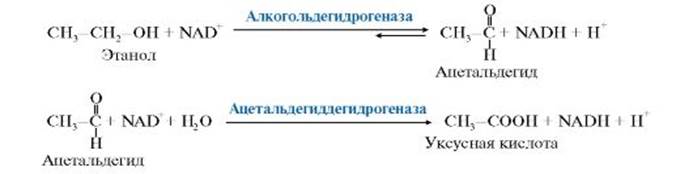
Рис. 12-6. Глутатион (GSH). Сисгема обезвреживания с участием ГТ и глутатиона играет уникальную роль в формировании резистентности организма к самым различным воздействиям и является наиболее важным защитным механизмом клетки. В ходе биотрансформации некоторых ксенобиотиков под действием ГТ образуются тиоэфиры (конъюгаты RSG), которые затем превращаются в меркаптаны, среди которых обнаружены токсические продукты. Но конъюгаты GSH с большинством ксенобиотиков менее реакционно-способны и более гидрофильны, чем исходные вещества, а поэтому менее токсичны и легче выводятся из организма (рис. 12-7). ГТ своими гидрофобными центрами могут не-ковалентно связывать огромное количество ли-пофильных соединений (физическое обезвреживание), предотвращая их внедрение в липидный слой мембран и нарушение функций клетки. Поэтому ГТ иногда называют внутриклеточным альбумином. 41. МЕТАБОЛИЗМ И ОБЕЗВРЕЖИВАНИЕ ЭТАНОЛА Этанол может синтезироваться в организме человека или поступает с пищей. Эндогенный этиловый спирт содержится в крови в концентрации 0,0004 до 0,001 г/л. Источниками этанола являются: • превращение глюкозы: Глюкоза Пируват →Ацетальдегид →Этанол; • спиртовое брожение углеводов микрофлорой кишечника и дыхательных путей. Источником экзогенного этанола для человека служат спиртные напитки и даже некоторые пищевые продукты (соки, кефир, хлеб). Экзогенный этанол быстро всасывается в желудке (20-30%) и в тонком кишечнике (70-80%), достигая через 30-60 минут максимальной концентрации в крови. Метаболизм (окисление) этанола начинается уже в слизистой оболочке рта и продолжается во многих органах, но главным образом в печени (до 70-95% окисляемого этанола).
Возможные реакции окисления этанола и ацетальдегида представлены ниже. При малых и умеренных дозах этанол окисляется с участием NAD-зави- симых ферментов (рис. 12.9).
|
|||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 465; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.50.94 (0.011 с.) |