
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 3. Основные законы химииСодержание книги
Поиск на нашем сайте
Закон сохранения массы Химические процессы подчиняются всеобщим законам природы — закону сохранения массы вещества и закону сохранения энергии, а также ряду специфических для химии законов, которыми управляются все химические реакции. Закон сохранения массывещества установили М.В. Ломоносов (1756 г.) и А.Л. Лавуазье (1789 г.) почти независимо друг от друга. Они далеко продвинули развитие химии тем, что при химических реакциях применили физические методы, в частности, взвешивание. Закон сохранения массы в химических процессах можно сформулировать так: масса веществ,вступающих в химическую реакцию,равна массе веществ, образующихся в результате реакции.Например, при разложении воды масса воды будет равна сумме массы водорода и массы кислорода. Из закона сохранения вещества вытекает, что вещество нельзя ни создать из ничего, ни уничтожить совсем. Количественным выражением закона сохранения массы веществ применительно к производственному химическому процессу является материальный баланс, в котором подтверждается, что масса веществ, поступивших на технологическую операцию (приход), равна массе полученных веществ (расход):
где- соответственно массы твердых, жидких и газоооразных Закон сохранения массы веществ М.В. Ломоносов связывал с законом сохранения энергии. Он рассматривал эти законы в единстве. Взгляды Ломоносова подтверждены современной наукой.
Закон сохранения энергии Закон сохранения энергии действует во всех случаях и повсюду, где одна форма энергии переходит в другую. Например, при переходе энергии пара в турбине в энергию вращательного движения, т. е. механическую энергию, при переходе электрической энергии в электрической лампочке в световую и т. д. Так же как нельзя ни уничтожить, ни создать вещество, нельзя ни создать, ни уничтожить энергию. Особым видом энергии является химическая энергия, которая освобождается или расходуется при каждой химической реакции. Химическую энергию, как любой вид энергии, можно превратить в механическую (использование взрывчатых веществ), тепловую (сжигание топлива), электрическую (гальванические элементы) и т. п. Измерить химическую энергию непосредственно нельзя. Ее величина определяется, как и величина тепловой энергии, в килоджоулях (в кДж).
Различают химические реакции с выделением тепла и химические реакции с поглощением тепла. Первые называются экзотермическими, вторые — эндотермическими реакциями. Изучением тепловых явлений при химических реакциях занимается термохимия. Количественным выражением закона сохранения энергии в химическом производстве является тепловой (энергетический) баланс. Применительно к тепловым процессам химической переработки закон сохранения энергии формулируется так: количество тепловой энергии, принесенной в зону взаимодействия веществ, равно количеству энергии, вынесенной веществами из этой зоны. Пример равенства прихода и расхода теплоты можно выразить уравнением: где Q ф — физическая теплота, введенная в процесс с исходными веществами; Qэ — теплота экзотермических реакций; Qв — теплота, введенная в процесс извне; Q'ф — физическая теплота, выведенная из процесса с продуктами реакции; Q'п — потери теплоты в окружающую среду.[10]
Специфические законы химии К специфическим законам химии относятся такие законы, как закон постоянства состава (Ж. Пруст, 1808 г.), закон постоянных весовых отношений (Дж. Дальтон, 1800 г.), закон простых объемных отношений для газов (Ж.Л. Гей-Люссак, 1808 г.) и в качестве его развития — закон А. Авогадро (1811 г.). Данными законами руководствуются ученые-химики и практики для проведения химических расчетов. Глава 4. Химия в современном мире Эволюция химических систем Под эволюцией химической системы понимают самопроизвольный синтез новых химических соединений, являющихся более сложными и более высокоорганизованными продуктами по сравнению с исходными веществами. Химики сегодня пришли к выводу, что, используя те же принципы, на которых построена химия организмов, в будущем можно будет построить принципиально новую химию, новое управление химическими процессами, где начнут применять принципы синтеза себе подобных молекул. По принципу ферментов будут созданы катализаторы такой степени специфичности, что далеко превзойдут существующие в нашей промышленности. Хотя химия в настоящее время еще далека от решения этих проблем, но намечены следующие пути решения этой задачи:
1. Развитие исследований в области металлокомплексного катализа с постоянной ориентацией на соответствующие объекты живой природы. Сегодня металлокомплексный катализ постепенно обогащается такими приемами, которыми пользуются живые организмы в ферментативных реакциях, а также приемами классического гетерогенного катализа. 2. Освоение каталитического опыта живой природы, заключающегося в определенных успехах моделирования биокатализаторов. Для решения проблемы освоения каталитического опыта живой природы необходимо изучение законов химической эволюции и происхождения жизни. 3. Использование достижений иммобилизованных систем. Сущность иммобилизации состоит в закреплении выделенных из живого организма ферментов на твердой поверхности путем адсорбции, которая превращает последние в гетерогенный катализатор и обеспечивает его стабильность и непрерывное действие, т. е. осуществляется биоорганический катализ. 4. Развитие исследований, ориентированных на применение принципов биокатализа в химии и химической технологии. Характеризуется изучением и освоением всего каталитического опыта живой природы, в том числе и опыта формирования самого фермента, клетки и даже организма, т. е. это пролог к принципиально новой химической технологии, способной стать аналогом живых систем.
Перспективы химии Успехи химии экстремальных состояний, каталитической химии, в областях металлокомплексного катализа, моделирования биокатализаторов, химии и технологии иммобилизированных систем, "нестационарной технологии", важным звеном которой должна стать теория саморазвития открытых каталитических систем, позволяют видеть в ближайшей перспективе богатейшие возможности развития новой химии. Эта новая химия уже теперь становится способной решать такие задачи, для реализации которых до сих пор еще не было предпосылок.[11] В частности, в области тяжелого органического синтеза это задачи: а) значительного ускорения химических превращений в мягких условиях за счет объединения в катализаторах будущего достоинств гетерогенного, гомогенного и металлоэнзимного катализа; б) достижение близкой к 100% селективности процессов; в) осуществление новых важных энергетически затрудненных г) существенной экономии углеводородного сырья и перехода от Химия теперь имеет реальные предпосылки и для решения а) моделирование и интенсификация фотосинтеза; б) фотолиз воды с получением водорода как самого высокоэффективного топлива; в) промышленный синтезширокого спектра органических продуктов, и в первую очередьметанола, этанола, формальдегида и муравьиной кислоты, на г) промышленный синтез многочисленных фторматериалов. Все это является залогом успешного претворения в жизнь задач по созданию малоотходных, безотходных и энергосберегающих промышленных процессов, рачительного использования каждого килограмма сырья и каждого киловатта энергии для производства необходимых материалов.
Заключение В заключение можно сказать, что роль развития химии как науки, в развитии естественнонаучных знаний – это одна из ключевых ролей. Химия занимает немаловажную роль в истории формирования общей естественнонаучной картине мира. Стоит заметить, что практическая сторона развития химии людям всегда была более интересна, чем методологическая. Развитие химической науки, физики и биологии, оказывало влияние на формирование естественнонаучных и мировоззренческих знаний. Также можно сказать, что вопросы химии не являются вопросами, без решения которых эта наука может быстро и успешно развиваться. Эти вопросы, так или иначе, выступают как одна из составных частей и в разработке конкретных научных проблем современной химии, прежде всего ее больших теоретических проблем, и в повседневной деятельности химика по добыванию новых знаний о веществе, по преобразованию веществ природы в жизненно нужные людям материальные блага.
|
|||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 112; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.155.20 (0.008 с.) |


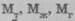 материалов, поступивших на обработку (приход материалов);
материалов, поступивших на обработку (приход материалов); 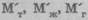 — массы продуктов, получившихся в результате химической переработки (расход материалов).[9]
— массы продуктов, получившихся в результате химической переработки (расход материалов).[9]



