
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 1. Предмет химии. Ее этапы развитияСодержание книги
Поиск на нашем сайте
Санкт- Петербург Оглавление Введение….....................................................................................................3 Глава 1. Предмет химии. Ее этапы развития ……………………………...4 1.1 Химия как наука ……………………………………………………….4 1.2 Период алхимии с древности до XVI в. н. э.…………………………5 1.3 Возникновение и развитие научной химии…………………………..7 1.4 Революция в химии…………………………………………………….9 1.5 Победа атомно-молекулярного учения………………………………11 Глава 2. Место химии в природе …………………………………………13 2.1 Химия в системе «общество-природа» ……………….......................13 Глава 3. Основные законы химии ………………........................................18 3.1 Закон сохранения массы……………………………………………….18 3.2 Закон сохранения энергии……………………………………………..19 3.3 Специфические законы химии………………………………………...20 Глава 4. Химия в современном мире ……………………………………...21 4.1 Эволюция химической системы……………………………………….21 4.2 Перспектива химии……………………………………………………..22 Заключение………………………………………………………………….24 Список использованной литературы………………………………………25 Введение Современное естествознание – это процесс очень сложный, включающий рассмотрение естественных наук. На мой взгляд, одной из важнейших таких систем естествознания является химическая наука. Современная химия развивается стремительными темпами, плотно сотрудничая с физикой, математикой, биологией и другими науками. Необходимость в получении химических – это потребность человека получить необходимые вещества, объяснить их взаимодействие веществ для своей жизнедеятельности. Химия как система знания о веществах и их превращениях. Это знание содержится в запасе фактов - надежно установленных и проверенных сведений о химических элементах и соединениях, их реакциях и поведении в природных и искусственных средах. Современные достижения ученых в химии, как в ее практической деятельности, так и в теоретических суждениях вносят большой вклад в общее мировоззрение, в развитие естественнонаучных знаний, которые, в свою очередь, существенно отражаются на состоянии взаимодействия общества с природой. Открываемые химией знания об окружающей нас среде, о вещах и превращениях веществ, являются основой для формирования миропонимания человека, развития общих представлений о мире, и о самой природе человека, а также его деятельности. Природа химических знаний, пути и средства формирования химии в историческом развитии, основные химические законы и перспективы химического развития - вот то, с чего в можно начать изучение влияния химии на формирование современного естествознания. Глава 1. Предмет химии. Ее этапы развития Химия как наука Химия – это естественная наука, изучающая состав, свойства и химические превращения веществ, явления, которые сопровождают эти превращения, а также рассматривает вопросы использования результатов этих превращений. Самое краткое определение предмета химии дал великий русский учёный-химик Д.И. Менделеев в книге «Основы химии». По Менделееву, химия – это учение об элементах и их соединениях.[1] Химия как самостоятельная дисциплина определилась в XVI—XVII веках, после ряда научных открытий, обосновавших механистическую картину мира, развития промышленности, создания фабрик, появления буржуазного общества. Однако из-за того, что химия, в отличие от физики, не могла быть выражена количественно, существовали споры, является ли химия количественной воспроизводимой наукой или это некий иной вид познания. В 1661 году Роберт Бойль создал труд «Химик-скептик», в котором объяснил разность свойств различных веществ тем, что они построены из разных частиц (корпускул), которые и отвечают за свойства вещества. Ван Гельмонт, изучая горение, ввёл понятие газ для вещества, которое образуется при нём, открыл углекислый газ. В 1672 году Бойль открыл, что при обжиге металлов их масса увеличивается, и объяснил это захватом «весомых частиц пламени». М. В. Ломоносов уже в первой известной своей работе, именно к данной области естествознания отношение имеющей — «Элементы математической химии» (1741), в отличие от большинства химиков своего времени, считавших эту сферу деятельности искусством, классифицирует её как науку. По его мнению, химия — наука об изменениях, происходящих в смешанном теле, поскольку оно смешанное....Не сомневаюсь, что найдутся многие, которым это определение покажется неполным, будут сетовать на отсутствие начал разделения, соединения, очищения и других выражений, которыми наполнены почти все химические книги; но те, кто проницательнее, легко усмотрят, что упомянутые выражения, которыми весьма многие писатели по химии имеют обыкновение обременять без надобности свои исследования, могут быть охвачены одним словом: смешанное тело. В самом деле, обладающий знанием смешанного тела может объяснить все возможные изменения его, и в том числе разделение, соединение и т. д.
Революция в химии Центральная проблема химии XVIII в. — проблема горения. Вопрос состоял в следующем: что случается с горючими веществами, когда они сгорают в воздухе? Для объяснения процессов горения немецкими химиками И. Бехером и его учеником Г. Э. Шталем была предложена теория флогистона (1697—1703). Флогистон — это некоторая невесомая субстанция, которую содержат все горючие тела и которую они утрачивают при горении. Тела, содержащие большое количество флогистона, горят хорошо; тела, которые не загораются, являются дефлогистированными. Эта теория позволяла объяснять многие химические процессы и предсказывать новые химические явления. В течение почти всего XVIII в. она прочно удерживала свои позиции, пока французский химик А. Л. Лавуазье в конце XVIII в. (опираясь на открытия К.В. Шееле сложного состава воздуха и Дж. Пристли кислорода, 1774) не разработал кислородную теорию горения.[5] Лавуазье показал, что все явления в химии, прежде считавшиеся хаотическими, могут быть систематизированы и сведены в закон сочетания элементов, старых и новых. К уже установленному до него списку элементов (металлы, углерод, сера и фосфор) он добавил новые — кислород, который вместе с водородом входит в состав воды, а также и другой компонент воздуха — азот. В соответствии с новой системой химические соединения делились в основном на три категории: кислоты, основания, соли. Лавуазье рационализировал химию и объяснил причину большого разнообразия химических явлений: она заключается в различии химических элементов и их соединений. Лавуазье раз и навсегда покончил со старой алхимической номенклатурой, основанной на случайных ассоциациях — «винное масло», «винный камень», «свинцовый сахар» и др. Он ввел (при активном участии К.Л. Бертолле) новую номенклатуру, которая исходила из того, что каждое химическое вещество должно иметь одно определенное название, характеризующее его функции и состав. Например, оксид калия состоит из калия и кислорода, хлорид натрия — из натрия и хлора, сульфид водорода — из водорода и серы, и т.д. Кроме того, Лавуазье поставил вопрос и о количествах, в которых сочетаются различные элементы между собой, и с помощью закона сохранения материи привел химию к представлению о необходимости количественного выражения пропорций, в которых сочетались элементы. С помощью ряда великолепно задуманных и проведенных экспериментов Лавуазье смог также показать, что живой организм действует точно таким же образом, как и огонь, сжигая содержащиеся в пище вещества и высвобождая энергию в виде теплоты. Лавуазье осуществил научную революцию в химии: он превратил химию из совокупности множества не связанных друг с другом рецептов, подлежавших изучению один за одним, в общую теорию, основываясь на которой можно было не только объяснять все известные явления, но и предсказывать новые.
Глава 2. Место химии в природе Глава 3. Основные законы химии Закон сохранения массы Химические процессы подчиняются всеобщим законам природы — закону сохранения массы вещества и закону сохранения энергии, а также ряду специфических для химии законов, которыми управляются все химические реакции. Закон сохранения массывещества установили М.В. Ломоносов (1756 г.) и А.Л. Лавуазье (1789 г.) почти независимо друг от друга. Они далеко продвинули развитие химии тем, что при химических реакциях применили физические методы, в частности, взвешивание. Закон сохранения массы в химических процессах можно сформулировать так: масса веществ,вступающих в химическую реакцию,равна массе веществ, образующихся в результате реакции.Например, при разложении воды масса воды будет равна сумме массы водорода и массы кислорода. Из закона сохранения вещества вытекает, что вещество нельзя ни создать из ничего, ни уничтожить совсем. Количественным выражением закона сохранения массы веществ применительно к производственному химическому процессу является материальный баланс, в котором подтверждается, что масса веществ, поступивших на технологическую операцию (приход), равна массе полученных веществ (расход):
где- соответственно массы твердых, жидких и газоооразных Закон сохранения массы веществ М.В. Ломоносов связывал с законом сохранения энергии. Он рассматривал эти законы в единстве. Взгляды Ломоносова подтверждены современной наукой.
Закон сохранения энергии Закон сохранения энергии действует во всех случаях и повсюду, где одна форма энергии переходит в другую. Например, при переходе энергии пара в турбине в энергию вращательного движения, т. е. механическую энергию, при переходе электрической энергии в электрической лампочке в световую и т. д. Так же как нельзя ни уничтожить, ни создать вещество, нельзя ни создать, ни уничтожить энергию. Особым видом энергии является химическая энергия, которая освобождается или расходуется при каждой химической реакции. Химическую энергию, как любой вид энергии, можно превратить в механическую (использование взрывчатых веществ), тепловую (сжигание топлива), электрическую (гальванические элементы) и т. п. Измерить химическую энергию непосредственно нельзя. Ее величина определяется, как и величина тепловой энергии, в килоджоулях (в кДж). Различают химические реакции с выделением тепла и химические реакции с поглощением тепла. Первые называются экзотермическими, вторые — эндотермическими реакциями. Изучением тепловых явлений при химических реакциях занимается термохимия. Количественным выражением закона сохранения энергии в химическом производстве является тепловой (энергетический) баланс. Применительно к тепловым процессам химической переработки закон сохранения энергии формулируется так: количество тепловой энергии, принесенной в зону взаимодействия веществ, равно количеству энергии, вынесенной веществами из этой зоны. Пример равенства прихода и расхода теплоты можно выразить уравнением: где Q ф — физическая теплота, введенная в процесс с исходными веществами; Qэ — теплота экзотермических реакций; Qв — теплота, введенная в процесс извне; Q'ф — физическая теплота, выведенная из процесса с продуктами реакции; Q'п — потери теплоты в окружающую среду.[10]
Специфические законы химии К специфическим законам химии относятся такие законы, как закон постоянства состава (Ж. Пруст, 1808 г.), закон постоянных весовых отношений (Дж. Дальтон, 1800 г.), закон простых объемных отношений для газов (Ж.Л. Гей-Люссак, 1808 г.) и в качестве его развития — закон А. Авогадро (1811 г.). Данными законами руководствуются ученые-химики и практики для проведения химических расчетов. Эволюция химических систем Под эволюцией химической системы понимают самопроизвольный синтез новых химических соединений, являющихся более сложными и более высокоорганизованными продуктами по сравнению с исходными веществами. Химики сегодня пришли к выводу, что, используя те же принципы, на которых построена химия организмов, в будущем можно будет построить принципиально новую химию, новое управление химическими процессами, где начнут применять принципы синтеза себе подобных молекул. По принципу ферментов будут созданы катализаторы такой степени специфичности, что далеко превзойдут существующие в нашей промышленности. Хотя химия в настоящее время еще далека от решения этих проблем, но намечены следующие пути решения этой задачи: 1. Развитие исследований в области металлокомплексного катализа с постоянной ориентацией на соответствующие объекты живой природы. Сегодня металлокомплексный катализ постепенно обогащается такими приемами, которыми пользуются живые организмы в ферментативных реакциях, а также приемами классического гетерогенного катализа. 2. Освоение каталитического опыта живой природы, заключающегося в определенных успехах моделирования биокатализаторов. Для решения проблемы освоения каталитического опыта живой природы необходимо изучение законов химической эволюции и происхождения жизни. 3. Использование достижений иммобилизованных систем. Сущность иммобилизации состоит в закреплении выделенных из живого организма ферментов на твердой поверхности путем адсорбции, которая превращает последние в гетерогенный катализатор и обеспечивает его стабильность и непрерывное действие, т. е. осуществляется биоорганический катализ. 4. Развитие исследований, ориентированных на применение принципов биокатализа в химии и химической технологии. Характеризуется изучением и освоением всего каталитического опыта живой природы, в том числе и опыта формирования самого фермента, клетки и даже организма, т. е. это пролог к принципиально новой химической технологии, способной стать аналогом живых систем.
Перспективы химии Успехи химии экстремальных состояний, каталитической химии, в областях металлокомплексного катализа, моделирования биокатализаторов, химии и технологии иммобилизированных систем, "нестационарной технологии", важным звеном которой должна стать теория саморазвития открытых каталитических систем, позволяют видеть в ближайшей перспективе богатейшие возможности развития новой химии. Эта новая химия уже теперь становится способной решать такие задачи, для реализации которых до сих пор еще не было предпосылок.[11] В частности, в области тяжелого органического синтеза это задачи: а) значительного ускорения химических превращений в мягких условиях за счет объединения в катализаторах будущего достоинств гетерогенного, гомогенного и металлоэнзимного катализа; б) достижение близкой к 100% селективности процессов; в) осуществление новых важных энергетически затрудненных г) существенной экономии углеводородного сырья и перехода от Химия теперь имеет реальные предпосылки и для решения а) моделирование и интенсификация фотосинтеза; б) фотолиз воды с получением водорода как самого высокоэффективного топлива; в) промышленный синтезширокого спектра органических продуктов, и в первую очередьметанола, этанола, формальдегида и муравьиной кислоты, на г) промышленный синтез многочисленных фторматериалов. Все это является залогом успешного претворения в жизнь задач по созданию малоотходных, безотходных и энергосберегающих промышленных процессов, рачительного использования каждого килограмма сырья и каждого киловатта энергии для производства необходимых материалов.
Заключение В заключение можно сказать, что роль развития химии как науки, в развитии естественнонаучных знаний – это одна из ключевых ролей. Химия занимает немаловажную роль в истории формирования общей естественнонаучной картине мира. Стоит заметить, что практическая сторона развития химии людям всегда была более интересна, чем методологическая. Развитие химической науки, физики и биологии, оказывало влияние на формирование естественнонаучных и мировоззренческих знаний. Также можно сказать, что вопросы химии не являются вопросами, без решения которых эта наука может быстро и успешно развиваться. Эти вопросы, так или иначе, выступают как одна из составных частей и в разработке конкретных научных проблем современной химии, прежде всего ее больших теоретических проблем, и в повседневной деятельности химика по добыванию новых знаний о веществе, по преобразованию веществ природы в жизненно нужные людям материальные блага. Санкт- Петербург Оглавление Введение….....................................................................................................3 Глава 1. Предмет химии. Ее этапы развития ……………………………...4 1.1 Химия как наука ……………………………………………………….4 1.2 Период алхимии с древности до XVI в. н. э.…………………………5 1.3 Возникновение и развитие научной химии…………………………..7 1.4 Революция в химии…………………………………………………….9 1.5 Победа атомно-молекулярного учения………………………………11 Глава 2. Место химии в природе …………………………………………13 2.1 Химия в системе «общество-природа» ……………….......................13 Глава 3. Основные законы химии ………………........................................18 3.1 Закон сохранения массы……………………………………………….18 3.2 Закон сохранения энергии……………………………………………..19 3.3 Специфические законы химии………………………………………...20 Глава 4. Химия в современном мире ……………………………………...21 4.1 Эволюция химической системы……………………………………….21 4.2 Перспектива химии……………………………………………………..22 Заключение………………………………………………………………….24 Список использованной литературы………………………………………25 Введение Современное естествознание – это процесс очень сложный, включающий рассмотрение естественных наук. На мой взгляд, одной из важнейших таких систем естествознания является химическая наука. Современная химия развивается стремительными темпами, плотно сотрудничая с физикой, математикой, биологией и другими науками. Необходимость в получении химических – это потребность человека получить необходимые вещества, объяснить их взаимодействие веществ для своей жизнедеятельности. Химия как система знания о веществах и их превращениях. Это знание содержится в запасе фактов - надежно установленных и проверенных сведений о химических элементах и соединениях, их реакциях и поведении в природных и искусственных средах. Современные достижения ученых в химии, как в ее практической деятельности, так и в теоретических суждениях вносят большой вклад в общее мировоззрение, в развитие естественнонаучных знаний, которые, в свою очередь, существенно отражаются на состоянии взаимодействия общества с природой. Открываемые химией знания об окружающей нас среде, о вещах и превращениях веществ, являются основой для формирования миропонимания человека, развития общих представлений о мире, и о самой природе человека, а также его деятельности. Природа химических знаний, пути и средства формирования химии в историческом развитии, основные химические законы и перспективы химического развития - вот то, с чего в можно начать изучение влияния химии на формирование современного естествознания. Глава 1. Предмет химии. Ее этапы развития Химия как наука Химия – это естественная наука, изучающая состав, свойства и химические превращения веществ, явления, которые сопровождают эти превращения, а также рассматривает вопросы использования результатов этих превращений. Самое краткое определение предмета химии дал великий русский учёный-химик Д.И. Менделеев в книге «Основы химии». По Менделееву, химия – это учение об элементах и их соединениях.[1] Химия как самостоятельная дисциплина определилась в XVI—XVII веках, после ряда научных открытий, обосновавших механистическую картину мира, развития промышленности, создания фабрик, появления буржуазного общества. Однако из-за того, что химия, в отличие от физики, не могла быть выражена количественно, существовали споры, является ли химия количественной воспроизводимой наукой или это некий иной вид познания. В 1661 году Роберт Бойль создал труд «Химик-скептик», в котором объяснил разность свойств различных веществ тем, что они построены из разных частиц (корпускул), которые и отвечают за свойства вещества. Ван Гельмонт, изучая горение, ввёл понятие газ для вещества, которое образуется при нём, открыл углекислый газ. В 1672 году Бойль открыл, что при обжиге металлов их масса увеличивается, и объяснил это захватом «весомых частиц пламени». М. В. Ломоносов уже в первой известной своей работе, именно к данной области естествознания отношение имеющей — «Элементы математической химии» (1741), в отличие от большинства химиков своего времени, считавших эту сферу деятельности искусством, классифицирует её как науку. По его мнению, химия — наука об изменениях, происходящих в смешанном теле, поскольку оно смешанное....Не сомневаюсь, что найдутся многие, которым это определение покажется неполным, будут сетовать на отсутствие начал разделения, соединения, очищения и других выражений, которыми наполнены почти все химические книги; но те, кто проницательнее, легко усмотрят, что упомянутые выражения, которыми весьма многие писатели по химии имеют обыкновение обременять без надобности свои исследования, могут быть охвачены одним словом: смешанное тело. В самом деле, обладающий знанием смешанного тела может объяснить все возможные изменения его, и в том числе разделение, соединение и т. д.
|
||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 89; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.63.214 (0.009 с.) |


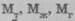 материалов, поступивших на обработку (приход материалов);
материалов, поступивших на обработку (приход материалов); 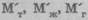 — массы продуктов, получившихся в результате химической переработки (расход материалов).[9]
— массы продуктов, получившихся в результате химической переработки (расход материалов).[9]



