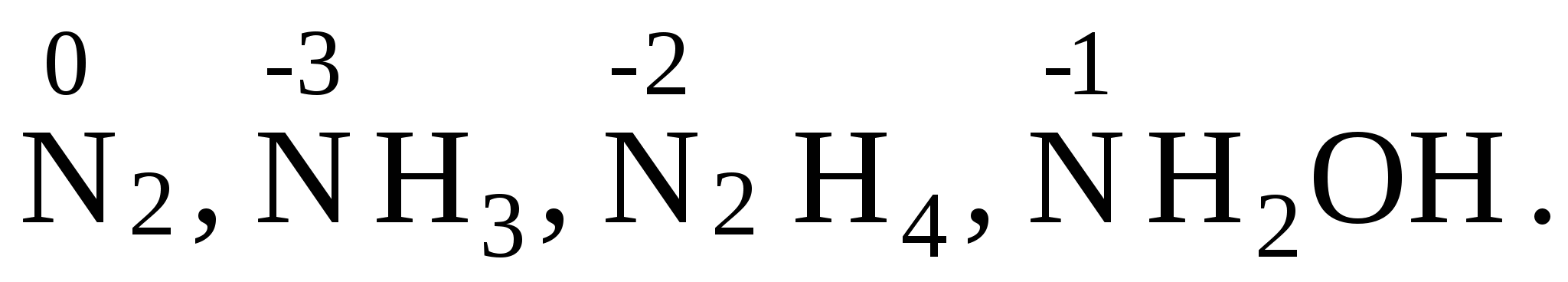Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакция полимеризации заданного алкадиена, озонолиза полимера и гидролиза озонида.Содержание книги
Поиск на нашем сайте
32.Укажите порядок окисления анионов при электролизе водного раствора.Приведите примеры. Порядок окисления анионов на аноде: 1.Первыми будут окисляться бескислородные анионы: S2-; I-; Br-; Cl- и анионы органических кислот: 2RCOO- - 2e → 2CO2 + R – R. 2. Во вторую очередь разряжается гидроксид – ион (в щелочной среде): 4OH- - 4e → O2 + 2H2O, или вода (в кислотной или нейтральной средах).(см. окисляться водаться катионы медио из раствора сульфата медм на катод акций и показывает Процесс окисление воды на аноде: A (+) 2 H2O - 4е → O2º↑+ 4H+(окисляется) 3. В растворе не разряжаются анионы кислородсодержащих кислотных остатков и F-. Рассмотрим электролиз раствора сульфата меди (II) CuSO4(раствор)↔Cu2++SO42- K(-) Cu2++ 2е → Cuº(восстанавливается) │4│2 A (+) 2H2O - 2е →O2º↑+ 4H+(окисляется) │2│1 2Cu2+ + 2H2O → 2Cuº + O2º↑+ 4H+ +SO42- +SO42- Суммарное уравнение электролиза раствора сульфата меди (II): 2CuSO4 + 2H2O на катоде на аноде в электролизёре KI (раствор) → K+ + I- К (+) 2H2O + 2e → H20 + 2OH- | 2| 1 A (-) 2I- - 2e → I20 | 2| 1 2H2O + 2I- → H20 + 2OH- + I20 Суммарное уравнение электролиза раствора 2KI + 2H2O → H20+ I20 + 2KOH Электролиз – это окислительно – восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через раствор или расплав электролита. На катоде будет происходить электрохимическое восстановление катионов или молекул воды, а на аноде электрохимическое окисление анионов или молекул воды. Простейшим примером электролиза является электролиз расплава. Под действием электрического поля катионы Na+ движутся к катоду и принимают от него электроны. Na+ +e = Na0- процесс восстановления. Анионы Cl – движутся к аноду и отдают электроны: 2Cl - - 2e = Cl20- процесс окисления. Суммарная реакция: 2NaCl ====2Na + Cl2 На катоде выделяется металлический натрий, а на аноде – газообразный хлор. А теперь разберем пример электролиза раствора хлорида натрия. NaCl → Na+ + Cl – K(-) Na+ 2H2O -2e→ 2OH – + H2↑ A(+) 2Cl – - 2e→ Cl20 H2O 2H2O + 2Cl –→2OH – + H2 + Cl2 2Na+ + 2H2O + 2Cl –→2OH + H2 + Cl20 + 2Na+ 2 NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
Сульфат меди в растворе диссоциирует ни ионы Си2+ и S042'. CuS04 = Cu2+ + S042" Cu2++2e- = Cu 12 2H20-4e- = 4H+ + 02 |1 2Cu2+ + 2H2O = 2Cu + 4H+ + O2 (краткоеионное уравнение): 2Си2+ + 2S042" + 2Н20 = 2Cu + 4Н+ + 2SO42' + О2 в молекулярном виде: 2CuSO4 + 2H2O = 2Cu + 2H2SO4 + О2 Газ, выделяющийся на аноде - кислород. В растворе образуется серная кислота.Молярная масса меди равна 64 г/моль, вычислим количество вещества меди:По уравнению реакции при выделении на катоде 2 моль меди ла аноде выделяется 1 моль кислорода. На катоде выделилось 0,75 моль меди, пусть на аноде выделилось х моль кислорода. Составим пропорцию: 2/1=0,75/x, x=0,75*1/2=0,375моль На аноде выделилось 0,375 моль кислорода, v(O2) = 0,375 моль. V(O2) = v(O2)«VM = 0,375 моль«22,4 л/моль = 8,4 л По уравнению реакции при выделении на катоде 2 моль меди в растворе образуется 2 моль серной кислоты, значит, если на катоде выделилось 0,75 моль меди, то в растворе образовалось 0,75 моль серной кислоты, v(H2SO4) = 0,75 моль. Вычислим молярную массу серной кислоты: M(H2SO4) = 2-1+32+16-4 = 98 г/моль. Вычислим массу серной кислоты:m(H2S04) = v(H2S04>M(H2S04) = = 0,75 моль«98 г/моль = 73,5 г Зависимость количества вещества, образовавшегося при электролизе, от времени и силы тока описывается обобщенным законом Фарадея: m = (Э / F) • I • t = (М / (n • F)) • I • t, m масса образовавшегося при электролизе вещества (г);Э эквивалентная масса вещества (г/моль); 31. По заданным полуреакциям окисления и восстановления напишите уравнение реакции в молекулярном виде. Окислительно-восстановительная: Взаимодействия сульфата калия и перманганата калия в щелочной среде:
Определяем степени окисления элементов, изменяющих степень окисления (Mn+7 → Mn+6, S+4 → S+6). Реальные ионы, куда входят данные элементы ( 2 1 Суммарное уравнение:
В суммарном ионном уравнении есть соответствие среды. Переносим коэффициенты в молекулярное уравнение:
1. Правила. Степень окисления атомов в простых веществах равна нулю: 2. Степень окисления (+1) во всех соединениях имеют щелочные металлы (IA группа) и водород, за исключением гидридов активных металлов, где степень окисления водорода равна (–1), например 3. Степень окисления +2 во всех соединениях имеют щелочноземельные металлы (IIAгруппа).
4. Кислород имеет степень окисления (–2), во всех соединениях, кроме пероксидов ( 5. Алгебраическая сумма степеней окисления всех частиц в молекуле равна нулю, а в ионе – заряду иона → +1–1 = 0, 6. Степень окисления иона элемента равна заряду иона: 7. Не следует путать понятия «валентность» и «степень окисления». Так в N2, NH3, N2H4, NH2OH валентность (ковалентность) азота равна трем, так как азот образует три ковалентные связи, а степень окисления различна: H2SO4(конц.) + HJ → H2S + J2 + H2O Прежде всего, установим, что степень окисления йода в йодистом водороде равна (-1), а серы в серной кислоте: (+6). В процессе реакции йод (-1) будет окисляться до молекулярного состояния, а сера (+6) восстанавливаться до степени окисления (-2) – сероводорода: J-→ J02 Чтобы составить уравнение электронного баланса необходимо учесть, что количество частиц атомов в левой и в правой частях полуреакций должно быть одинаковой 2J-→ J20 Далее необходимо определить количество электронов, принявших участие в реакции: 2J- - 2 e → J02 Установив вертикальную черту, справа данной схемы полуреакции, определим коэффициенты реакции: 2J- - 2 e → J02 |8 Сократив на «2», получим окончательные значения коэффициентов: 2J- - 2 e → J02 |4 Подведем под данной схемой полуреакции горизонтальную черту и суммируем участвующее в реакции количество частиц атомов: 2J- - 2 e → J02 |4 После этого необходимо расставить коэффициенты в уравнении реакции. Подставив полученные значения коэффициентов в молекулярное уравнение, приведем его к данному виду: 8HJ + H2SO4 = 4J2 + H2S + Н2O Подсчитав количество атомов водорода в левой и правой частях уравнения, убедимся в необходимости коррекции коэффициента «4» перед водой, получим полное уравнение: 8HJ + H2SO4 = 4J2 + H2S + 4Н2O H2SO4 ↔ 2H+ + SO42- Аналогичным образом можно записать диссоциацию иодистого водорода и сероводорода: HJ ↔ Н+ + J- J2 не диссоциирует. Так же практически не диссоциирует Н2О. Составление уравнения методом полуреакции по йоду остается такой же: 2J- - 2 e → J02 SO4-2 → S-2 Поскольку в правой части полуреакции недостает четыре атома кислорода, то это количество необходимо сбалансировать за счет воды: SO4-2 → S-2 + 4H2О Тогда в левой части полуреакции необходимо компенсировать атомы водорода за счет протонов (т.к. реакция среды кислая): SO42- + 8Н+ → S-2 + 4H2О Подсчитав количество переходящих электронов, методу полуреакций: SO42- + 8Н+ + 8 е → S-2 + 4H2О Суммируя обе полуреакции, получим уравнение электронного баланса: 2J- - 2 e → J02 |8 4
|
||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 232; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.123.240 (0.007 с.) |

 2Cuº + O2º + 2Н2SO4
2Cuº + O2º + 2Н2SO4
 ,). Процессы (полуреакции) окисления и восстановления:
,). Процессы (полуреакции) окисления и восстановления: – процесс восстановления
– процесс восстановления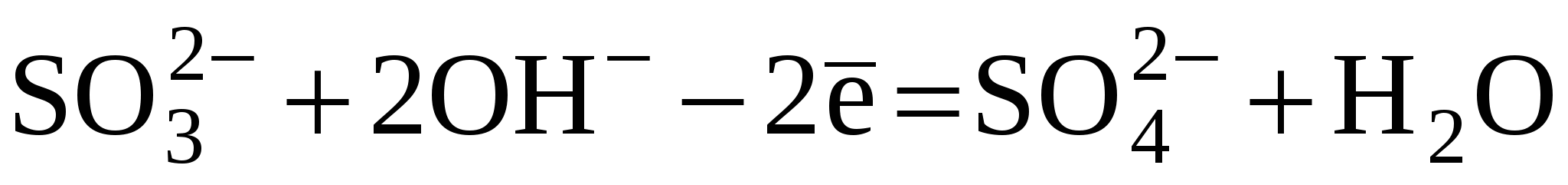 – процесс окисления
– процесс окисления

 (металл в свободном состоянии).
(металл в свободном состоянии).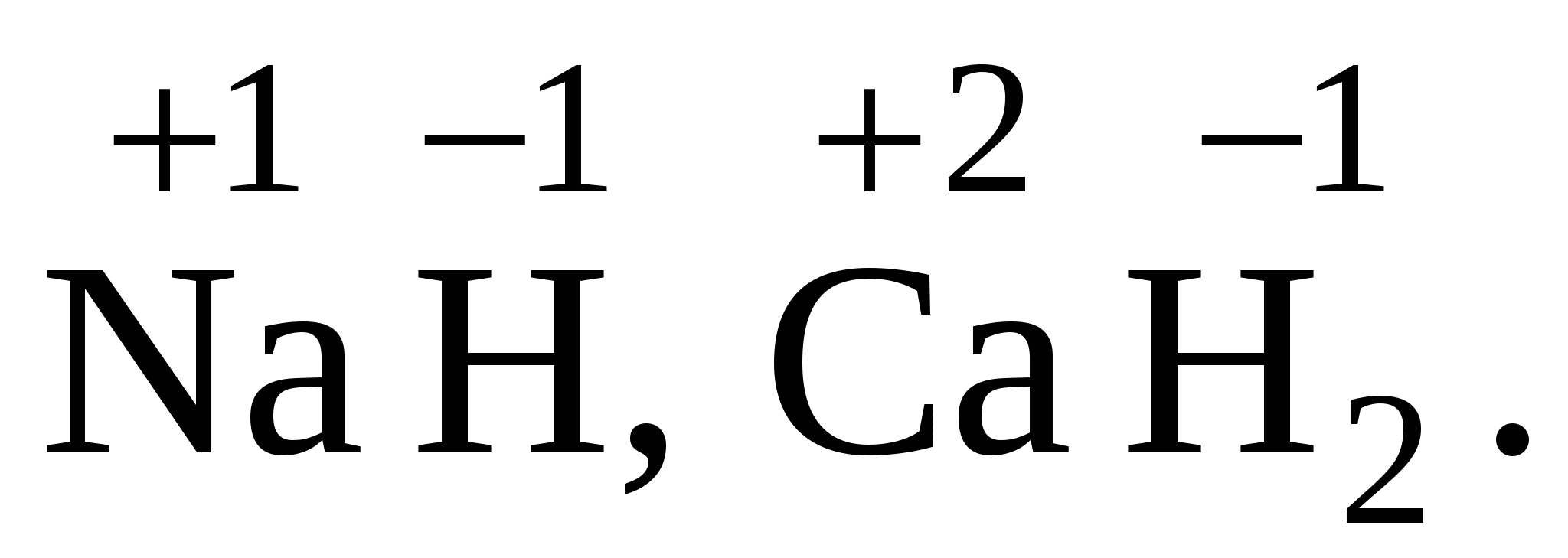
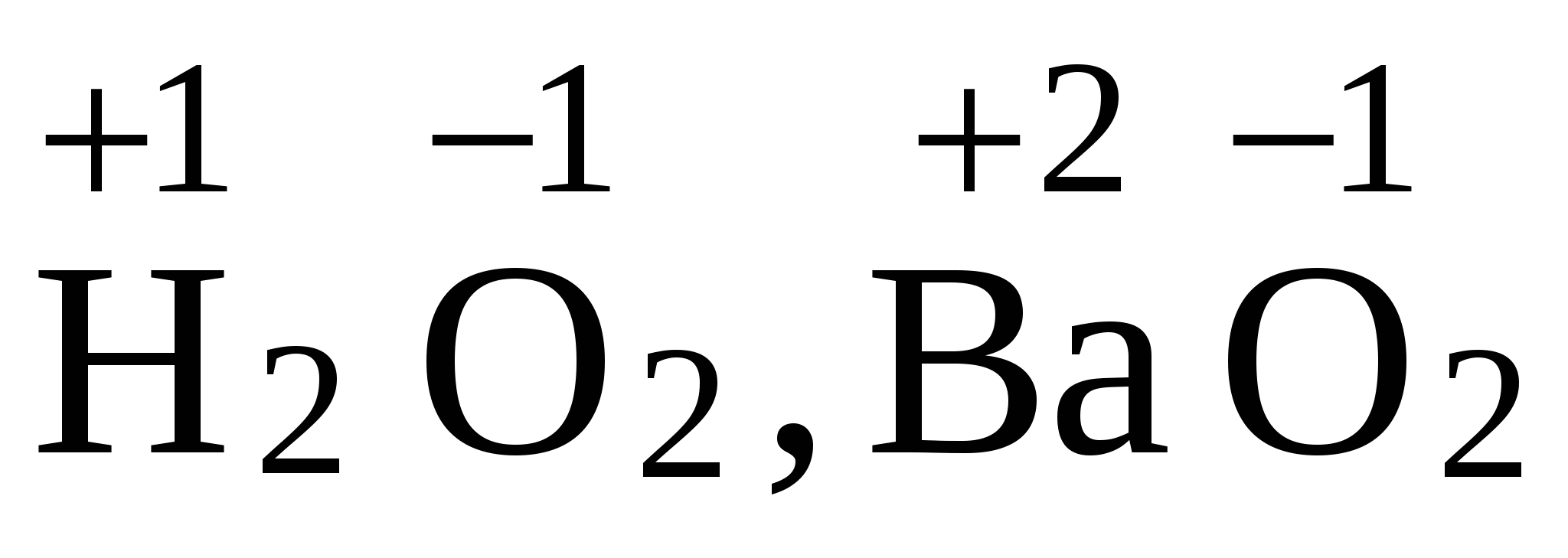 ) и фторида кислорода
) и фторида кислорода  .
. .
. Ca2+ + 2Cl1–.
Ca2+ + 2Cl1–.