Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Пам'ятайте, що після роботи більша частина досліджуваних розчинів на Розпізнавання речовин повинна залишатися невикористаною. Це необхідно на випадок, якщо доведеться повторювати Дослідження.Содержание книги
Поиск на нашем сайте Будьте уважні й обережні при роботі з кислотами! Пам'ятайте, що робота з кислотами вимагає особливої старанності і пильності! Беріть малі кількості кислот, не розливайте їх! З правилами техніки безпеки ознайомлен ___ тазобов'язуюсь їх виконувати. Підпис Хід роботи Дослід 1. Розпізнавання солей. а) У трьох пронумерованих пробірках містяться розчини солей: сульфату натрію, карбонату натрію і хлориду натрію. Визначте за допомогою дослідів, в якій пробірці яка сіль міститься, і напишіть рівняння реакцій в молекулярній та йонній формах. _________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ б) Утрьох сухих пробірках під номерами містяться кристали таких солей: хлориду натрію, броміду натрію. Визначте сіль у кожній пробірці і напишіть рівняння реакцій в молекулярній та йонній формах. _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ в) У трьох пробірках під номерами містяться розчини солей: хлориду барію, хлориду амонію і сульфату амонію. Визначте у якій з пробірок міститься кожна з цих солей, і напишіть рівняння реакцій в молекулярній та йонній формах. ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ _______________________________________________
Дослід 2. Розпізнавання кислот. У трьох пронумерованих пробірках містяться розчини кислот: хлоридної, сульфатної, нітратної. Які реакції необхідно здійснити, щоб довести присутність тієї або іншої кислоти в конкретній пробірці? Напишіть рівняння реакцій в молекулярній та йонній формах. _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Дослід 3. Хімічні властивості кислот. Проробіть не менше п'яти реакцій, що характеризують хімічні властивості: а) хлоридної; б)сульфатної кислот. Напишіть рівняння реакцій в молекулярній та йонній формах. ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Дослід 4. Сублімація. Візьміть суху пробірку, покладіть кілька кристалів йоду. Пробірку злегка нагрійте. Що спостерігається? Поясніть явище. ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Висновок _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дата "____"________________20___року Лабораторна робота №6 Тема: АЛЮМІНІЙ. ВИвчення амфотерних сполук алюмінію. Мета: Ознайомитися з лабораторним методом добування алюмінію гідроксиду та довести його амфотерність, дослідити рН розчинів деяких солей алюмінію. Обладнання і реактиви: Штатив з пробірками, універсальний індикатор, лакмус, метилоранж, АІСІ3, NaOH, H2SO4, Al(NO3)3
З правилами техніки безпеки ознайомлен ___ тазобов'язуюсь їх виконувати. Підпис
ХІД РОБОТИ
Дослід 1. Одержання АІ(ОН)3. В пробірку налийте 2 мл алюміній хлориду АІСІ3, і додайте по краплям розчин натрій гідроксиду до утворення драглистого осаду. Напишіть рівняння реакцій в молекулярному та іонному повному і скороченому вигляді. ___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Дослід 2. Дослідження амфотерних властивостей алюмінію гідроксиду. Отриманий осад в досліді 1 розділіть на дві пробірки. а) до вмісту першої пробірки додайте сульфатної кислоти H2SO4. Що спостерігаєте? __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ б) до вмісту другої пробірки додайте гідроксиду NaOH. Що спостерігаєте? Напишіть рівняння реакцій в молекулярному та іонному повному і скороченому вигляді. __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Дослід 3. Випробування розчинів солей алюмінію індикатором. Налийте в кожну пробірку по 2 мл солей люміній хлориду АІСІ3, алюміній нітрату Al(NO3)3. Дослідіть універсальним індикатором рН середовища. Напишіть рівняння гідролізу солей алюмінію. _________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Висновок __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Дата"____"_____________20 _ р
ЛАБОРАТОРНА РОБОТА №7 Тема: Вивчення властивостей споЛук феруму (ІІ), ФЕРУМУ (ІІІ). Мета: Навчитися шляхом хімічного експерименту одержувати Fe(OH)2, Fe(OH)3; вивчити їх хімічні властивості. Обладнання і реактиви: штатив з пробірками, пробірко тримач, FeSO4, NaOH, HCl, FeCl3, Н2SO4 Будьте обережні із сульфатною кислотою, бо вона ушкоджує шкіру, тканини і спричиняє опіки. З правилами техніки безпеки ознайомлен ___ тазобов'язуюсь їх виконувати. підпис ХІД РОБОТИ
Дослід 1. Одержання Fe(OH)2 і дослідження його властивостей. а) Одержання Fe(OH)2. В пробірку налийте 1 мл свіжоприготованого ферум (ІІ) сульфату і по краплям додайте натрій гідроксид NaOH чи калій гідроксид КОН. Які зміни відбуваються в пробірці? Напишіть рівняння реакцій в молекулярному та іонному повному і скороченому вигляді. ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ б) Дослідження властивостей Fe(OH)2. Отриманий в попередньому досліді осад розділіть на дві пробірки, вміст першої пробірки підігрійте. Які відбуваються зміни? Напишіть рівняння реакції. ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ До вмісту другої пробірки додайте хлоридної кислоти НСІ. Які спостерігаєте зміни? Напишіть рівняння реакції. _________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Дослід 2. Одержання Fe(OH)3 і дослідження його властивостей. а) Одержання Fe(OH)3. В пробірку налийте 1 мл ферум (ІІІ) хлориду FeСІ3 і додайте натрій гідроксиду NaOH до утворення осаду. Якого кольору утворився осад? Напишіть рівняння реакцій в молекулярному та іонному повному і скороченому вигляді _________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ б) Дослідження властивостей Fe(OH)3. До отриманого в попередньому досліді осаду додайте хлоридну кислоту НСІ. Які спостерігаєте зміни? Напишіть рівняння реакцій в молекулярному та іонному повному і скороченому вигляді. ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Висновок_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Дата "___"________________20_ р
Лабораторна робота №8 Тема: властивості одноатомних і бага-тоатомних спиртів. МЕТА: Пояснити хімічні властивості одноатомних і багатоатомних спиртів, виходячи з наявності і будови функціональної групи. Обладнання і реактиви: штатив зпробірками, пробка з газовідвідною трубкою, пробіркотримач, пальник, спіраль з мідної дротини, С2Н5ОН, гліцерин, стакан, NaOH, CuSO4, CH3COOH, H2SO4 конц., дистильована вода, ізобутиловий і ізоаміловий спирти. Під час дослідів підтримуйте слабке нагрівання суміші, щоб рідина з пробірки не перекинулася у прилад черезгазовідвідну трубку. Будьте обережні із сульфатною кислотою, бо вона ушкоджує шкіру, тканини і спричиняє опіки. З правилами техніки безпеки ознайомлен ___ тазобов'язуюсь їх виконувати. підпис ХІД РОБОТИ
Дослід 1. Розчинність гліцерину у воді. Змішайте у пробірці воду і гліцерин (приблизно по 1мл). Додайте до суміші ще 1 мл гліцерину. Чи розчиняється він? Зробіть висновок про розчинність гліцерину у воді. ____________________________________________________________________________________________________________________________________________________________________________________________________ Дослід 2. Взаємодія гліцерину з купрум (II) гідроксидом. У пробірку налийте 1 мл розчину натрій гідроксиду і додайте кілька крапель розчину купрум (ІІ) сульфат.До осаду додайте гліцерин. Суміш збовтайте. Що спостерігаєте? Запишіть рівняння реакцій. _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Дослід 3. Хімічні властивості одноатомних спиртів. а) Розчинність спиртів у воді. В 3 пробірки налийте по 0,5 мл спиртів: етилового, ізобутилового, амілового. В кожну з них додайте по 1 мл дистильованої води, струсіть вміст пробірок. Зробіть висновок. _________________________________________________________________________________________________________________________________________________________ ______________________________________________________________________________________________________ б) Взаємодія етилового спирту з металами. У пробірку наливаємо 1мл етилового спирту і додаємо краплину фенолфталеїну. Чи спостерігаємо зміни? Поясніть. _________________________________________________________________________________________________________________________________________________________ _________________________________________________________________________________________________________________________________________________________
В цю ж пробірку додаємо шматочок натрію. Пробірку закриваємо пробкою з газовивідною трубкою і через деякий час до отвору підносимо палаючий сірник (обережно). Зробіть висновок. Напишіть рівняння реакції. ____________________________________________________________________________________________________________________________________________________________________________________________________________ в) Окислення спиртів. Мідний дротик вносимо в полум´я спиртівки, прожарюємо його до утворення купрум (ІІ) оксиду. Прожарений доотик вносимо в пробірку з етиловим спиртом. Зробіть висновок. Напишіть рівняння реакції. _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ г) Одержання складних ефірів. В пробірку наливаємо 1 мл етилового спирту, додаємо рівну кількість оцтової кислоти і декілька крапель концентрованої сульфатної кислоти. Обережно нагріваємо і виливаємо в стакан з водою – утворюється кільце. Зробіть висновок. Напишіть рівняння реакції. _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Висновок_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ _______________________________________________ Дата "___"________________20_ р Лабораторна робота №9 Тема: Добування оцтового альдегіду і вивчення його властивостей. Мета: На прикладі оцтового альдегіду, виходячи з його будови пояснити хімічні властивості. Обладнання і реактиви: карбід кальцію, розбавлена сульфатна кислота, дистильована вода; етанол, аміачний розчин оксиду срібла, купрум (ІІ) сульфату, натрій гідроксиду, штатив з пробірками, спіраль з мідної дротини, газовідвідна трубка, хімічний стакан, спиртівка прилад для нагрівання,
З правилами техніки безпеки ознайомлен __ тазобов'язуюсь їх виконувати. підпис Хід роботи Дослід 1. Добування етаналю. Вивчити лабораторні методи добування оцтового альдегіду. а) Добування етаналю гідратацією ацетилену. В пробірку кладуть декілька кусочків карбіду кальцію величиною з горошину, і додають 5 – 8 мл дистильованої води. Пробірку закривають пробкою з газовідвідною трубкою, кінець якої опущений в другу пробірку, де налито 3-4 мл води так щоб газовідвідна трубка була опущена в воду. Цю пробірку опускають в стакан з холодною водою. Карбід кальцію з водою дає ацетилен, який з водою утворює оцтовий альдегід. Напишіть рівняння реакції. ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ б) Добування етаналю окисленням етанолу. У пробірку влийте не більше 0,5 -1 мл етанолу і занурте в нього розжарену спіраль із мідної дротини. Які речовини утворюються в результаті реакції? Напишіть рівняння реакції. ___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Дослід 2. Хімічні властивості етаналю . а) Окислення етаналю оксидом срібла (І). Ретельно помийте пробірку і влийте в неї свіжовиготовленого аміачного розчину оксиду срібла і додайте кілька краплин етаналю. Пробірку помістіть у стакан з гарячою водою. Що спостерігаєте? Запишіть рівняння реакції. ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ б) окислення етаналю курум (ІІ) гідроксидом. У пробірку влийте 1 мл розчину етаналю і добавте по 1 мл розчину, який містить у масових частках 0,02 або 2 %, сульфату міді (II) і розчину, що містить в масових частках 0,1 або 10 %, гідроксиду натрію. Добуту суміш нагрійте. Зробіть висновок. Напишіть рівняння реакції.________________________________ ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Висновок___________________________________ ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
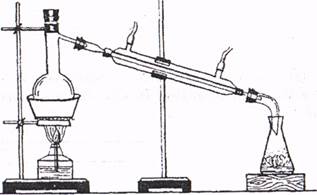
Дата "___"________________20_ р Лабораторна робота №10 Тема: Добування і властивості оцтової кислоти МЕТА: Шляхом хімічного експерименту вивчити властивості добутої оцтовоїкислоти, виходячи з будови функціональної групи. Обладнання і реактиви ацетат натрію - Зг, сульфатна кислота (1:1)2-3 мл, натрій карбонату - 5г, порошок або стружка магнію, розчин ферум (III) хлориду – 1мл, розбавлений розчин натрій гідроксиду, фенолфталеїн, універсальний лакмусовий папір або розчини індикаторів; прилад для добування газів, штатив із пробірками, нагрівний прилад. З правилами техніки безпеки ознайомлен ___ тазобов'язуюсь їх виконувати. підпис Збирання приладу. Зібрати прилад згідно малюнка.
Добування оцтової кислоти Хід роботи Дослід 1. Добування оцтової кислоти. Всипте у пробірку ацетат натрію і влийте сульфатну кислоту. Закрийте пробірку пробкою з газовідвідною трубкою, кінець якої опустіть у пробірку-приймач. Обережно нагрівайте суміш. Зберіть 2 - 3 мл оцтової кислоти. Обережно понюхайте рідину. Який висновок про силу оцтової кислоти можна зробити на основі цього досліду? ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Дослід 2. Дія оцтової кислоти на індикатори. Відлийте у пробірку частину добутої кислоти і розведіть її водою. Добутий розчин розділити на 2 пробірки, в одну занурити універсальний лакмусовий папірець а до другої додати метилового оранжевого. Як змінилося забарвлення розчину і чому? ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Дослід 3. Взаємодія оцтової кислоти з основами. До розчину натрій гідроксиду натрію, забарвленого фенолфталеїном, краплями добавляйте розчин оцтової кислоти. Що спостерігаєте. Напишіть рівняння реакції. ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Дослід 4. Кольорова реакція на ацетат-іон. До добутого в попередньому досліді продукту нейтралізації добавте кілька крапель розчину ферум (III) хлориду. З'являється характерне забарвлення внаслідок утворення феруму (III) ацетату, що свідчить про наявність ацетат-іонів. _________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Дослід 5. Взаємодія оцтової кислоти з металами. У пробірку з розбавленою кислотою помістіть стружку магнію. Спостерігайте виділення газу. Який газ виділяється? Напишіть рівняння реакції. _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Дослід 6. Взаємодія оцтової кислоти із солями. У пробірку з розчином кислоти добавте сіль кислоти, слабшої, ніж оцтова, наприклад, карбонат натрію. Спостерігайте виділення газу. Який газ виділяється? Свої спостереження під час дослідів підтвердіть рівняннями реакцій. ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Висновок:____________________________________ _________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дата "___"________________20_ р Лабораторна робота №11 Тема: Добування етерів. Вивчення властивостей жирів. Мета: Добутиреакцією етерифікації складний ефір, пояснити фізичні властивості. Шляхом хімічного експерименту пояснити хімічні властивості жирів і довести ненасичений характер рослинних олій. Обладнання і реактиви: етиловий спирт - 5мл, оцтова кислота конц. - 5мл, сульфатна кислота - Імл; соняшникова олія, NaOH, насичений розчин NaCl, бромна вода,колба Вюрца на 50 – 75 мл, лід, нагрівний прилад; штатив з пробірками, пробірко тримач. Оцтовоетиловий ефір - рідина з фруктовим запахом, розчинний у воді; т-ра кипіння - 77,2 °С.
Не нагрівайте суміш на відкритому попум'ї!Оцтовоетиловий ефір легко займається, утворює з повітрям вибухонебезпечну суміш. Нюхайте ефір обережно, оскільки він подразнює слизової оболонки! З правилами техніки безпеки ознайомлен ___ тазобов'язуюсь їх виконувати. підпис
ХІД РОБОТИ Дослід 1 Синтез етилового ефіру оцтової кислоти. Збирання приладу. Зберіть прилад для перегонки. Колбу Вюрца помістіть у водяну баню, а у приймач добавте суміш води з льодом.
Добування етилового ефіру оцтової кислоти. У колбу Вюрца помістіть видану вам суміш етанолу, оцтової і сульфатної кислот. Закрийте пробку, приєднайте холодильник і увімкніть воду. Кінець алонжа опустіть у приймач. Обережно нагрівайте суміш на водяній бані. Продукт реакції зберігається у приймачі під шаром льоду. Вміст приймача струсіть, дайте відстоятися у витяжній шафі і відокремте верхній ефірний шар за допомогою ділильної лійки. Переконайтеся у специфічному запаху ефіру. З'ясуйте роль сульфатної кислоти у даній реакції. Напишіть рівняння реакцій. ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
|
|||
|
Последнее изменение этой страницы: 2016-07-11; просмотров: 217; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.216 (0.01 с.) |