
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Полум'я водню і продукт його горінняСодержание книги Поиск на нашем сайте
Реактиви та обладнання: апарат Кіппа з цинком і розчином сульфатної кислоти, промивна склянка з концентрованою сульфатною кислотою, стакан місткістю 500 мл, штатив з лапкою, безводний сульфат міді (II).
Пари води, що утворюються при горінні водню, конденсуються на внутрішній поверхні великого стакана, який тримають похило над полум'ям. Коли утворюється достатня кількість крапель води, внесіть в стакан трохи безводного сульфату міді (II). Посиніння солі підтверджує наявність води, що утворилася при горінні водню.
Вибух гримучого газу — суміші водню з киснем Реактиви та обладнання: апарат Кіппа з воднем, газометр з киснем, кристалізатор з водою, циліндр на 100 мл, годинникове скло (за розміром циліндра), пальник, штатив з лапкою, рушник. Зробіть мітку на циліндрі — 2/3 об'єму від дна. Наповніть циліндр водою, закрийте його годинниковим склом, перекиньте в кристалізатор і закріпіть в лапці штативу. Наповніть циліндр на 2/3 воднем і до краю циліндра киснем. Циліндр з газами закрийте годинниковим склом, вийміть його з кристалізатора, оберніть рушником. Тримайте циліндр горизонтально, отвором від себе, зніміть годинникове скло і пальником підпаліть суміш газів. Відбувається безпечний вибух.
Отримання кисню з пероксиду водню Реактиви та обладнання: плоскодонна колба, ділильна лійка, проста лійка, циліндр для збирання кисню з скляною пластинкою, кристалізатор, 2 штативи з лапками, скалка, пероксид водню (10%-ний), оксид марганцю (IV).
2Н2О2 = 2Н2О + О2↑ Витісніть повітря з приладу. Перевірте наявність кисню, що виділяється, тліючою скалкою. Потім підведіть газовідвідну трубку під перекинутий циліндр з водою і наповніть його киснем. Якщо виділення кисню сповільниться, можна трохи підігріти колбу. Після закінчення досліду спочатку вийміть газовідвідну трубку з води. Переверніть циліндр з киснем і тліючою скалкою перевірте наявність в ньому кисню. Добування кисню розкладанням калію перманганату Реактиви та обладнання: велика пробірка, пробка з газовідвідною трубкою, циліндр, кристалізатор, вата, калій перманганат, 2 штативи з лапками, пальник.
Вата не повинна стикатися зі всією масою перманганату калію, інакше при нагріванні вона спалахує. 10 г перманганату калію дають близько 0,7 г кисню (така кількість бертолетової солі дає 3 г кисню).
Фізичні властивості кисню Реактиви та обладнання: 2 скляні циліндри (банки) для збирання газу, газометр, технохімічні терези, 2 колби на 500 мл, зігнута скляна трубка, пісок, тліюча скалка. Агрегатний стан, відсутність кольору і запаху можна спостерігати, зібравши кисень в банку або газометр. Доказ того, що кисень важче за повітря На терезах врівноважують порожню колбу (з повітрям), яку наповнюють з газометра киснем (краще просушеним). При цьому рівновага порушується, колба з киснем переважує. Переливання кисню Киснем заповнюють банку в 500 мл. Зібраний кисень поволі переливають в іншу банку місткістю менше першої (250-300 мл). Банку, з якої переливали кисень, залишають стояти вверх дном. Випробуванням тліючою скалкою визначають присутність кисню тільки в меншій банці.
|
||||
|
Последнее изменение этой страницы: 2016-07-11; просмотров: 332; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.254.35 (0.006 с.) |

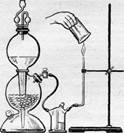 Зберіть прилад, як вказано на малюнку. До промивної склянки, сполученої з апаратом Кіппа, приєднайте укріплену в лапці штатива, зігнуту під прямим кутом скляну трубку, верхній кінець якої відтягнутий. Пустивши з апарату Кіппа помірний струм водню (після випробування газу, що виділяється, на відсутність гримучої суміші), підпаліть його у відтягнутого кінця трубки. Спостерігайте полум’я водню.
Зберіть прилад, як вказано на малюнку. До промивної склянки, сполученої з апаратом Кіппа, приєднайте укріплену в лапці штатива, зігнуту під прямим кутом скляну трубку, верхній кінець якої відтягнутий. Пустивши з апарату Кіппа помірний струм водню (після випробування газу, що виділяється, на відсутність гримучої суміші), підпаліть його у відтягнутого кінця трубки. Спостерігайте полум’я водню.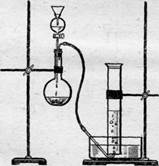 Зберіть прилад, як вказано на малюнку. Наповніть циліндр водою і закріпіть його в кристалізаторі. В колбу внесіть чайну ложку оксиду марганцю (IV). В ділильну лійку налийте пероксид водню і по краплях додайте його в колбу:
Зберіть прилад, як вказано на малюнку. Наповніть циліндр водою і закріпіть його в кристалізаторі. В колбу внесіть чайну ложку оксиду марганцю (IV). В ділильну лійку налийте пероксид водню і по краплях додайте його в колбу: Пробірку з перманганатом калію закріплюють злегка похило і нагрівають. Розкладання починається вже при 240°С. Оскільки при нагріванні перманганат калію розпиляється і летить разом з киснем, то корисно у верхній частині пробірки покласти рихлий тампон з вати.
Пробірку з перманганатом калію закріплюють злегка похило і нагрівають. Розкладання починається вже при 240°С. Оскільки при нагріванні перманганат калію розпиляється і летить разом з киснем, то корисно у верхній частині пробірки покласти рихлий тампон з вати.


