

Мы поможем в написании ваших работ!
ЗНАЕТЕ ЛИ ВЫ?
|
Щелочные металлы – это элементы 1 группы главной подгруппы периодической системы химических элементов Д. И. Менделеева.
Щелочные металлы – это элементы 1 группы главной подгруппы Периодической системы химических элементов Д.И. Менделеева.
| Металлы
| s –э л е м е н т ы
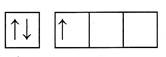
| электронная конфигурация внешнего уровня: ns1 
| степень окисления +1
| ß----------------------------------------- увеличиваетсярадиус, усиливаются металлические свойства, уменьшается электроотрицательность
| Т пл. °С
| Плотность, г/см3
| | Li
|
| 0,53 (почти в 2 раза легче воды)
| | Na
|
| 0,97
| | K
|
| 0,86
| | Rb
|
| 1,53
| | Cs
|
| 1,88
| Качественная реакция: окрашивание пламени растворами солей!

| Щелочной металл
| Цвет пламени
| | Li
| Карминно-красный
| | Na
| Жёлтый
| | K
| Фиолетовый
| | Rb
| Буро-красный
| | Cs
| Фиолетово-красный
|
Способы получения щелочных металлов.
| Натрий:
минерал - поваренная (каменная) соль NaCl
| Электролиз расплава хлорида натрия с добавками хлорида кальция: 2NaCl (расплав)–(эл. ток)à2Na + Cl2.
Электролит- смесь NaCl с NaF и КСl (позволяет проводить процесс при 610–650°С).
| | Калий: минералы сильвин KCl, сильвинит NaCl · KCl
| Пропускание паров натрия через расплав хлорида калия при 800°С: KCl + Na = K↑+ NaCl
| | Литий:
| Электролиз расплава хлорида лития проводят в смеси с KCl
или BaCl2 (эти соли служат для понижения температуры плавления смеси). 2LiCl = 2Li + Cl2 | | Цезий
| Нагревание смеси хлорида цезия и специально подготовленного кальция: Са + 2CsCl à 2Cs + CaCl2
|
Химические свойства натрия и калия
| Реакция
| литий
| натрий
| Калий, рубидий, цезий.
| | 1. С кислородом
(реагируют очень активно, окисляются на воздухе)
| образует оксид
4Li + O2 = 2Li2O
| образуется
пероксид!
2Na + O2 = Na2O2
| образуется
надпероксид!
K + O2 = KO2 (так же Rb,Cs)
| | 2. С простыми веществами-неметаллами: галогенами, серой, фосфором, водородом, углеродом (очень активно).
| С галогенами: 2Na + Cl2 = 2NaCl (галогениды)
С серой – сульфиды: 2K + S = K2S
С фосфором – фосфиды: 3K + P = K3P
С водородом – солеобразные гидриды: 2Na + H2 = 2NaH
С углеродом - карбиды Ме2С2
| | 3. С азотом
| Литий при комнатной температуре образует нитрид:6Li + N2 = 2Li3N
| Только при очень высокой температуре.
| | 4. С водой
| Литий – спокойно, остальные – со взрывом:
2К + 2H2O = 2КOH + H2
| | 5. С кислотами
Со всеми кислотами реагируют со взрывом!
| С азотной концентрированной: выделяется N2O.
8Na + 10HNO3 (конц) à N2O+ 8NaNO3 + 5H2O
С азотной разбавленной: в зависимости от разбавления либо азот, либо нитрат аммония (оч. разб).
10Na + 12HNO3 (разб)à N2+10NaNO3 + 6H2O
С концентрированной серной: выделяется сероводород.
8Na + 5H2SO4 àH2S + 4Na2SO4 +4H2O
| | 6. В расплаве (!) могут вытеснять из солей менее активные (ил иболее летучие, легкокипящие) металлы.
| 3Na + AlCl3 (расплав) à 3NaCl + Al
KCl + Na = K↑+ NaCl
|
Оксиды натрия и калия.
Получение. Так как натрий и калий с кислородом образуют не оксиды, а пероксид и надпероксид, оксиды получают косвенным путём:
из пероксидов: Na2O2 + 2Na = 2Na2O
и надпероксидов: 3K + KO2 = 2K2O.
Свойства: основные оксиды
| 1) Реагируют с водой- очень активно присоединяют воду, образуя ЩЕЛОЧИ
| К2O + H2O = 2КOH
| | 2) Реагируют с кислотными и амфотерными оксидами, образуя соли
| Li2O + SO3 = Li2SO4;
Na2O + Al2O3 = NaAlO2
| | 3) Реагируют с кислотами – образуя соли.
| Li2O + 2HCl = 2LiCl + H2О.
| | 4) Окисляются кислородом (кроме оксида лития): оксид натрия - до пероксида, калия, рубидия и цезия – до надпероксида.
| 2Na2O + O2 = 2Na2O2;
|
Гидроксиды щелочных металлов – ЩЕЛОЧИ.
Получение.
1) Электролиз водного раствора хлорида натрия и калия.
2NaCl + 2H2O –(эл.ток)à H2 + 2NaOH + Cl2.
2) С помощью обменных реакций сульфатов с гидроксидом бария:
Rb2SO4 + Ba(OH)2 = 2RbOH + BaSO4 ↓.
3) Взаимодействие металлов, их оксидов, пероксидов, гидридов, фосфидов, нитридов с водой: 2К + 2H2O = 2КOH + H2 К2O + H2O = 2КOH
КН + Н2О = КОН + Н2 Li3N + 3H2O = 3LiOH + NH3
Свойства:
| 1) Все гидроксиды проявляют свойства сильных оснований.В воде полностью диссоциируют, образуя щелочную среду и меняя окраску индикаторов.
| NaOH D Na+ + OH-.
| | 2) Гидроксиды всех щелочных металлов плавятся без разложения, гидроксид лития разлагается при нагреваии до температуры 600°С:
| 2LiOH –(t)à Li2O + H2O.
NaOH, КОН à не разлагаются!
| | 3) Реагируют с кислотными и амфотерными оксидами, образуя соли.
| а) с кислотными оксидами:
KOH + CO2 (изб) = KHCO3;
2NaOH(изб) + CO2 = Na2CO3 + H2O;
2KOH + 2NO2 = KNO3 + KNO2 + H2O.
б) с амфотерными оксидами:
NaOH + Al2O3(спл) → t NaAlO2 + H2O
2NaOH + BeO + H2O = Na2[Be(OH)4]
| | 4) Взаимодействуют с кислотами, вступают в реакцию нейтрализации, образуют с многоосновными кислотами кислые и средние соли.
| KOH + HNO3 = KNO3 + H2O
KOH + H2SO4 (изб) = KHSO4+ H2O;
2NaOH(изб) + H2SO4 = Na2SO4 + 2H2O
| | 5) Вступают в обменные реакции с растворимыми солями:
| 2NaOH + CuCl2 = Cu(OH)2¯+ 2NaCl
КОН + NH4Cl = NH3 + H2O + KCl
KOH + KHSO3 = K2SO3 + H2O
Реакция возможна, если образуется осадок, газ или вода.
| | 6) Взаимодействуют с амфотерными металлами (кроме хрома и железа):
| 2KOH + Zn(сплавление) →tK2ZnO2 + H2;
2NaOH + Be + 2H2O = Na2[Be(OH)4]+ H2;
| | 7) Реагируют с амфотерными гидроксидами, образуя гидроксокомплексы в водном растворе.
|
2NaOH + Be(OH)2 = Na2[Be(OH)4]
| | 8) Реагируют с неметаллами, кроме O2, N2, C, инертных газов.
| 1) 2NaOH + Si + H2O = Na2SiO3 + 2H2
2) 4NaOH + 2F2 = 4NaF + O2 (OF2)+ 2H2O
3) С серой и остальными галогенами – идет реакция диспропорционирования:
6NaOH + 3S = 2Na2S + Na2SO3 + 3H2O
6NaOH + 3Cl2 → t 5NaCl + NaClO3 + 3H2O
| | 9) В расплаве подвергаются электролизу
| NaOH(расплав)-(эл.ток)àNa + O2 + H2O
Катод Анод
|
Особенности химии бериллия
| Металл Ве – амфотерный. Реагирует с кислотами и концентрированными щелочами, выделяя водород.
| Be + 2HCl = BeCl2 + H2;
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + Н2
тетрагидроксобериллат натрия
| | Оксид ВеО – амфотерный. Реагирует с кислотами и щелочами.
| BeO + 2HCl = BeCl2 + H2O;
BeO + 2NaOH + H2O = Na2[Be(OH)4] (в растворе);
BeO + 2NaOH –(t)à Na2BeO2 + H2O (в расплаве);
бериллат натрия
| | Гидроксид Ве(ОН)2 – амфотерный. Реагирует с кислотами и щелочами.
| Be(OH)2 + 2HCl = BeCl2 + 2H2O;
Be(OH)2 + 2NaOH = Na2[Be(OH)4]
Be(OH)2 + 2NaOH –(t)à Na2BeO2 + Н2О (в расплаве).
| | Соли бериллия – гидролизуются по катиону.
| BeCl2 + H2O ⇄ BeOHCl + HCl.
|
АЛЮМИНИЙ.
| р-элемент,
амфотерный металл.
Степень окисления:
+3
| Электронная конфигурация внешнего слоя 3s23p1
| | По распространенности занимает третье место, после О и Si, содержание в земной коре 8,3 мас.%.
| Природное соединение:
корунд Al2O3
| Физические свойства:
t пл. 660°С,
t кип 1450°С,
плотность 2,7 г/см3.
|
Химические свойства алюминия На воздухе поверхность металла покрыта прочной пленкой оксида, защищающей металл от окисления.
| 1) Взаимодействие с неметаллами – кислородом, серой, галогенами, азотом и фосфором.
С водородом не взаимодействует.
| 4Al + 3O2 –(t)à 2Al2O3
2Al + 3S –(t)à Al2S3
4Al + 3C –(t)à Al4C3
Al + N2 –(1000˚)à AlN
2Al + 3Cl2 –(t)à 2AlCl3
| | 2) Взаимодействие с водой: в обычных условиях алюминий с водой не реагирует из-за оксидной пленки.
Очищенный от оксидной пленки алюминий (например, амальгамированный) энергично взаимодействует с водой.
| Al + H2O àне реагирует (оксидная пленка)
2Al(амальгама)+6H2O = 2Al(OH)3+ 3H2
| | 3) Взаимодействие с кислотами:с концентрированными серной и азотной кислотами не реагирует, происходит пассивация, образование плотной оксидной плёнки.
| 2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2
10Al+ 36HNO3(разб)=10Al(NO3)3+3N2+18H2O
2Al + 6H2SO4 (конц) –(t)à Al2(SO4)3 + 3SO2 + 6H2O
| | 4) Взаимодействие со щелочами:алюминий – амфотерный металл, он легко реагирует со щелочами
| 2Al +2NaOH+6H2O=2Na[Al(OH)4] + 3H2
2Al + KOH –(t)à 2K3AlO3 + 3H2
| | 5) Восстанавливает менее активные металлы из оксидов.
| 2Al + Cr2O3 –(t)à 2Cr + Al2O3
|
Получение алюминия
Металлический алюминий получают электролизом расплава Al2O3 в расплавленном криолите Na3AlF6 при 960–970°С. Криолит добавляется для понижения температуры расплава. Электролиз Al2O3 можно представить следующей схемой:
Al2O3 → t Al3+ + AlO33-
| на катоде восстанавливаются ионы Al3+:
|
| Al3+ +3e à Al0,
| | на аноде окисляются ионы AlO33-:
|
| 4AlO33- - 12e à 2Al2O3 + 3O2
| Суммарное уравнение процесса: 2Al2O3 (расплав) –(эл.ток)à 4Al + 3O2.
Так как при электролизе расплава оксида алюминия используются графитовые электроды, они окисляются и вместо кислорода выделяются оксиды углерода – СО и СО2!
Оксид алюминия Al2O3 – амфотерный оксид, химически малоактивен, благодаря своей прочной кристаллической решетке.
Получение: разложение гидроксида. 2Al(OH)3 – (t)à Al2O3 + 3H2O;
Свойства:
| Реагирует с кислотами и кислотными оксидами сильных кислот
| Al2O3 + 6HCl = 2AlCl3 + 3H2O;
Al2O3 + 3SO3 = Al2(SO4)3 (основные свойства)
| | Взаимодействует со щелочами и карбонатами щелочных металлов при сплавлении с образованием алюминатов:
| (кислотные свойства)
Al2O3 + 2KOH –tà 2KAlO2 + H2O;
Al2O3 + Na2CO3 –tà 2NaAlO2 + CO2.
| | Растворяется в водном растворе щелочи.
| Al2O3 + 2NaOH + 3H2O = 2 Na[Al(OH)4].
|
Гидроксид алюминия.
Получение:
1) Действие водного раствора аммиака на растворы солей алюминия:
AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl;
2) Пропускание углекислого газа, сернистого газа или сероводорода через щелочной раствор тетрагидроксоалюмината натрия:
2Na [Al(OH)4]+ СО2 = 2Al(OH)3 + NaНCO3 + H2O
3) Взаимодействие растворов солей с недостатком щелочи:
AlCl3 + 3KOH(недост) = Al(OH)3 ↓+ 3KCl
Свойства: Типичное амфотерное соединение, свежеполученный гидроксид растворяется в кислотах и щелочах
| Реагирует с кислотами, образуя соли.
| 2Al(OH)3 + 6HCl = 2AlCl3 + 6H2O
| | Реагирует со щелочами – в растворе и в расплаве.
| Al(OH)3 + NaOH + 2H2O = Na[Al(OH)4].
Al(OH)3 + NaOH →tNaAlO2 + 2H2O
| | Разлагается при нагревании.
| 2Al(OH)3 → tAl2O3 + 3H2O
|
Щелочные металлы – это элементы 1 группы главной подгруппы Периодической системы химических элементов Д.И. Менделеева.
| Металлы
| s –э л е м е н т ы
| электронная конфигурация внешнего уровня: ns1 
| степень окисления +1
| ß----------------------------------------- увеличиваетсярадиус, усиливаются металлические свойства, уменьшается электроотрицательность
| Т пл. °С
| Плотность, г/см3
| | Li
|
| 0,53 (почти в 2 раза легче воды)
| | Na
|
| 0,97
| | K
|
| 0,86
| | Rb
|
| 1,53
| | Cs
|
| 1,88
| Качественная реакция: окрашивание пламени растворами солей!

| Щелочной металл
| Цвет пламени
| | Li
| Карминно-красный
| | Na
| Жёлтый
| | K
| Фиолетовый
| | Rb
| Буро-красный
| | Cs
| Фиолетово-красный
|
|









