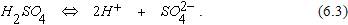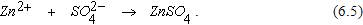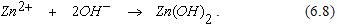Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электрохимическая коррозия — это разрушение сплава, сопровождающееся появлением электрического тока в результате работы множества микрогальванических элементов на корродирующей поверхности металла.Содержание книги
Поиск на нашем сайте
Металлические покрытия бывают двух типов — анодные и катодные. Для анодного покрытия используют металлы, обладающие более отрицательным электродным потенциалом, чем основной металл (например, цинк, хром). Для катодного покрытия выбирают металлы, имеющие меньшее отрицательное значение электродного потенциала, чем основной металл (медь, олово, свинец, никель и др.). Металлические покрытия наносят горячим методом, гальваническим и металлизацией. При горячем методе покрытия изделия погружают в ванну с расплавленным защитным металлом, температура которого ниже, чем температура плавления изделия (цинк, олово, свинец). 40. Термореактивные полимеры, применяемые в строительстве и для защиты от коррозии.
Это обусловлено тем, что при нагреве реактопласты подвергаются необратимому химическому разрушению. Упругие свойства термореактивных полимеров выше, чем у термопластичных. В то же время, термореактивные полимеры практически не обладают текучестью, вследствие чего они имеют более низкое напряжение разрушения. Представителями реактопластов являются фенолоальдегидные, карбамидные, эпоксидные, полиуретановые полимеры и полиэфиракрилаты. 41. Коррозия металлов. Поляризация. При соприкосновении двух металлов с различными окислительно-восстановительными потенциалами и погружении их в раствор электролита, например, дождевой воды с растворенным углекислым газом CO2, образуется гальванический элемент, так называемый коррозионный элемент. Он представляет собой не что иное, как замкнутую гальваническую ячейку. В ней происходит медленное растворение металлического материала с более низким окислительно-восстановительным потенциалом; второй электрод в паре, как правило, не корродирует. Этот вид коррозии особо присущ металлам с высокими отрицательными потенциалами. Так, совсем небольшого количества примеси на поверхности металла с большим редокспотенциалом уже достаточно для возникновения коррозионного элемента. Особо подвержены риску места соприкосновения металлов с различными потенциалами, например, сварочные швы или заклёпки. Если растворяющийся электрод коррозионно-стоек, процесс коррозии замедляется. На этом основана, например, защита железных изделий от коррозии путём оцинковки — цинк имеет более отрицательный потенциал, чем железо, поэтому в такой паре железо восстанавливается, а цинк должен корродировать. Однако в связи с образованием на поверхности цинка оксидной плёнки процесс коррозии сильно замедляется. 42. Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении целостности покрытия. Составьте уравнение анодного и катодного процессов. Оцинкованное: Луженое железо в нейтральной среде: A: Fe – 2е → Fe2+ Луженая медь в нейтральной среде: A: Sn – 2е → Sn2+ 43. Коррозия металлов. Водородная и кислородная деполяризация.
Рисунок 6.2 – Схемы процессов, протекающих в гальваническом элементе: а – водородная деполяризация; б – кислородная деполяризация Благодаря отрицательному потенциалу цинк разрушается и в раствор переходят положительные ионы цинка. Вследствие полярного строения молекул воды происходит гидратация ионов
Освобождающиеся электроны движутся по внешней цепи от анода к катоду
Вблизи катода имеются положительные ионы водорода Н+, образовавшиеся в результате диссоциации серной кислоты
Ионы водорода, соединяясь с подошедшими к катоду электронами, образуют молекулы водорода, пузырьками выделяющегося с поверхности катода
Ионы водорода выступают в роли деполяризаторов. Они отводят электроны с катода и способствуют восстановлению его потенциала. Продуктом коррозии является сульфат цинка, образовавшийся в результате соединения ионов SO42- с перешедшими в раствор ионами Zn2+
При кислородной деполяризации электроны отводятся кислородом, растворенным в электролите и попадающим туда из воздуха. Примером может служить коррозия цинка в контакте с медью в водном растворе какой-либо соли, например NaCl, водимой для увеличения электропроводности среды. Электроны отводятся с катода путем взаимодействия с кислородом и водой по схеме
Возможна схема с образованием пероксида водорода
В обоих случаях деполяризатором является кислород. От подвода кислорода к аноду зависит скорость всего коррозионного процесса. Образующиеся гидроксильные ионы, соединяясь с ионами цинка, образуют Zn(OH)2
Анализ работы гальванических элементов позволяет заключить, что при коррозии всегда разрушается анод из металла с меньшим электродным потенциалом. Катод не разрушается и является электродом, на котором осуществляются процессы деполяризации.
|
||||
|
Последнее изменение этой страницы: 2016-06-29; просмотров: 454; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.009 с.) |