
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вода в ионных кристаллах (Ионные кристаллы )Содержание книги
Поиск на нашем сайте
Объединение катионов и анионов в кристалл осуществляется благодаря кулоновскому притяжению электрических зарядов. В молекуле заряды взаимодействуют с силой. Величина R – расстояние между двумя ионами. Если это расстояние будет бесконечно далеко, то сила равна нулю. На конечном расстоянии сила взаимодействия двух противоположно заряженных ионов отрицательна, что соответствует притяжению, ионы стремятся сблизиться на минимально допустимое расстояние, которое соответствует устойчивому связанному состоянию. Сила взаимодействия двух одинаково заряженных ионов положительна, что соответствует отталкиванию. Ионы стремятся разлететься и на любом расстоянии не образуют устойчивого соединения. Таким образом, энергия образования кристалла должна быть отрицательной. Такое условие реализуется при образовании ионного кристалла. В ионных кристаллах нет молекул, поэтому не существует границ между структурными единицами. Ионы можно представить как заряженные шары, силовые поля которых равномерно распределяются во всех направлениях в пространстве. Поэтому каждый ион может притягивать к себе ионы противоположного знака в любом направлении, поэтому ионная связь не обладает направленностью. Взаимодействие двух ионов противоположного знака не может привести к полной взаимной компенсации их силовых полей. В силу этого у них сохраняется способность притягивать ионы противоположного знака и по другим направлениям. Следовательно, ионная связь не является насыщенной. Катионы стремятся себя окружить как можно большим числом анионов так, что кулоновское отталкивание ионов одного знака друг от друга компенсируется взаимным кулоновским притяжением катионов и анионов. Поэтому для структур с ионным типом химической связи характерны высокие координационные числа и плотнейшие шаровые упаковки. Симметрия ионных кристаллов обычно высокая. Кристаллические вещества с ионным типом химической связи характеризуют диэлектрические свойства, хрупкость, средние значения твердости и плотности, низкая тепло- и электропроводность.
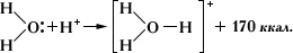
Донорно-акцепторная связь. Донорно-акцепторный механизм (координационная связь) — химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого атома (акцептора). Донорно-акцепторный механизм возникает часто при комплексообразовании за счет свободной пары электронов, принадлежавшей (до образования связи) только одному атому (донору) и обобществляемой при образовании связи. Донорно-акцепторная связь отличается от обычной ковалентной только происхождением связующих электронов. Например, реакция аммиака с кислотой состоит в присоединении протона, отдаваемого кислотой, к неподеленной электронной паре донора (азота): В ионе NH4+ вce четыре связи азота с водородом равноценны, хотя отличаются происхождением. Донорами могут быть атомы азота, кислорода, фосфора, серы и др. Роль акцепторов может выполнять протон, а также атомы с незаполненным октетом (напр., атомы элементов III группы таблицы Д. И. Менделеева, а также атомы-комплексообразователи, имеющие незаполненные энергетические ячейки в валентном электронном слое). Донорно-акцепторная связь, координационная связь, термин, обозначающий один из способов образования химической ковалентной связи. Обычная ковалентная связь между двумя атомами обусловлена взаимодействием двух электронов — по одному от каждого атома. Д.-а. с. осуществляется за счёт пары электронов одного атома (донора) и свободной (незаполненной) орбитали другого (акцептора). Схематически это различие можно выразить так: В обоих случаях электроны становятся общими для двух атомов. Типичным примером является образование иона аммония при реакции аммиака с ионом водорода (протоном): В молекуле аммиака азот имеет неподелённую пару электронов, у иона водорода 1s-орбиталь свободна. При достаточном сближении молекулы NH3 и иона Н+ двухэлектронное облако азота попадает в сферу притяжения иона водорода и становится общим и для атома азота, и для атома водорода, т. е. возникает четвёртая ковалентная связь N — Н. Все связи N — Н в этом ионе становятся равноценными и неразличимыми. Ещё один важный пример — образование иона оксония:
В данном случае молекула воды — донор, протон — акцептор. Этот способ образования ковалентной связи играет большую роль в химии комплексных соединений. Донорно-акцепторная связь (координационная связь, семиполярная связь) — химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободного уровня другого атома (акцептора). Донорно-акцепторная связь образуется часто при комплексообразовании за счет свободной пары электронов, принадлежавшей (до образования связи) только одному атому (донору). Донорно-акцепторная связь отличается от обычной ковалентной только происхождением связевых электронов. Реакция аммиака с кислотой состоит в присоединении протона, отдаваемого кислотой, к неподеленным электронам азота:
В ионе NH4+ все четыре связи азота с водородом равноценны, хотя отличаются происхождением. Донорами могут быть атомы азота, кислорода, фосфора, серы и др. Роль акцепторов могут выполнять протон, а также атомы с незаполненным октетом, напр. атомы элементов III группы таблицы Д. И. Менделеева, а также атомы-комплексообразователи, имеющие незаполненные энергетические ячейки в валентном электронном слое. Донорно-акцепторная связь называется иначе семиполярной (полуполярной), так как на атоме-доноре возникает эффективный положительный заряд, а на атоме-акцепторе — эффективный отрицательный заряд. Изображают эту связь стрелкой, направленной от донора к акцептору.
Ковалентная связь Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой. Образование связи Простая ковалентная связь образуется из двух неспаренных валентных электронов, по одному от каждого атома:
В результате обобществления электроны образуют заполненный энергетический уровень. Связь образуется, если их суммарная энергия на этом уровне будет меньше, чем в первоначальном состоянии (а разница в энергии будет не чем иным, как энергией связи).
Заполнение электронами атомных (по краям) и молекулярных (в центре) орбиталей в молекуле H2. Вертикальная ось соответствует энергетическому уровню, электроны обозначены стрелками, отражающими их спины. Согласно теории молекулярных орбиталей, перекрывание двух атомных орбиталей приводит в простейшем случае к образованию двух молекулярных орбиталей (МО): связывающей МО и антисвязывающей (разрыхляющей) МО. Обобществленные электроны располагаются на более низкой по энергии связывающей МО. Виды ковалентной связи Существуют три вида ковалентной химической связи, отличающихся механизмом образования: 1. Простая ковалентная связь. Для ее образования каждый из атомов предоставляет по одному неспаренному электрону. При образовании простой ковалентной связи формальные заряды атомов остаются неизменными.
2. Донорно-акцепторный механизм. Для образования этого вида ковалентной связи оба электрона предоставляет один из атомов — донор. Второй из атомов, участвующий в образовании связи, называется акцептором. В образовавшейся молекуле формальный заряд донора увеличивается на единицу, а формальный заряд акцептора уменьшается на единицу. 3. Семиполярная связь. Этот вид ковалентной связи образуется между атомом, обладающим неподелённой парой электронов (азот, фосфор, сера, галогены и т. п.) и атомом с двумя неспаренными электронами (кислород, сера). Образование семиполярной связи протекает в два этапа: 1. Перенос одного электрона от атома с неподелённой парой электронов к атому с двумя неспаренными электронами. В результате атом с неподелённой парой электронов превращается в катион-радикал (положительно заряженная частица с неспаренным электроном), а атом с двумя неспаренными электронами — в анион-радикал (отрицательно заряженная частица с неспаренным электроном). 2. Обобществление неспаренных электронов (как в случае простой ковалентной связи). При образовании семиполярной связи атом с неподелённой парой электронов увеличивает свой формальный заряд на единицу, а атом с двумя неспаренными электронами понижает свой формальный заряд на единицу. Примеры веществ с ковалентной связью Простой ковалентной связью соединены атомы в молекулах простых газов (Н2, Сl2 и др.) и соединений (Н2О, NH3, CH4, СО2, НСl и др.). Соединения с донорно-акцепторной связью — катион аммония NH4+, тетрафторборат aнион BF4- и др. Соединения с семиполярной связью — закись азота N2O, O--PCl3+. Кристаллы с ковалентной связью диэлектрики или полупроводники. Типичными примерами атомных кристаллов (атомы в которых соединены между собой ковалентными (атомными) связями)могут служить алмаз, германий и кремний. Электроотрицательность - мера способности атома в веществе притягивать к себе общие электронные пары. По характеру перекрывания электронных облаков ("орбиталей") ковалентная связь делится на Ковалентная связь обладает направленностью и насыщаемостью, а также поляризуемостью.
Кристаллическая решетка со строго определенными параметрами и повторением совершенно одинаковых элементарных ячеек является условной схемой, в действительности кристаллы всегда имеют отклонения от этой схемы. Вполне упорядоченное расположение частиц отвечает идеальным кристаллам, к которым более или менее приближаются встречающиеся в природе и получаемые искусственно реальные кристаллы. Нарушения в идеальном расположении атомов в кристаллах называют дефектами. Они оказывают большое, иногда решающее влияние на свойства кристаллических веществ. Неправильное расположение отдельных атомов в кристаллической решетке создает точечные дефекты. В кристалле, состоящем из одинаковых атомов, например в кристалле металла, в каком-то участке решетки может отсутствовать один из атомов. На его месте будет полость, вокруг нее - искаженная структура (рис. 1.82 а). Такой дефект называется вакансией. Если же атом вещества или примеси попадает между атомами в узлах решетки (рис. 1.82 б), то возникает дефект внедрения. В ионных кристаллах, в которых должна соблюдаться электронейтральность, образование дефектов связано с перераспределением зарядов. Так, появление вакансии катиона сопровождается возникновением вакансии аниона (рис. 1.83 а), такой тип дефекта в ионном кристалле называется дефектом по Шоттки. Внедрение иона в междоузлие сопровождается появлением на его прежнем месте вакансии, которую можно рассматривать как центр заряда противоположного знака (см. рис. 1,83 б), такой дефект называют дефектом по Френкелю. Рис. 1.82. Точечные дефекты в металлической кристаллической решетке: а - вакансия; б - дефект внедрения Рис. 1.83. Точечные дефекты в ионных кристаллах: a- дефект по Шоттки; б - дефект по Френкелю; пунктиром показаны вакансии Точечные дефекты возникают по разным причинам, в том числе и в результате теплового движения частиц. Вакансии (а также дефекты внедрения) могут перемещаться по кристаллу - в полость попадает соседний атом, его местоосвобождается и т. д. Перемещением вакансий объясняется диффузия в твердых телах и ионная проводимость кристаллов солей и оксидов, которые становятся заметными при высоких температурах. Дефекты по Френкелю всегда образуются в результате перемещения катионов, которые обычно значительно меньше анионов и легче внедряются в решетку. Такие дефекты характерны, например, для AgBr, концентрация ионов Ag+ в междоузлиях кристаллов этой соли при 210 и 300°С составляет соответственно 0,076 и 0,4%. Возникновению дефектов по Френкелю способствует малый радиус катионов и легкая деформируемость, т. е. высокая поляризуемость анионов. Наоборот, дефекты по Шоттки характерны для соединений, катионы и анионы которых имеют примерно одинаковые размеры и мало поляризуемы, что затрудняет их внедрение. Отсутствие атома (иона) одного из элементов соединения в некоторых узлах его кристаллической решетки обусловливает изменение его состава - отклонение от стехиометрии*. Известен ряд веществ, в кристаллах которых дефектов по Шоттки так много, что отклонения от стехиометрии легко определяются химическим анализом. В зависимости от условий получения и роста кристаллов число вакансий может быть различным, поэтому нестехиометрические соединения обычно имеют непостоянный состав. К числу таких веществ относятся оксид и карбид титана. Их состав можно выразить в общем виде формулами ТiOх, x = 0,70. 1,30 и TiCx, x= 0,60. 1,00. Отклонения от стехиометрии могут быть связаны и с дефектами внедрения, возможны также различные комбинации двух рассмотренных механизмов. Известны также линейные, поверхностные и объемные дефекты. Среди неорганических веществ имеется огромное число нестехиометрических соединений, таковыми, в частности, являются большинство оксидов, нитридов, гидридов, карбидов и силицидов d-элементов.
Важной энергетической характеристикой кристаллов является энергия кристаллической решетки, измеряемая работой, которую необходимо совершить для разделения кристалла на ионы и удаленияих на бесконечно большое расстояние друг от друга. Эту величину обычно относят к одному молю вещества. * Стехиометрия - учение о количественных соотношениях между веществами, участвующими в химической реакции. Включает законы сохранения массы, постоянства состава, эквивалентов и кратных соотношений (законы стехиометрии). Энергия кристаллической решетки может быть найдена из экспериментальных данных. Для этого требуется знание энергетических эффектов ряда процессов, совокупность которых может быть представлена схемой, называемой циклом Борна-Габера. Разберем этот цикл на примере процесса образования хлорида натрия: Согласно представленному циклу процесс образования кристаллического хлорида натрия из твердого металлического натрия и газообразного хлора возможен по двум путям. Первый путь состоит в превращении натрия и хлора в состояние ионов Na+ и Сl- и образовании из них твердого хлорида натрия. В соответствии с определением понятия «энергия кристаллической решетки» при образовании NaCl из газообразных ионов выделяется энергия, равная по абсолютной величине энергии кристаллической решетки U0. Для получения ионов натрия требуется перевести металлический натрий в газообразное состояние, на это затрачивается теплота возгонки ∆H°возг, затем нужно подвергнуть атомы ионизации, что требует энергии ионизации INa. Для получения хлорид-ионов необходимо сначала разорвать связь в молекуле Cl2 (на получение 1 моль Сl потребуется энергия, равная половине энергии связи Сl−Сl, т. е. 1/2Eсв), затем к атому хлора нужно присоединить электрон (оторванный от атома натрия), при этом выделяется энергия сродства к электрону ECl. Все указанные здесь величины могут быть измерены. Второй путь состоит в непосредственном получении кристаллического NaCl из газообразного хлора и кристаллического натрия. Тепловой эффект данного процесса сравнительно легко может быть измерен - это теплота образования хлорида натрия из простых веществ ∆H°f. Согласно закону сохранения энергии тепловой эффект реакции не зависит от пути, по которому проходит процесс, а определяется только начальным и конечным состоянием системы. Поскольку в обоих рассмотренных вариантах процесса конечное и начальное состояния одинаковы, то суммарный энергетический эффект первого процесса равен тепловому эффекту второго, т. е. теплоте образования NaCl из простых веществ. Таким образом, можно записать: ∆H°f = ∆H°возг + INa + 1/2Eсв − ECl − U0, откуда U0 = −∆H°f + ∆H°возг + INa + 1/2Eсв − ECl. (1.67)
Значения энергии кристаллической решетки для некоторых соединений, найденные из экспериментальных данных, приведены в табл. 1.15. Как видно, для солей, состоящих из однозарядных ионов, это значения порядка 800 кДж/моль, для веществ, содержащих многозарядные ионы, они значительно больше. Известны различные методы теоретического вычисления энергии кристаллической решетки. Наиболее прост расчет по уравнению, предложенному в 1943 г. А. Ф. Капустинским: U0 = ανZkZa (1- ρ/(rk + ra) rk + ra где Z и r - заряды и радиусы ионов (индексы к и а относятся к катиону и аниону); α и ρ- константы, если U0 выражено в кДж/моль, а r - в пм, то α = 1,214·105, ρ = 34,5; ν-суммарное фчисло ионов в химической формуле кристалла.
Вода в ионных кристаллах Ионные кристаллы. В узлах кристаллической решетки ионных кри-сталлов находятся ионы. Ионы располагаются так, что силы кулоновского притяжения между ионами противоположного знака больше, чем силы от-талкивания между ионами одного знака. Таким образом, ионная связь (она также называется полярной, гетерополярной) обусловлена преимуществен-но электростатическим взаимодействием противоположно заряженных ио-нов. Ионная связь является типичной для неорганических соединений. Силы электростатического притяжения и отталкивания между ионами обладают сферической симметрией, и поэтому ионы разных знаков ведут себя подобно твердым шарам, притягивающимся друг к другу. Возникает естественный вопрос: почему многие атомы легко присоединя-ют электрон и становятся электроотрицательными ионами (как, например, хлор)? Казалось бы, у нейтрального атома нет сил кулоновского взаимо-действия с электроном. На самом деле, действительно, взаимодействие ней-трального атома с электроном не является следствием статического притя-жения. Электрон наводит в атоме электрический днпольный момент, в ре-зультате чего возникает потенциал притяжения, пропорциональный 1/г* и действующий на больших расстояниях. Во многих случаях этот поляризаци-онный потенциал притяжения достаточно велик для того, чтобы свободный атом смог присоединить добавочный электрон. Число ионов противоположного знака, которое составляет ближайшее ок-ружение данного иона в кристалле, называется координационным числом К. Значение координационного числа определяется величиной отношения ра-диусов ионов противоположного знака гл/гд. Чем ближе это отношение к единице, тем больше К. Так, например, при равенстве ионных радиусов (гл = гд) К = 12, при гд/гв < 0,22 координационное число К -- 2. Достаточно хорошей моделью ионных кристаллов является модель твер-дых шаров. Это связано с тем, что степень ионизации атомов, составляющих ионный кристалл, часто такова, что электронные оболочки всех ионов со-ответствуют электронным оболочкам, характерным для атомов инертных газов. Так, например, электронная оболочка иона Na+ подобна Ne, иона С1~ -- Аг, и тем самым ионный кристалл состоит как бы из сферических заряженных атомов. Поэтому тип решетки ионных кристаллов практически определяется соотношением ионных радиусов. Например, кристаллы хло-ристого натрия имеют структуру граненентрированной кубической решетки вследствие того, что размер иона хлора (1,81 А) почти вдвое превышает раз-мер иона натрия (0,98 А); при таком соотношении ионных радиусов в центре кубической ячейки хлористого натрия свободное пространство оказывается недостаточным для размещения еще одного иона и образования объсмноцен-трированной ячейки. Иначе обстоит дело с кристаллом хлористого цезия. Размеры ионов хлора и цезия близки (1,81 и 1,65 А), пространство и центре элементарного куба оказывается достаточным для размещения еще одно-го иона, и энергетически выгоднее оказывается более плотно упакованная структура -- объемноцептрированный куб.
|
||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 563; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.42.34 (0.012 с.) |


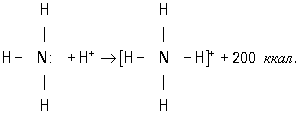

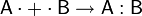


 + и
+ и  .
. -связь и
-связь и  -связь.
-связь.


