
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчеты в объемном методе анализаСодержание книги
Поиск на нашем сайте
В объемном методе, как и в весовом, рассчитывают или массу определяемого вещества (mA) или его массовую долю (ХА). Массу анализируемого вещества рассчитывают по формуле:
где V – объем титранта см3; С – нормальная концентрация, моль·экв/дм3; MЭА – масса -эквивалента анализируемого вещества, г. Массу анализируемого вещества рассчитывают по формуле
где a – масса вещества (г), взятого для анализа. Если для анализа взята лишь часть анализируемого раствора, то: где V1 – общий объем анализируемого раствора, см3; V2 – объем анализируемого раствора, взятого для титрования, см3. Часто в объемном методе рассчитывают титр одного вещества по другому: Тa/b где С на – нормальная концентрация вещества а; Мэв – масса -эквивалента вещества в. Тогда массу анализируемого вещества можно рассчитать по формуле
Кислотно-основное титрование
В основе кислотно-основного титрования лежит реакция:
По этому методу можно проводить количественное определение оснований, титруя их кислотами с известной концентрацией, и кислот, титруя их основаниями с известной концентрацией. В случае, если титрантом является кислота, метод называют ацидиметрическим (acidium – кислота), а если основание – алкалиметрическим (alkali – щелочь). Основными титрантами являются HCl, или H2SO4 (в ацидиметрии), или NaOH и KOH (в алкалиметрии). Эти вещества не отвечают требованиям, предъявляемым к стандартам, поэтому их концентрацию предварительно устанавливают по первичным стандартам. Стандартизация – определение нормальности и Т раствора, титранта по первичным стандартам. Стандартными для кислотно-основного титрования являются растворы сильных кислот и оснований, т.к. заметное изменение pH в области точки эквивалентности наблюдается в том случае, если в реакции участвует сильная кислота или сильное основание. Для приготовления растворов первичных стандартов с определенной концентрацией берут навеску первичного стандарта, помещают в мерную колбу, доводят объем раствора водой до метки. Затем отбирают часть раствора первичного стандарта и оттитровывают его титрантом, концентрацию которого необходимо определить. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 2. 1 Лабораторная работа № 1 «Ацидиметрия» (6 часов) Краткая характеристика метода При определении в растворах концентрации различных оснований (гидроксида натрия, калия, кальция, аммиака в нашатырном спирте) солей, имеющих вследствие гидролиза щелочную реакцию, а также для определения жесткости воды применяют в качестве рабочих растворов растворы сильных кислот (например, НС1, Н2SO4). Эти определения составляют ацидиметрию. Для определения концентрации кислот пользуются тетраборатом натрия Ма2В4О7•10H2O (бура), безводным карбонатом натрия Na2СО3 (сода), КJO3 (иодатом калия) и др. Наиболее удобен для определения концентрации НС1 тетраборат натрия, т.к. путем перекристаллизации эту соль легко получить химически чистой и точно соответствующей своей формуле Nа2В4О7•10H2O. 2.1.2 Приготовление 0,1 н раствора буры (Nа2В4О7•10H2O) По точной навеске Для приготовления раствора навеску буры рассчитывают по формуле СБ · МЭБ · V mбуры = ________________, где СБ – нормальная концентрация тетрабората натрия, моль·экв/дм3; V– объём мерной колбы, см3; МЭБ – масса эквивалента тетрабората натрия, г/моль. МЭ(Nа2В4О7•10H2O) = 1/2М(Nа2В4О7•10H2O)= 190,69 г/моль. Навеску взвешивают на технических весах (1,9 г), высыпают в сухой бюкс и взвешивают на аналитических весах с точностью до четвертого знака после запятой. Записывают полученный результат в журнал, отвешенную соль высыпают в мерную колбу на 100 см3 через сухую чистую стеклянную воронку. После этого бюкс вновь взвешивают на аналитических весах и по разности находят массу соли, внесенные в мерную колбу. Соль тщательно смывают со стенок воронки внутрь колбы горячей дистиллированной водой, добавляют воды до половины объема колбы. Перемешивают содержимое колбы вращательным движением. После полного растворения навески раствор охлаждают до комнатной температуры, разбавляют водой до метки, закрывают колбу пробкой и тщательно перемешивают. По навеске рассчитывают титр (Т Б) и нормальную концентрацию (С Б) раствора буры по формуле Т Б = или С Б =
|
||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 131; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.254.35 (0.006 с.) |

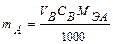 ,
,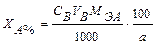 ,
,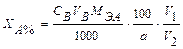 ,
,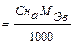 ,
,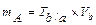 .
.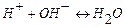 .
. г/см3;
г/см3; 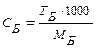 моль·экв/дм3
моль·экв/дм3 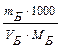 моль·экв/л.
моль·экв/л.


