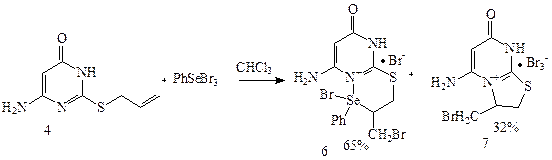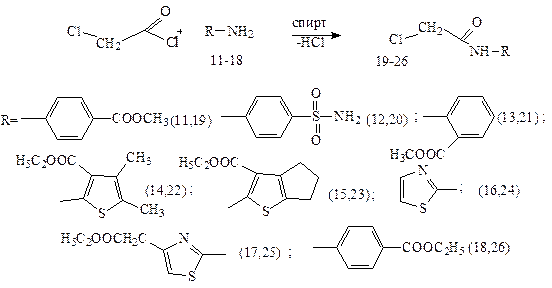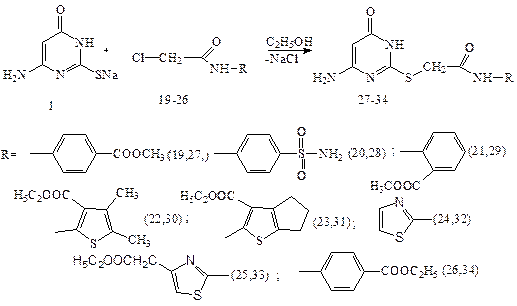Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обговорення отриманих результатів
Відомо, що піримідинове кільце досить поширене в природі і проявляє біологічну активність [32, c. 1856]. Метою даного дослідження є вивчення реакцій похідних 4-аміно-2-тіо-1,6-піримідинонів з електрофільними реагентами (бром, фенілселентрибромід), вивчені хімічні властивості одержаних сполук. Також, ми планували одержати нові неописані в літературі ацетамідні фрагменти на основі нашої сполуки, адже відомо що ацетамідні фрагменти відіграють надзвичайно важливу роль в біологічних процесах (наприклад, утворення пептидного зв’язку). За мету, ми ставили встановлення будови отриманих продуктів та вивчити їх стійкість в органічних розчинниках. Розрахувати імовірність прояву біологічної активності та провести відповідне біологічне дослідження. Синтез вихідного 4-аміно-2-тіо-1,6-піридинону здійснили за відомою методикою [1] із тіосечовини та етилового спирту ціаноцтової кислоти, металічним натрієм в середовищі етилового спирту. Одержану натрієву сіль 1 виділили з реакційного середовища фільтруванням. Вона представляє собою жовті голкоподібні кристали. До фільтрату прилили 10 % оцтову кислоту і утворений білий осад тіону-2 відфільтрували, промили на фільтрі етанолом та дистильованою водою. Його очистку проводили перекристалізацією з льодяної оцтової кислоти. Індивідуальність вихідних сполук була підтверджена даними: температури топлення та ПМР спектрами (Схема 2.1.). Схема 2.1.
Проведено алкілування натрієвої солі 1 алілбромідом, пропаргіл бромідом. З виходом 75% одержали продукт 3. Реакцію алкілування проводили шляхом нагрівання вихідної сполуки в середовищі етанолу протягом 1 години (Схема 2.2.) [33, c. 4716]. Схема 2.2.
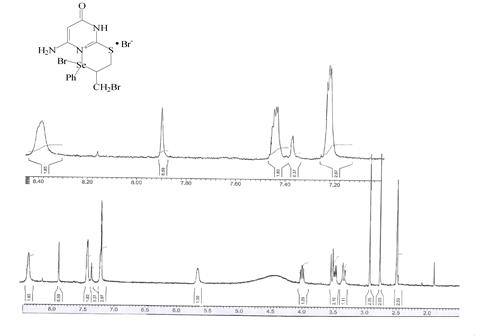
Для прикладу, можна навести ПМР спектр алілового тіоетеру вихідного піримідинону 4, спостерігаються чіткі групи сигналів характерному алільному фрагменту при 3,74; 5,09; 5,31; 5,92 м.ч. та група сигналів характерних протонам піримідинового кільця (див. рис. 1).
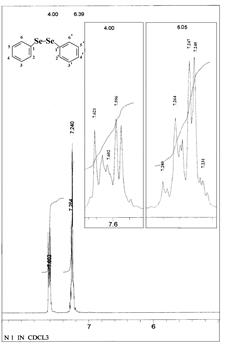
Рисунок 1. ЯМР 1Н спектр сполуки 4. Вихідний фенілселентрибромід був одержаний за допомогою магній-органічного синтезу з бромбензену, магнію та порошкоподібного чорного селену в середовищі безводного етеру. Вихід дифенілдиселенід склав 65%. При бромуванні в безводному холоформі дифенілдиселеніду з виходом 92% отримано фенілселентрибромід темно-червоного кольору. Чистоту та ідентичність дифенілселентриброміду підтверджено ПМР спектром (Схема 2.3.).
Схема 2.3.
Ідентичність проміжкового дифенілдиселеніду та вихідного фенілселентриброміду була підтверджена ПМР спектрами (див. рис. 2) та спектрами ЯМР 77Se та ЯМР 13С фенілселентриброміду (див. рис. 3).
Рисунок 2. ЯМР Н спектри дифенілдиселеніду та фенілселентриброміду.
а)
Рисунок 3. Спектр ЯМР 13С (а) та ЯМР 77Se (б) фенілселентриброміду.
Вивчено реакцію фенілсентриброміду з алілтіоетером 4. Її проводили в безводному хлороформі при постійному перемішуванні протягом 24 годин. Утворений селенвмісний гетероцикл 6, а продукт 7 випадав в осад у вигляді жовтого порошку. Виходи продуктів селенвмісного – становить 65%, а бромвмісного – 32%. Одночасне утворення в реакційному середовищі селен- та бромвмісних гетероциклів 6 та 7 можна пояснити низькою стійкістю селенвмісного гетероциклу 6. Адже відомо, що у попередніх дослідження наукового керівника було проведено ґрунтовне дослідження цього явища і встановлено, що під дією ацетону відбувається відщеплення фенілселененілброміду і утворюється галогеновмісний гетероцикл (Схема 2.4.) [34, c. 25]. Схема 2.4.
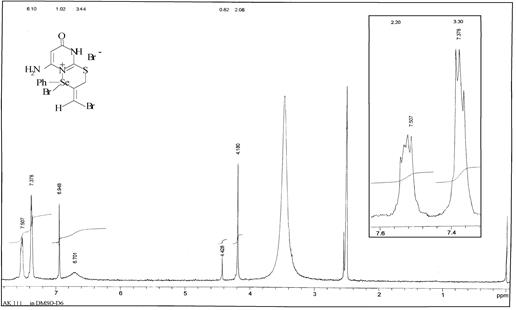
У ПМР спектрі селеновмісного гетероциклу 6 відсутні характерні групи сигналів алільного фрагмену, що спостерігаються у вихідній сполуці, а з’являються сигнали протонів фенольної групи що свідчить про утворення селеновмісних гетероциклічних систем. Зроблений елементний аналіз на азот та характерних сигналів ПМР спектрів підтверджено запропоновану структуру даного гетероциклу (див. рис. 4).
Рисунок 4. ЯМР 1Н спектр сполуки 6.
Реакцією пропаргіл тіоетеру 1,6-піримідинону з фенілселентрибромідом з виходом 51 % одержують селенвмісний гетероцикл 8 та з 41% бром циклічний продукт 9. При 30 хв. перемішуванні при кімнатній температурі продукту 8 в ацетоні, відбувається знебарвлення вмісту реакційної колби і випадав монобромід 10. Слід наголосити, що пряме бромування сполуки 5 приводить до утворення смоли, яку перевести в твердий стан нам не вдалося, проте можна зробити припущення, що галоген крім реакції з участю потрійного зв’язку та послідуючою гетероциклізацією з утворенням тіазинового кільця взаємодіє з піримідиновим кільцем з утворенням продукту 9а (Схема 2.5.).
Такі припущення ми робимо на підставі ПМР спектра цієї смолоподібної речовини 9а, де в області ароматичних протонів відсутній сигнал, який був у вихідних продуктах. Таким чином, фенілселентрибромід може бути використаний в якості проміжкових сполук для одержання бромвмісної гетероциклічної сполуки 10, оскільки пряме бромування веде до утворення смолоподібних продуктів (Схема 2.6.). Схема 2.5.
Схема 2.6.
Будову селеновмісного гетероциклу 8 підтверджено ПМР спектром (див. рис. 5), в якому видно усі характерні сигнали запропонованої структури.
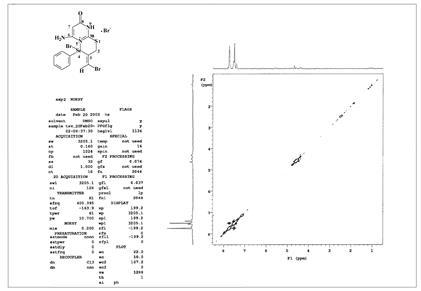
Рисунок 5. ЯМР 1Н спектр сполуки 8. Склад селеновмісного гетероциклу 8 підтверджено елементним аналізом на нітроген, а просторову будову – двомірним спектром NOESY. Так в ПМР спектрі присутні усі характерні сигнали даної сполуки. В двохмірному спектрі NOESY відсутні сигнали крос-піків, що свідчать про запропоновану нами просторову будову, оскільки в іншому випадку протон бромметиліденової групи взаємодіяв би із близько розташованими протонами інших груп і в цьому спектрі ми б спостерігали інші крос-піки (див. рис. 6).
Рисунок 6. Двомірний NOESY спектр 4-бромо-4-феніл-6-аміно-3-[(Е)-1-бромометилідено]-8-оксо-2,3,8,9-тетрагідропіримідо[2,1-b][1,4,3]тіаселена зин-5-іум броміду 8. Подальше наше дослідження було присвячене ацетамідним похідним 1,6-піримідинону. Для цього ми спочатку провели взаємодію хлорангідриду хлороцтової кислоти з амінами 11-18. Продукти 19-26 були виділенні з виходом 80-92 %. Вони являли собою сполуки білого кольору, які стійкі на повітрі тривалий час (Схема 2.6.). Схема 2.6.
На рисунку 7 представлено ПМР спектр продукту 21. Характер сигналів та їх кількість свідчить про високу чистоту та його індивідуальність.
Рисунок 7. ЯМР 1Н спектр сполуки 21.
Взаємодія натрієвої солі 1 з сполуками 19-26 проводили в середовищі етанолу при нагріванні протягом 1 години. Синтезовані ацетамідні сполуки 27-34 випадали з реакційного середовища, їх відфільтровували, промивали спиртом, водою та сушили на повітрі при 60 °С (Схема 2.7.). Схема 2.7.
На рисунку 8 представлений спектр ПМР одного з одержаних продуктів 34. Характеристичним в цьому спектрі є сигнали протону амідної групи при 11,50 м.ч.
Рисунок 8. ЯМР 1Н спектр сполуки 34.
|
||||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 194; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.86.56 (0.008 с.) |
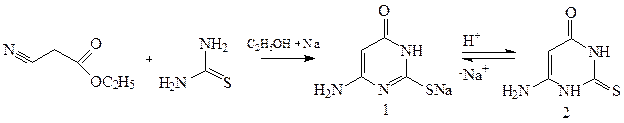




 б)
б)