
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Понятие идеального газа. Молекулярно-кинетическое толкование температуры. Макроскопические параметры системы.Содержание книги
Поиск на нашем сайте
Вопросы рейтинг-контроля № 2 (Основы молекулярной физики и термодинамики) Понятие идеального газа. Молекулярно-кинетическое толкование температуры. Макроскопические параметры системы. Идеальный газа - это газ, состоящий из точечных материальных частиц с конечной массой, силами взаимодействия между которыми можно пренебречь, и которые сталкиваются между собой по законам соударения упругих шаров. Следовательно, молекулы идеального газа обладают только кинетической энергией, поскольку потенциальной энергией взаимодействия молекул можно пренебречь. Любая молекула в любой момент времени может находиться в любом месте предоставленного объёма. Идеального газа в природе не существует. Температура (от лат. temperatura — надлежащее смешение, соразмерность, нормальное состояние), физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. Температура одинакова для всех частей изолированной системы, находящейся в равновесии термодинамическом. Средняя кинетическая энергия теплового движения пропорциональна температуре системы. Температуру можно измерить только косвенным путём. В состоянии, сколь угодно близком к равновесию, температура не может быть измерена. При низкой числовой плотности газа n (в идеально-газовом состоянии) для давления р выполняется соотношение: р = nkТ. Любой материальный объект, любое тело или совокупность тел, состоящих из большого числа частиц, называется макроскопической системой. Состояние системы определяется совокупностью ее свойств. Признаки, характеризующие состояние системы, например, температура, давление, объем или процентный состав, называются термодинамическими параметрами. Величины, определяемые положением не входящих в нашу систему внешних тел, называются внешними параметрами, например напряженность силового поля, объем системы и т.д. Следовательно внешние поараметры являются функциями координат внешних тел. Величины, определяемые совокупным движением и распределением в пространстве входящих в систему частиц, называются внутренними параметрами, например энергия, давление, плотность, намогниченность, поляризованность и т.д. (зависят от движения и положения частиц системы и входящих в них зарядов). В зависимости от условий, в которой находится система один и тот-же параметр может быть внешним и внутренним. Внутренние параметры системы разделяются на интенсивные и экстенсивные. Параметры не зависящие от массы и числа частиц в системе, называются интенсивными (давление, температура и др.). Параметры пропорциональные массе или числу частиц в системе, называются аддитивными или экстенсивными (энергия, энтропия и др.). Экстенсивные параметры характеризуют систему как целое, в то время как интенсивные могут принимать определенные значения в каждой точке системы.
Внутренняя энергия идеального газа. Число степеней свободы. Закон Равнораспределения энергии. Внутренней энергией тела называется энергия, зависящая только от термодинамического состояния тела. Она зависит только от характера и в/д частиц в системе и состоит из следующий частей:- Кинетической энергии теплового хаотического движения частиц, образующих молекул и атомов и т.д- Потенциальной энергией частиц, обусловленный силами их межмолекулярного в/д. - Энергии электронов в электронных оболочках атомов и молекул.- Внутриядерная энергия. Те части внутренней энергии зависят от того в каком состоянии находится энергия. Т.е. внутренняя энергия определяется термодинамическим состоянием системы и не зависит от того как система оказалась в данном состоянии. V=i/2*k*Na*T=i/2*RT, где R=k*Na=8.31 Числом степеней свободы тела называют наименьшее число координат, которые необходимо задать для того, чтобы полностью определить положение тела в пространстве. Абсолютно твердое тело имеет шесть степеней свободы: для определения его положения в пространстве нужно задать три координаты центра масс тела, две координаты, определяющие положение в пространстве определенной оси, проходящей через центр масс и какую-либо другую фиксированную точку тела, и, наконец, нужно еще задать угол поворота тела вокруг этой оси по отношению к некоторому начальному положению. Следовательно, абсолютно твердое тело обладает тремя степенями свободы посту нательного движения и тремя степенями свободы вращательного движения. i=i пост+i вращ + 2i колебЗакон равнораспределения энергии: Для системы N молекул, имеющих s степеней свободы каждая, и находящейся в тепловом равновесии при температуре, средняя механическая энергия <E> равна s(kT/2). Количество степеней свободы – это количество неизменных переменных, с помощью которых можно охарактеризовать положения объекта и расположение его частей в пространстве. Формулу для средней кинетической энергии поступательного движения атомов одноатомного газа можно записать в виде <E> = 3(kT/2). На каждую степень свободы приходится в среднем энергия i/2*kT, где i-степень свободы.
Давление газа с точки зрения молекулярно-кинетической теории. Основное Характеристика жидкого состояния. Ближний порядок. Жидкость является агрегатным состоянием вещества, промежуточным между газообразным и твердым, поэтому она обладает свойствами как газообразных, так и твердых веществ. Жидкости, подобно твердым телам, обладают определенным объемом и малосжимаемы. Обладают сравнительно большой плотностью, способны сопротивляться не только сжатию, но и растяжению. Подобно газам, принимают форму сосуда, в котором они находятся, т.е. обладают текучестью. Имеют определенный объем. Одно из важнейших свойств именно жидкости - ее поверхностное натяжение (это свойство не присуще ни газам, ни твердым веществам). Поверхностное натяжение - это минимальная сила, сдерживающая движение частиц жидкости в глубину жидкости и тем самым удерживающая поверхность жидкости от сокращения. Характер расположения частиц жидкости промежуточен между газом и твердым телом. В газах молекулы движутся хаотично, поэтому нет никакой закономерности в их взаимном расположении. В жидкостях имеет место так называемый ближний порядок в расположении частиц, т. е. их упорядоченное расположение, повторяющееся на расстояниях, сравнимых с межатомными. Поверхностное натяжение. Силы, возникающие на кривой поверхности Упругие свойства твердых тел. Растяжение и сжатие. Закон Гука. Сдвиг. Кручение. Изгиб. Деформацией называют изменение формы, размеров или объема тела. Деформация может быть вызвана действием на тело приложенных к нему внешних сил. Деформации, полностью исчезающие после прекращения действия на тело внешних сил, называют упругими, а деформации, сохраняющиеся и после того, как внешние силы перестали действовать на тело, - пластическими. Различают деформации растяжения или сжатия, изгиба, кручения и сдвига.При деформациях твердого тела его частицы (атомы, молекулы, ионы), находящиеся в узлах кристаллической решетки, смещаются из своих положений равновесия. Этому смещению противодействуют силы взаимодействия между частицами твердого тела. Поэтому при любом виде упругой деформации в теле возникают внутренние силы, препятствующие его деформации. Закон гука: Сила упругости прямо пропорциональна величине деформации. F упр = k | x |, где k -коэффициент упругости или жесткость пружины (ед.изм. в СИ - 1 Н/м)
Адиабатический процесс. Адиабатический процесс (адиабатный процесс) - термодинамический процесс, происходящий в системе без теплообмена с окружающей средой (
22. Цикл Карно и его КПД для идеального газа. Это обратимый круговой процесс, состоящий из двух изотермических и двух адиабатных процессов; впервые рассмотрен французским инженером Л. С. Карно (1824 г.) всвязи с определением КПД тепловых машин. КПД Карно цикла не зависит от свойств рабочего тела (пара, газа и т. п.) и определяется температурами теплоотдатчика Т1 и теплоприемника Т2= (Т1-Т2)/Т1. КПД любой тепловой машины не может быть больше КПД Карно цикла (при тех же Т1 и Т2). Термический КПД цикла Карно, определяется по формуле: 5. Динамические и статистические закономерности в физике. Статистический метод исследования системы. Понятие о функции распределения. две осн. формы закономерной связи явлений, которые отличаются по характеру вытекающих из них предсказаний. В законах динамич. типа предсказания имеют точно определённый, однозначный характер. Так, в механике, если известен закон движения тела и заданы его координаты и скорость, то по ним можно точно определить положение и скорость движения тела в любой др.момент времени. Динамич. законы характеризуют поведение относительно изолированных систем, состоящих из небольшого числа элементов и в которых можно абстрагироваться от целого ряда случайных факторов. В статистич. законах предсказания носят не достоверный, а лишь вероятностный характер. Подобный характер предсказаний обусловлен действием множества случайных факторов, которые имеют место в статистич. коллективах или массовых событиях(напр., большого числа молекул в газе, особей в биологич. популяциях, людей в социальных коллективах). Статистич. закономерность возникает как результат взаимодействия большого числа элементов, составляющих коллектив, и поэтому характеризует не столько поведение отд. элемента, сколько коллектива в целом. Необходимость, проявляющаяся в статистич. законах, возникает вследствие взаимной компенсации и уравновешивания множества случайных факторов. Абсолютизация динамич. законов тесно связана с концепцией механич. детерминизма, сторонники которой (П. Лаплас и др.)рассматривали Вселенную как огромную механич. систему и экстраполировали законы динамики Ньютона на все процессы и явления мира. Лаплас утверждал, что если бы были известны такие законы для всех явлений, то можно было бы обнять в одной формуле движения как величайших тел, так и лег-чайших атомов. Статистич. законы хотя и не дают однозначных и достоверных предсказаний, тем не менее являются единственно возможными при исследовании массовых явлений случайного характера. Критикуя механич. детерминизм, Ф. Энгельс указывал, что случайное не может быть безразличным для науки. Вместе с тем он подчёркивал, что случайное требует иного подхода, ибо изучить всю сеть каузальных отношений, даже с горошинами в стручке, наука совершенно не в состоянии: «... такая наука, которая взялась бы проследить случай с этим отдельным стручком в его каузальном сцеплении со все более отдаленными причинами, была бы уже не наукой, а простой игрой» (Маркс К. и Энгельс Ф., Соч., т. 20, с. 534). За совокупным действием различных факторов случайного характера, которые практически невозможно охватить, статистич. законы вскрывают нечто устойчивое, необходимое, повторяющееся. Статистические законы служат подтверждением диалектики превращения случайного в необходимое. Динамич. законы оказываются предельным случаем статистических, когда вероятность становится практич. достоверностью. С помощью динамич. законов обычно формулируются каузальные (причинные) связи явлений. Рассматривая одно явление как причину другого, мы вырываем их из всеобщей связи, изолируем друг от друга и тем самым значительно упрощаем и идеализируем действительность. Подобную идеализацию легче осуществить в механике, астрономии, классич. физике, которые имеют дело с точно известными силами и законами движения тел под их воздействием. В более сложных ситуациях приходится учитывать воздействие множества случай-ных факторов и обращаться к статистич. законам.
6. Распределение Максвелла. Средние скорости молекул. МА́КСВЕЛЛА РАСПРЕДЕЛЕ́НИЕ, распределение по скоростям частиц (молекул) макроскопической физической системы, находящейся в состоянии термодинамического равновесия, (в отсутствии внешнего поля, при условии, что движение частиц подчиняется законам классической механики. Установлено Дж. К. Максвеллом) в 1859. Закон Максвелла о распределении молекул идеального газа) по скоростям основан на предположениях, что газ состоит из большого числа N одинаковых молекул, его температура постоянна, а молекулы совершают тепловое хаотическое движение. При этом на газ не действуют силовые поля. Функция распределения молекул по скоростям f(v)=dN(v)/Ndv определяет относительное число молекул dN(v)/N, скорости которых лежат в интервале от v до v+dv и имеет смысл плотности вероятности Для газа, подчиняющегося классической механике, в состоянии статистического равновесия функция распределения f Максвелла по скоростям имеет вид: Средние скорости молекул.
Вопросы рейтинг-контроля № 2 (Основы молекулярной физики и термодинамики) Понятие идеального газа. Молекулярно-кинетическое толкование температуры. Макроскопические параметры системы. Идеальный газа - это газ, состоящий из точечных материальных частиц с конечной массой, силами взаимодействия между которыми можно пренебречь, и которые сталкиваются между собой по законам соударения упругих шаров. Следовательно, молекулы идеального газа обладают только кинетической энергией, поскольку потенциальной энергией взаимодействия молекул можно пренебречь. Любая молекула в любой момент времени может находиться в любом месте предоставленного объёма. Идеального газа в природе не существует. Температура (от лат. temperatura — надлежащее смешение, соразмерность, нормальное состояние), физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. Температура одинакова для всех частей изолированной системы, находящейся в равновесии термодинамическом. Средняя кинетическая энергия теплового движения пропорциональна температуре системы. Температуру можно измерить только косвенным путём. В состоянии, сколь угодно близком к равновесию, температура не может быть измерена. При низкой числовой плотности газа n (в идеально-газовом состоянии) для давления р выполняется соотношение: р = nkТ. Любой материальный объект, любое тело или совокупность тел, состоящих из большого числа частиц, называется макроскопической системой. Состояние системы определяется совокупностью ее свойств. Признаки, характеризующие состояние системы, например, температура, давление, объем или процентный состав, называются термодинамическими параметрами. Величины, определяемые положением не входящих в нашу систему внешних тел, называются внешними параметрами, например напряженность силового поля, объем системы и т.д. Следовательно внешние поараметры являются функциями координат внешних тел. Величины, определяемые совокупным движением и распределением в пространстве входящих в систему частиц, называются внутренними параметрами, например энергия, давление, плотность, намогниченность, поляризованность и т.д. (зависят от движения и положения частиц системы и входящих в них зарядов). В зависимости от условий, в которой находится система один и тот-же параметр может быть внешним и внутренним. Внутренние параметры системы разделяются на интенсивные и экстенсивные. Параметры не зависящие от массы и числа частиц в системе, называются интенсивными (давление, температура и др.). Параметры пропорциональные массе или числу частиц в системе, называются аддитивными или экстенсивными (энергия, энтропия и др.). Экстенсивные параметры характеризуют систему как целое, в то время как интенсивные могут принимать определенные значения в каждой точке системы.
|
||||
|
Последнее изменение этой страницы: 2016-06-22; просмотров: 1344; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.186.26 (0.008 с.) |

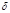 Q=0), т. е. в адиабатически изолированной системе, состояние которой можно изменить только путем изменения внешних параметров. Понятие адиабатической изоляции является идеализацией теплоизолирующих оболочек или сосудов Дьюара (адиабатные оболочки). Изменение температуры внешних тел не оказывает влияния на адиабатически изолированной системы, а их энергия U может изменяться только за счет работы, совершаемой системой (или над ней). Согласно первому началу термодинамики, при обратимом адиабатическом процессе для однородной системы: dQ=dU+pdV=0, где V - объем системы, p - давление. Согласно второму началу термодинамики, при обратимом адиабатическом процессе энтропия постоянна, dS=dQ/T=0, а при необратимом - возрастает. Очень быстрые процессы, при которых не успевает произойти теплообмен с окружающей средой, например, при распространении звука, можно рассматривать как адиабатический процесс. Простым примером адиабатического процесса является сжатие (или расширение) газа в теплоизолированном цилиндре с теплоизолированным поршнем.
Q=0), т. е. в адиабатически изолированной системе, состояние которой можно изменить только путем изменения внешних параметров. Понятие адиабатической изоляции является идеализацией теплоизолирующих оболочек или сосудов Дьюара (адиабатные оболочки). Изменение температуры внешних тел не оказывает влияния на адиабатически изолированной системы, а их энергия U может изменяться только за счет работы, совершаемой системой (или над ней). Согласно первому началу термодинамики, при обратимом адиабатическом процессе для однородной системы: dQ=dU+pdV=0, где V - объем системы, p - давление. Согласно второму началу термодинамики, при обратимом адиабатическом процессе энтропия постоянна, dS=dQ/T=0, а при необратимом - возрастает. Очень быстрые процессы, при которых не успевает произойти теплообмен с окружающей средой, например, при распространении звука, можно рассматривать как адиабатический процесс. Простым примером адиабатического процесса является сжатие (или расширение) газа в теплоизолированном цилиндре с теплоизолированным поршнем. =(Q1-Q2)/ Q1 = A/Q1 (КПД любой тепловой машины). Работа совершаемая газом в изотермических процессах:
=(Q1-Q2)/ Q1 = A/Q1 (КПД любой тепловой машины). Работа совершаемая газом в изотермических процессах:  ;
;  , где А- работа совершенная за 1 цикл. КПД идеальной тепловой машины:
, где А- работа совершенная за 1 цикл. КПД идеальной тепловой машины:  =(T1-T2)/ T1
=(T1-T2)/ T1 
 Подставляя
Подставляя  и интегрируя, мы получим
и интегрируя, мы получим
 — вероятность обладания которой любой молекулой системы максимальна, и которая соответствует максимальному значению
— вероятность обладания которой любой молекулой системы максимальна, и которая соответствует максимальному значению  . Чтобы найти её, необходимо вычислить
. Чтобы найти её, необходимо вычислить  , приравнять её нулю и решить относительно
, приравнять её нулю и решить относительно 



